Benralizumab v terapii těžkého eozinofilního astmatu
Souhrn:
Koukalová E, Hutyrová B. Benralizumab v terapii těžkého eozinofilního astmatu. Remedia 2020; 30: 485–488.
Astma je v současné době onemocněním, které je poměrně dobře kontrolovatelné konvenční terapií. Existuje skupina nemocných s těžkým refrakterním astmatem, u nichž nadále zůstává dosažení kontroly nad onemocněním výzvou. V posledním desetiletí se zde uplatňuje, tak jako v jiných oborech medicíny, biologická léčba. Nedílnou součástí indikace této finančně náročné terapie je fenotypizace astmatu nemocného, jedná se tedy o personalizovaný přístup v léčbě. Jedním ze schválených biologik pro léčbu těžkého eozinofilního astmatu je benralizumab – monoklonální protilátka proti alfa podjednotce receptoru pro interleukin 5 (anti‑IL‑5Rα). Klinické studie potvrzují účinnost benralizumabu u pacientů s těžkým refrakterním eozinofilním astmatem (se zánětem typu 2). Bylo prokázáno snížení počtu exacerbací, významné zlepšení plicních funkcí (FEV1), zmírnění astmatických symptomů a zlepšení kvality života astmatiků. Pacienti léčení benralizumabem mohou významně redukovat dávku systémových kortikosteroidů, nebo jejich podávání dokonce ukončit. Rovněž byla potvrzena vysoká bezpečnost a snášenlivost biologika. V současnosti je dostupná i subkutánní forma přípravku k autoaplikaci předplněnou stříkačkou.
Summary:
Koukalova E, Hutyrova B. Benralizumab in the treatment of severe eosinophilic asthma. Remedia 2020; 30: 485–488.
Asthma is currently relatively well‑controlled disease with conventional therapy. However, there is a group of patients with severe refractory asthma where the sufficient control stays a challenge for the clinicians. Biological treatment is applied in these cases over the past decade. The important part of indication for this expensive therapy is the determination of asthma phenotype. One of the monoclonal antibodies approved for the treatment of severe eosinophilic asthma is benralizumab – the target structure is alpha‑subunit of the receptor for interleukin 5 (anti‑IL‑5Ra). Clinical trials confirm efficacy of benralizumab in the treatment of patients with severe type 2 asthma. Benralizumab reduces the number of exacerbations, improves lung functions, asthma symptoms and quality of life. A significant reduction in daily oral corticosteroids (OCS) is reached or patients completely finish using OCS. Also the high safety and tolerance of benralizumab was proved. Nowadays, patients can apply subcutaneous injection of this product at home.
Key words: severe eosinophilic asthma, monoclonal antibodies, receptor for interleukin 5, benralizumab.
Úvod
Asthma bronchiale je heterogenní chronické zánětlivé onemocnění dýchacích cest. Patogenetickým korelátem je chronický zánět průdušek spojený s bronchiální hyperreaktivitou a variabilní, často reverzibilní obstrukcí dýchacích cest. Kromě bronchokonstrikce se na ní podílí edém a produkce vazkého hlenu, nezastupitelnou úlohu hrají četné buňky zánětu a jejich cytokiny. Klinickým korelátem astmatu jsou opakující se epizody dušnosti, pískotů, tíže na hrudi a kašle, které odrážejí bronchiální hyperreaktivitu [1]. Podle současných znalostí je možno pacienty s astmatem zařadit do určitých fenotypů definovaných klinickými a morfologickými charakteristikami, jako jsou např. doba vzniku onemocnění, atopická osobní či rodinná anamnéza, eozinofilie, sérové koncentrace imunoglobulinu E (IgE), plicní funkce, odpověď na terapii kortikoidy při exacerbacích, kouření, obezita atd. Fenotyp vzniká interakcí genotypu a zevního prostředí [2].
Terapie těžkého astmatu
Astma je v současnosti u většiny pacientů kontrolovatelné konvenční terapií, tzn. inhalačními kortikosteroidy (IKS), případně v kombinaci s dlouhodobě působícími β2 agonisty (long acting β2 agonists, LABA), antileukotrieny, teofyliny, dlouhodobě působícími antagonisty muskarinových receptorů (long acting muscarinic receptors antagonists, LAMA). Ovšem zůstává skupina pacientů s těžkým refrakterním astmatem, kteří nedosahují kontroly onemocnění touto konvenční terapií. Podle studie FOSCA z roku 2016 v České republice tvoří asi 6–8 % pacientů s astmatem [3]. Fenotypově se jedná o heterogenní skupinu nemocných se zastoupením fenotypu eozinofilního alergického, eozinofilního nealergického a neeozinofilního nealergického. Eozinofilní astma, ať již alergické, či nealergické, se vyskytuje asi v 50 % případů nemocných trpících těžkým astmatem a vyznačuje se zánětem typu 2, kde důležitou roli hrají interleukiny 4, 5 a 13 (IL 4, IL 5, IL 13). U pacientů s astmatem neeozinofilním nealergickým bývá zachycen zánět neutrofilní nebo paucigranulocytární [4].
V minulosti bylo jedinou možností terapie těžkého refrakterního astmatu podání systémových kortikosteroidů (SKS), avšak s rizikem rozvoje nežádoucích účinků. V posledním desetiletí můžeme i u nás těmto pacientům nabídnout biologickou terapii, která je vázána na centra pro těžké astma. Prvním schváleným biologikem byl v roce 2008 omalizumab (anti IgE protilátka). Je indikován u pacientů s těžkým alergickým astmatem s prokázanou přecitlivělostí na celoroční alergen, kteří v posledním roce prodělali dvě nebo více těžkých exacerbací, tzn. vyžadujících léčbu SKS. Od roku 2015 byly v Evropské unii postupně registrovány humanizované monoklonální protilátky proti interleukinu 5 (anti IL 5). Interleukin 5 lze považovat za ústřední molekulu eozinofilního zánětu, který hraje klíčovou roli v patogenezi eozinofilního astmatu a jehož inhibice je žádoucím terapeutickým cílem. Interleukin 5 stimuluje diferenciaci, přežití, proliferaci, chemoatrakci a degranulaci eozinofilů. V České republice je u pacientů s těžkým refrakterním eozinofilním astmatem indikována léčba mepolizumabem (úhrada od 1. 9. 2018), reslizumabem (úhrada od 1. 5. 2019) a benralizumabem (úhrada od 22. 5. 2018).
Úhradová kritéria stanovená pro terapii anti IL 5 v současnosti jsou následující:
- periferní eozinofilie ≥ 300/µl u mepolizumabu a benralizumabu v průběhu 12 měsíců před zahájením léčby, eozinofilie ≥ 400/µl u reslizumabu;
- dodržování zákazu kouření;
- nejméně čtyři těžké exacerbace s nutností podání SKS v posledních 12 měsících navzdory dlouhodobé léčbě IKS a přídatné léčbě nebo dlouhodobé užívání SKS v dávce nejméně 5 mg prednisonu denně v souhrnu alespoň 6 měsíců v posledních 12 měsících [5,6].
Benralizumab – mechanismus
účinku
Benralizumab je řazen do skupiny anti IL 5 protilátek, ale neváže se na IL 5 přímo (na rozdíl od mepolizumabu a reslizumabu), nicméně cílí na alfa řetězec receptoru pro IL 5 (IL 5Rα) na eozinofilech a bazofilech. Funkčně se tak benralizumab významně liší od obou zmiňovaných anti IL 5 biologik. Jedná se o humanizovanou IgG1κ monoklonální protilátku proti IL 5Rα připravenou pomocí hybridomové technologie. Vysoce afinitní interakce mezi benralizumabem (jeho Fab oblastí) a IL 5Rα brání vazbě IL 5 na jeho receptor a jeho následné heterodimerizaci, čímž je zabráněno stimulaci signalizačních mechanismů spojených s aktivací eozinofilů (prostřednictvím Janusových kináz 2 a aktivátorů transkripce STAT1, 3, 5). Kromě toho se benralizumab váže také prostřednictvím konstantního fragmentu Fc k receptoru FcγRIIIα na buněčné membráně přirozených zabíječských buněk (natural killer – NK buněk), čí
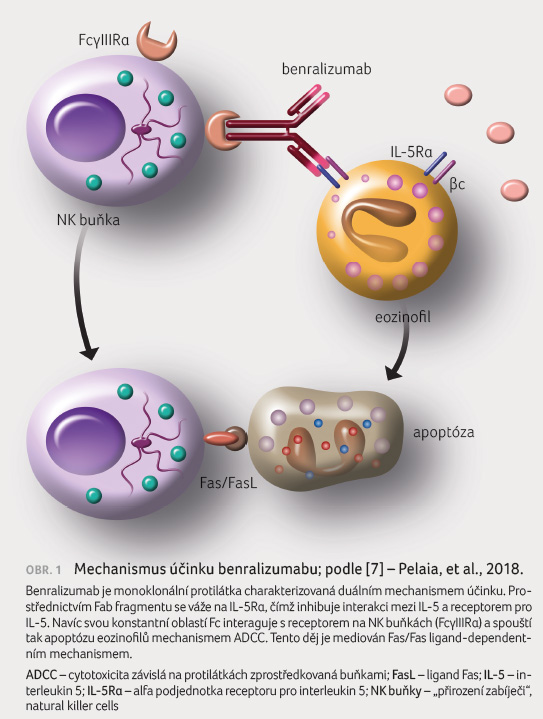
mž indukuje apoptotický mechanismus označovaný jako cytotoxicita závislá na protilátkách zprostředkovaná buňkami (antibody dependent cell cytotoxicity, ADCC), obr. 1 [7]. Benralizumab je tudíž silným induktorem eozinofilní apoptózy, která je spouštěna uvolněním proapoptotických proteinů perforinu a granzymu B z NK buněk. Tento duální mechanismus působení benralizumabu vede k rychlé depleci eozinofilů a jejich prekurzorů jak v dýchacích cestách, tak v periferní krvi a kostní dřeni, a to již do 24 hodin po prvním podání léčiva. Z podstaty regulované apoptotické smrti eozinofilů nedochází k neřízenému uvolnění obsahu cytotoxických granul ani k poškození tkáně [9,10].
Klinické studie s benralizumabem
Klíčovou pro schválení benralizumabu (Food and Drug Administration 11/2017 a European Medicines Agency 1/2018, Fasenra, AstraZeneca) jako přídatné biologické léčby těžkého eozinofilního astmatu byla série několika studií fáze III zahrnutých do klinického programu WINDWARD (studie SIROCCO, CALIMA, ZONDA, BORA, BISE a GREGALE).
Po dobu 28–56 týdnů byli hodnoceni pacienti ve věku 12–75 let v paralelních skupinách v rámci randomizovaných dvojitě zaslepených a placebem kontrolovaných studií SIROCCO, CALIMA a ZONDA. Jako vhodný režim aplikace biologika byla vyhodnocena dávka 30 mg subkutánně (s.c.) 1× za 4 týdny pro první 3 dávky a dále 1× za 8 týdnů, neboť nebyl pozorován žádný další přínos při častějším podávání.
Exacerbace byly sledovány v rámci studií SIROCCO a CALIMA. Bylo zařazeno celkem 2 510 pacientů s těžkým nekontrolovaným astmatem s anamnézou dvou nebo více těžkých exacerbací vyžadujících SKS v posledních 12 měsících a sníženou výchozí hodnotou plicních funkcí před bronchodilatací i navzdory pravidelné léčbě vysokými dávkami IKS (SIROCCO) nebo středními či vysokými dávkami IKS a LABA (CALIMA). Pro zařazení do studie nebyla podmínkou žádná prahová hodnota počtu eozinofilů.
V obou studiích bylo doloženo významné snížení roční míry exacerbací u pacientů léčených benralizumabem ve srovnání s placebem, a to bez ohledu na prahovou hodnotu počtu eozinofilů v krvi. Nicméně v rámci post hoc analýzy byly vyšší vstupní hodnoty eozinofilů v krvi (≥ 300 buněk/μl) identifikovány jako potenciální prediktor lepší odpovědi na léčbu. Zároveň bylo v této skupině zaznamenáno při srovnání s výchozí hodnotou i významné zlepšení hodnot usilovné vitální kapacity plic (forced expiratory volume in 1 second, FEV1) již ve čtvrtém týdnu a toto zlepšení převažovalo až do konce léčby. V další post hoc analýze byl prokázán výraznější účinek benralizumabu na redukci počtu exacerbací u populace astmatiků, jejichž vstupní hodnoty eozinofilů v periferní krvi nedosahovaly 300 buněk/μl, pokud zároveň užívali SKS (vliv KS) nebo trpěli nazálními polypy. Účinek benralizumabu nebyl závislý na hodnotách IgE a na přítomnosti atopické reaktivity [8]. V obou studiích zaznamenali pacienti ve skupině s benralizumabem signifikantní zmírnění astmatických symptomů, zlepšení kvality života dle dotazníků Asthma Control Questionnaire 6 a Standardised Asthma Quality of Life Questionnaire for 12 Years and Older [11,12].
Studie ZONDA hodnotila vliv benralizumabu na snížení udržovací dávky SKS (8–40 mg denně, medián 10 mg). U 52 % astmatiků bylo možné ve 28. týdnu ukončit podávání SKS bez ztráty kontroly nad chorobou. U ostatních došlo k signifikantnímu snížení jejich dávky. Celkově mohli astmatici léčení benralizumabem redukovat dávku SKS průměrně o 75 %. Co se týče exacerbací, benralizumab snížil jejich roční incidenci o 70 % při osmitýdenním intervalu subkutánní aplikace.
Na registrační studie navázala významná studie BORA; dlouhodobá aplikace benralizumabu po dobu 108 týdnů zde potvrdila vysokou bezpečnost a snášenlivost této léčby [13].
V další studii – GREGALE – bylo úspěšně léčeno 116 pacientů trpících těžkým astmatem; léčba byla podávána v domácích podmínkách předplněnými injekčními stříkačkami k subkutánní aplikaci. Přípravek je díky vysoké bezpečnosti a vhodnému dávkování možno podávat formou autoaplikace, která je již schválena registračními agenturami.
Indikace a způsob podání
Benralizumab je indikován jako přídatná udržovací léčba dospělých pacientů (v USA u pacientů ve věku od 12 let) s těžkým eozinofilním astmatem, kteří nejsou adekvátně kontrolováni vysokými dávkami IKS a LABA. Doporučená dávka benralizumabu je 30 mg aplikovaných subkutánní injekcí 1× za 4 týdny pro první 3 dávky a dále 1× za 8 týdnů.
Biologikum je indikováno k dlouhodobé léčbě a není určeno k léčbě akutních exacerbací astmatu. Pokračování v léčbě má být posuzováno alespoň jednou ročně na základě závažnosti onemocnění, úrovně kontroly exacerbací a počtu eozinofilů v krvi. Po subkutánním podání byl doložen poločas absorpce léku 3,6 dne, biologická dostupnost 59 % bez významného rozdílu při subkutánní aplikaci do kožní řasy břicha, stehna nebo horní části paže. Eliminační poločas je přibližně 15 dnů. Před podáním by měl být benralizumab (přípravek Fasenra) ponechán 30 minut při pokojové teplotě, lék je možné podat do 24 hodin. Přípravek je doporučeno uchovávat v chladničce (2–8 °C) a neměl by projít mrazem. Balení obsahuje jednu předplněnou injekční stříkačku pro jednorázové použití, doba použitelnosti je poměrně dlouhá, tři roky.
Data pro léčbu benralizumabem v průběhu gravidity jsou v současnosti zatím omezená (méně než 300 případů těhotenství dle Souhrnu údajů o přípravku). Studie na zvířatech neprokázaly reprodukční toxicitu. Aplikaci přípravku těhotným je třeba zvážit pouze tehdy, pokud je očekávaný přínos pro matku větší než jakékoliv riziko pro plod. Definitivní rozhodnutí tedy spočívá na ošetřujícím lékaři po domluvě s gravidní astmatičkou. Z hlediska kojení není známo, zda se benralizumab vylučuje do mateřského mléka [5].
Eozinofily se mohou podílet na imunologické odpovědi na některé helmintické infekce, proto mají být pacienti s helmintózou před zahájením terapie benralizumabem nejprve vyléčeni. Pokud jsou pacienti infikováni během léčby benralizumabem a nereagují na antihelmintickou léčbu, má být léčba benralizumabem přerušena.
Bezpečnost a snášenlivost léčby
Nejčastějšími nežádoucími účinky, jejichž frekvence byla hodnocena jako častá, byly dle klinických studií faryngitida, bolest hlavy, reakce v místě vpichu až hypersenzitivní reakce charakteru kopřivky. Ve srovnání s placebem se např. reakce v místě vpichu (bolest, erytém, pruritus, papula) vyskytovaly u pacientů léčených benralizumabem ve 2,2 % ve srovnání s frekvencí 1,9 % u pacientů s aplikací placeba [14]. V případě hypersenzitivní reakce je třeba trvale přerušit léčbu benralizumabem a zahájit vhodnou léčbu. Letální anafylaxe není v souvislosti s léčbou benralizumabem vůbec popsána [5,13,15].
Závěr
Biologická léčba monoklonálními protilátkami přináší nemocným s těžkým refrakterním bronchiálním astmatem novou kvalitu života. Dle výsledků studií představuje léčba benralizumabem největší přínos pro nemocné s odpovídajícím fenotypem, jedná se tedy o léčbu vysoce personalizovanou. Úhradová kritéria odrážejí výsledky studií a umožňují podávání této nákladné terapie nejtěžším pacientům, jejichž astma se nezdařilo dostat pod kontrolu konvenční terapií či za cenu nezanedbatelných nežádoucích účinků systémové kortikoterapie. Dle aktuálních doporučení GINA (Global Initiative for Asthma) je biologická léčba předřazena dlouhodobé léčbě SKS [16]. Benralizumab jakožto jediná monoklonální protilátka proti receptoru pro IL 5 zajišťuje svým duálním mechanismem působení v podstatě nejkomplexnější depleci eozinofilů. Cílí tedy na klíčové hráče eozinofilního zánětu. Vzájemné srovnávání účinnosti mezi jednotlivými anti IL 5 biologiky je předmětem dalšího zkoumání.
Bezpečnostní profil benralizumabu je výborný. Výhodou může být dávkovací schéma, kdy po počátečním čtyřtýdenním intervalu jednotlivých subkutánních injekcí se pokračuje od čtvrté injekce v intervalu osmitýdenním. V současnosti je umožněna i autoaplikace v domácím prostředí, která je pro většinu nemocných akceptovatelná a v současné epidemiologické situaci představuje vítanou možnost terapie jak ze strany zdravotníků, tak především ze strany pacientů. Očekávají se výsledky studií, které posuzují, jaké účinky má benralizumab u těžkých eozinofilních astmatiků také na relevantní komorbidity astmatu, jako jsou nosní polypóza a chronická rinosinusitida (studie ANDHI) [15].
Seznam použité literatury
- [1] Kašák V. Asthma bronchiale, průvodce ošetřujícího lékaře (Farmakoterapie pro praxi), 2. vydání. Praha, Maxdorf, 2013.
- [2] Novosad J, Krčmová I. Biomarkery v léčbě bronchiálního astmatu. Postgraduální medicína 2019; 21: 344–353.
- [3] Teřl M, Pohunek P, Kuhn M, Bystroň J. Four seasons of Czech asthma study: asthma charakteristics and magement reality in the Czech Republic. J Asthma 2020; 57: 898–910.
- [4] Teřl M, Čáp P, Dvořáková R, et al. Doporučený postup diagnostiky a léčby bronchiálního astmatu, společný DP ČPFS a ČSAKI, aktualizace 2016. Dostupné na: http://pneumologie.cz/guidelines/.
- [5] Souhrn údajů o přípravku Fasenra inj. 1x1ml, s.c. Dostupné na: www.sukl.cz
- [6] Koukalová E, Hutyrová B, Bystroň, J. Biologická terapie v alergologii. Postgraduální medicína 2019; 21: 330–338.
- [7] Pelaia C, Vatrella A, Bruni A, et al. Benralizumab in the treatment of severe asthma: design, development and potential place in therapy. Drug Des Devel Ther 2018; 12: 619–628.
- [8] Chipps B, Newbold P, Hirsch I, et al. Benralizumab efficacy by atopy status and serum immunoglobulin E for patients with severe, uncontrolled asthma. Ann Allergy Asthma Immunol 2018; 120: 504–511.e4.
- [9] Kolbeck R, Kozhich A, Kolke M, et al. Medi‑563, a humanized anti‑IL‑5 receptor a mAb with enhanced antibody‑dependent cell mediated cytotoxicity function. J Allergy Clin Immunol 2010; 125: 1344–1353.
- [10] Ghazi A, Trikha A, Calhoun WJ. Benralizumab – A humanized mAb to IL‑5Rα with enhanced antibody‑dependent cell‑mediated cytotoxicity – A novel approach for the treatment of asthma. Expert Opin Biol Ther 2012; 12: 113–118.
- [11] Bleecker ER, FitzGerald JM, Chanez P, et al. Efficacy and safety of benralizumab for patients with severe asthma uncontrolled with high‑dosage inhaled corticosteroids and long‑acting ß2‑agonists (SIROCCO): a randomised, multicentre, placebo‑controlled phase 3 trial. Lancet 2016; 388: 2115–2127.
- [12] FitzGerald JM, Bleecker ER, Nair P, et al. Benralizumab, an anti‑interleukin‑5 receptor α monoclonal antibody, as add‑on treatment for patients with severe, uncontrolled, eosinophilic asthma (CALIMA): a randomised, double‑blind, placebo‑controlled phase 3 trial. Lancet 2016; 388: 2128–2141.
- [13] Busse WW, Bleecker ER, FitzGerald JM, et al. Long‑term safety and efficacy of benralizumab in patients with severe, uncontrolled asthma: 1‑year results from the BORA phase 3 extension trial. Lancet Respir Med 2019; 7: 46–59.
- [14] Liu T, Wang F, Wang G, et al. Efficacy and safety of benralizumab in patiens with eosinophilic asthma: a meta‑analysis of randomized placebo‑controled trials. Front Med 2018: 12: 340–349.
- [15] Krčmová I, Novosad J, Sedlák V. Benralizumab – profil léku a první klinická zkušenost. Farmakoterapie 2019; 15: 500–509.
- [16] Global Strategy for Asthma Management and Prevention, Global Initiative for Asthma (GINA), 2019. Dostupné na: http://www.ginasthma.org/.