Bimekizumab – rychlá a účinná léčba psoriázy cílící na patofyziologii onemocnění
Ve dnech 26. a 27. ledna letošního roku proběhlo v Praze launchovací sympozium společnosti UCB, které registrované přítomné i online účastníky zevrubně seznámilo s novým biologickým lékem pro terapii psoriázy bimekizumabem (Bimzelx). Bimekizumab byl Evropskou lékovou agenturou schválen v srpnu 2021 a v České republice má úhradu od 1. listopadu 2022. Psoriáza je systémové onemocnění, které výrazně snižuje kvalitu života pacientů. Právě biologická terapie představuje v péči o tyto nemocné významný pokrok a bimekizumab vzhledem k duálnímu mechanismu působení by mohl výrazně zlepšit kontrolu nad tímto závažným a obtěžujícím onemocněním.
Úvod
Edukační sympozium sestávalo ze dvou bloků, v prvním vystoupilo se svými příspěvky pět odborníků, kteří bimekizumab představili podrobně z hlediska mechanismu účinku, z hlediska imunologického a klinického. První blok doprovázela průběžně zajímavá diskuse. Jádro druhého bloku tvořila panelová diskuse, v němž poznatky z prvního dne stručně shrnuli a doplnili dermatologové z několika odborných pracovišť. Součástí sdělení byly také první praktické zkušenosti s léčbou bimekizumabem. Užitečné poznatky přinesla závěrečná prezentace zaměřená na sociálně právní aspekty léčby psoriázy. Odborné setkání moderovali profesor MUDr. Spyridon Gkalpakiotis, Ph.D., MBA, a odb. as. MUDr. Martin Tichý, Ph.D.
Bimekizumab – lék s unikátním mechanismem účinku
Mechanismu působení bimekizumabu věnoval svoji přednášku (Bimzelx - Introduction of a new and unique mode of action) profesor Dr. med. Diamant Thaçi z Institute and Comprehensive Center for Inflammation Medicine Univerzity v Lübecku, Německo.
Management léčby psoriázy prošel od osmdesátých let 20. století dynamickým rozvojem, který reagoval na porozumění patofyziologii tohoto onemocnění. Právě toto porozumění vede k inovacím v léčbě.
K prozánětlivým cytokinům, které se uplatňují v patogenezi psoriázy, patří interleukin (IL) 17, IL‑23 a IL‑36. Jejich rozdílné mechanismy působení hrají roli v rozvoji různých typů psoriázy – plakové, pustulózní či tzv. paradoxní (psoriáza indukovaná inhibitory tumor nekrotizujícího faktoru, TNF). Prozánětlivé cytokiny jsou produkovány funkčně polarizovanými T lymfocyty (především do subsetů pomocných T lymfocytů Th1, nověji byla doložena také úloha Th17), kdy prostřednictvím vazby na receptor dochází ke spuštění řady signálních drah, tvorbě prozánětlivých chemokinů a dalších biologicky aktivních látek.
Klíčové v rozvoji psoriázy jsou signální dráhy IL‑23 a IL‑17 [1,2]. Ze zacílení na inhibici těchto drah vychází řada biologických léků: v případě IL‑23 jsou to risankizumab, guselkumab či tildrakizumab, v případě IL‑17 secukinumab, ixekizumab či brodalumab. Rodina IL‑17 se skládá minimálně ze šesti strukturně podobných cytokinů – IL‑17A-F. Interleukiny 17A a 17F signalizují prostřednictvím stejného receptorového komplexu. Na duální inhibici IL‑17A a IL‑17F je založen mechanismus účinku bimekizumabu. Tyto dva interleukiny jsou sekretovány aktivovanými Th17 lymfocyty ve formě homodimerů (IL‑17A/A, IL‑17F/F), nebo heterodimeru (IL‑17A/F) [3,4]. Recentní názory ukazují, že IL‑17F hraje roli v patogenezi psoriázy společně s IL‑17A právě ve formě uvedených tří dimerů. Interleukin 17A silněji řídí rozvoj psoriázy, IL‑17F je v mnohem větší míře obsažen v psoriatických lézích. Jsou produkovány odlišnými populacemi lymfocytů adaptivní a přirozené imunity, ale mají mnoho podobností [1,2,5].
Sekvenování jednotlivých buněk ukazuje odlišné populace buněk produkujících IL‑17A/A, IL‑17F/F a IL17‑A/F [6]. Pokud tedy léčbou blokujeme pouze IL‑17A/A, míjíme IL‑A/F, pokud se soustředíme jen na IL‑17A/F, můžeme míjet IL‑17F/F. Z tohoto důvodu je důležité inhibovat všechny procesy, které v rámci onemocnění probíhají.
Nově bylo zjištěno, že populace lymfocytů přirozené imunity označované jako ILC3 (přirozené lymfoidní buňky typu 3) a γδ T lymfocyty rovněž produkují IL‑17A a IL‑17F. Je velmi důležité pro praxi, že zde funguje mnoho buněčných zdrojů pro IL‑17A a IL‑17F, které představují nepřímé dráhy pro aktivaci těchto interleukinů. Buňky ILC3 a γδ T lymfocyty fungují nezávisle na ose IL‑23 a produkují převážně IL‑17F. Jestliže tedy experimentálně blokujeme IL‑23, stále přetrvává působení IL‑17F a nedochází ke zmírnění projevů onemocnění [1,2,7-11]. „V rámci zkoumání psoriázy se tedy dozvídáme nejen mnoho nového o její patogenezi, ale také o dalších cytokinech a jejich roli v zánětlivém procesu. Mění se tím i naše přemýšlení o nemoci a je velmi důležité vědět, proč někteří pacienti neodpovídají na určitou léčbu, ale mohou odpovídat na léčbu jinou,“ uzavřel první část přednášky profesor Thaçi.
Shrnutí role rodiny IL‑17 v rozvoji psoriázy
Působení IL‑17A a IL‑17F se překrývá a oba centrálně řídí zánět u psoriázy. Interleukin 17F je méně potentní než IL‑17A, vyskytuje se však v kožních lézích v mnohem větší míře a může řídit zánět nezávisle na IL‑17A. Produkce IL‑17A a IL‑17F nezávislá na ose IL‑23 odpovídá zánětu zprostředkovanému IL‑17.
Duální inhibice
Bimekizumab je humanizovaná monoklonální protilátka IgG1 vyvinutá pro selektivní inhibici IL‑17A a IL‑17F. Látka má inovativní uspořádání s duální specificitou pro IL‑17A a IL‑17F a s vysokou afinitou pro tyto interleukiny (obr. 1). Cílí na tři dimery: IL‑17A/A, IL‑17A/F, IL‑17F/F [3,12,13].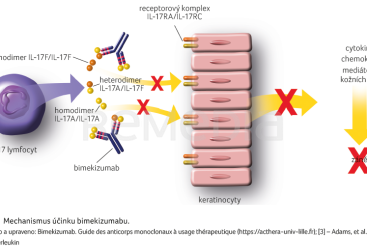
Inhibitory IL‑17A efektivně neutralizují dimery IL‑17A/A a IL‑17A/F. Experimentem in vitro byl bimekizumab porovnáván se secukinumabem a ixekizumabem a bylo doloženo, že bimekizumab inhibuje navíc k IL‑17A/A a IL‑17A/F také IL‑17F/F. Poměr IL‑17A a IL‑17F je velmi důležitý u onemocnění zprostředkovaných IL‑17. Samotná inhibice IL‑17A je účinná při poměru IL‑17A a IL‑17F 1 : 1. Avšak pokud je mnohem vyšší koncentrace IL‑17F, je třeba jej více blokovat. V případě psoriázy je tento poměr 1 : 30, z tohoto důvodu je tedy působení bimekizumabu na onemocnění mnohem efektivnější než samotná inhibice IL‑17A (např. ixekizumab) [3].
Bimekizumab redukuje prozánětlivou expresi genů v lidských buňkách. Pokud inhibujeme pouze IL‑17F, nebo pouze IL‑17A, je potlačena aktivita jen u některých prozánětlivých genů. Jestliže jsou blokovány oba interleukiny, dochází k mnohem podstatnější supresi prozánětlivých genů [13]. Na několika modelech bylo demonstrováno, že bimekizumab potlačuje expresi genů asociovaných s psoriázou ve významnější míře než samotná inhibice IL‑17A [14]. U psoriázy IL‑17A a IL‑17F podporují migraci neutrofilů cestou IL‑8. Interleukin 8 produkovaný keratinocyty je chemoatraktantem pro neutrofily u psoriázy a neutrofily jsou akumulovány v psoriatických lézích [13,15]. Bimekizumab inhibuje migraci buněk adaptivní (T lymfocyty) a přirozené (neutrofily, monocyty ad.) imunity účinněji než samotná blokáda IL‑17A [16]. Dále byla provedena transkriptomová analýza psoriatických plaků po léčbě bimekizumabem (explorativní studie fáze II), která zahrnula 49 pacientů s psoriázou léčených dvěma dávkami bimekizumabu jednou za čtyři týdny. Kožní biopsie byla odebrána na začátku léčby a v osmém týdnu [17]. Bimekizumab byl úspěšný v rychlé normalizaci kožních lézí a v normalizaci exprese cytokinových genů IL‑17 a IL‑23 (pokud je inhibován IL‑17, nastává zároveň downregulace genů IL‑23). Léčba bimekizumabem normalizuje IL‑17 responzivní geny u psoriázy. Proto vidíme tak rychlý léčebný efekt v denní praxi.
„Terapeutická inovace s těmito cytokiny může pokračovat i mimo oblast psoriatického onemocnění. Rozvíjející se klinická evidence například dokládá, že IL‑17 a IL‑23 hrají nezanedbatelnou roli v imunitní odpovědi na rozvoj nádoru zapojením poškozujícího zánětu do nádorového mikroprostředí [18,19]. Psoriáza je spojena s řadou komorbidit a pacienti mohou mít například právě zvýšené riziko rozvoje malignit. V této souvislosti můžeme tedy spekulovat do budoucna,“ vysvětlil profesor Thaçi.
Shrnutí k duální inhibici u bimekizumabu
Bimekizumab je jedinou monoklonální protilátkou, která selektivně inhibuje IL‑17A i IL‑17F. Inhibice IL‑17F společně s IL‑17A je výrazně účinnější oproti cílení pouze na IL‑17A, jak doložily ověřovací testy s lidskými buňkami, včetně produkce cytokinů, migrace buněk a exprese genů asociovaných s psoriázou. Společná inhibice IL‑17F a IL‑17A prokázala navíc v rámci těchto testů výrazně rychlou normalizaci kožních lézí u pacientů s psoriázou.
Patogeneze psoriázy z pohledu imunologa
„Zánět je komplexní reakce, která by měla napravit to, co se v našem těle stalo špatně,“ uvedl svoji přednášku profesor RNDr. Jan Krejsek, CSc., (Ústav klinické imunologie a alergologie, LF UK a FN Hradec Králové). Za normálních okolností převáží složka ochranná nad poškozující, u imunopatologických nemocí tomu tak ale není. Imunitní systém je zásadní součástí obranného i poškozujícího zánětu, určitě to však není jediná součást. Iniciaci, průběh a ukončení imunitní reakce v našem imunitním systému určuje kontext.
Ideální stav, v němž by naši homeostázu nic nenarušovalo a byli bychom vystaveni pouze signálům bezpečí, v podstatě nemůže nastat - znamenalo by to, že naše imunita nefunguje dobře. Jak tedy rozumíme zánětlivé reakci? Naše tělo je vystaveno vzorům vnějšího nebezpečí (pathogen‑associated molecular pattern, PAMP; mikrobiální invaze atd.) a vzorům vnitřního poškození (damage‑associated molecular pattern, DAMP), které jsou spojeny s poškozením vlastních struktur. Vzory DAMP i PAMP jsou rozpoznávány skupinou receptorů PRR (pattern recognition receptors), které mají zajistit určitou reakci našeho těla. Zánět musí být na všech úrovních velmi silně regulován a do této homeostatické regulace se zapojuje řada dalších soustav včetně kůže. Na konci uvedeného procesu je odstranění příčiny, reparace a obnova homeostázy.
Zaznamenáváme obrovské pokroky v poznání molekulární biologie a biologie buňky, která se podílí na zánětlivé reakci. Naše buňky jsou vyzbrojeny na povrchu, ale také uvnitř řadou receptorů, které jsou přesně popsány. Tyto receptory jsou schopny identifikovat signály nebezpečí nebo poškození a vytvářejí se složité molekulární komplexy, jež označujeme jako adaptasomy. Aktivují se nitrobuněčné signální dráhy včetně aktivace transkripčních faktorů, které se přesunují do jádra buňky a spustí zde přepis genů.
Aktivace, expanze a polarizace T lymfocytů
„Vrozená imunita, kterou jsme ještě před deseti lety považovali za primitivní, evolučně starou nebo zbytečnou, rozhoduje o tom, jak naše tělo bude obranný, případně poškozující zánět regulovat,“ upozornil profesor Krejsek. Její součástí jsou dendritické buňky, které jsou nejlépe vybaveny PRR a mají největší kapacitu identifikovat DAMP nebo PAMP, po internalizaci je uvnitř sebe zpracovat a předkládat je T lymfocytům v určitém kontextu. Dendritické buňky různých podtypů prezentují antigenní peptidy T lymfocytům, které mají příslušný receptor (T cell receptor, TcR). Většina našich T lymfocytů má heterodimer TcRαβ a rozpoznává peptidy – antigeny zpracované a odvozené od bílkovin, jež internalizovaly dendritické buňky. T lymfocyty s receptorem TcRγδ jsou velmi unikátní ve schopnosti rozpoznávat nebílkovinné antigeny. Tato skupina buněk je ve zvýšené míře přítomna také ve slizničních rozhraních a v kůži a je schopna rozpoznat nekonvenční antigenní podněty v dobrém i ve špatném kontextu. T lymfocyt, který rozpoznal antigenní podnět ve správném kontextu, klonálně expanduje. Po klonální expanzi podle momentálních potřeb našeho těla dochází k funkční polarizaci do různých subsetů T lymfocytů.
Funkční polarizace (subsetů CD4+ T lymfocytů) je spojena s aktivitou prezentujících dendritických buněk, ale v polarizovaných T lymfocytech je to proces, který zahrnuje určité skupiny transkripčních faktorů. Jsou to transkripční faktory, které zajistí aktivační přenosy z receptorových struktur a rozhodnou o tom, do kterého polarizovaného subtypu T lymfocytů bude buňka aktivována (subsety Th1, Th2, Th17, Treg).
T lymfocyty subsetu Th17 jsou klíčovou součástí nejen poškozujícího, ale rovněž obranného zánětu. Pokud se v určitém kontextu vymknou z homeostatických regulací, stanou se nebezpečnými (psoriáza, roztroušená skleróza, Crohnova choroba a další imunopatologická onemocnění). Fyziologicky polarizace do subsetu Th17 má posílit naše obranné bariéry na kůži a na epitelech. Je to pozitivní reakce našeho těla. V obranném zánětu umíme Th17 lymfocyty podle aktuálních potřeb polarizovat a poté zase utlumit, v poškozujícím zánětu se regulační složky ztrácejí.
Kůže a její základní funkce, poškozující zánět u psoriázy
Kůže je největším orgánem našeho těla, strategickým rozhraním, které nás odděluje od vnějšího světa. Je to komplexní orgánová soustava, která má řadu funkcí - chrání nás před chemickými/fyzikálními noxami, invazí patogenů, únikem vody/iontů, má termoregulační funkce. Kůže je charakterizována anatomickou a funkční propojeností s informačními soustavami nervovou/endokrinní/imunitní. K jejím základním charakteristikám patří přirozená mikrobiota, vícevrstevnost, průběžná obnova a diferenciace buněčných složek, mezibuněčné spoje různých typů, lipidové substance ve vnějších vrstvách, cévní zásobení, inervace.
Každý člověk má určité genetické predispozice, které ovládají biologii kůže, i genetické predispozice, které ovládají imunitní systém. Genetickou danost však můžeme ovlivnit negativně i pozitivně, např. přepisem genů prostřednictvím epigenetických mechanismů, komunikací, především s vnějším světem. Na procesu se podílí také systém neuroendokrinních regulací a na konci ve spolupráci s mikrobiotou obranný nebo poškozující zánět.
Psoriáza je systémové zánětlivé onemocnění s převahou kožních (kloubních) projevů, které provází řada komorbidit. Do rozvoje onemocnění je zapojeno mnoho subsetů dendritických buněk, makrofágů, ve hře u poškozujícího zánětu jsou funkčně polarizované T lymfocyty (Th1/Th17/Th22 a další), jež vyvažuje homeostatické působení Treg. Objektivizace aktivity onemocnění je prováděna prostřednictvím indexu PASI (Psoriasis Area and Severity Index).
Poškozující zánět u psoriázy je pravděpodobně iniciován v kůži (inzultem fyzikálním, chemickým, infekčním atp.). Aktivují se rezidentní imunocyty, přičemž klíčová úloha je dána dendritickým buňkám. Ty jsou řízeně posílány do sekundárních lymfatických tkání (migrace), kde se setkávají se specifickými T lymfocyty, jež aktivují ke klonální expanzi a funkční polarizaci. Poté cíleně migrují do postižené kůže, kde amplifikují poškozující zánět. Do procesu vstupují další buněčné složky poškozujícího zánětu a podílí se na něm i patologická aktivace keratinocytů.
Podskupina myeloidních dendritických buněk CD11c+ je připravena na to, aby předávala prozánětlivé informace T lymfocytárnímu systému u nemocných s psoriázou. Roli zde hrají tzv. Toll like receptory, které se nacházejí na povrchu i uvnitř našich buněk (např. v endosomálním kompartmentu), a také řada dalších receptorů. Jsou‑li tyto receptory obsazeny odpovídajícími PAMP nebo DAMP, je sestaven signalisom a geny jsou prostřednictvím transkripčního faktoru, především NFκB, aktivovány k přepisu.
Specifický subset Th0 je schopen rozpoznat podněty zprostředkované dendritickou buňkou. Tato buňka pak klonálně expanduje a funkčně se polarizuje do základních subsetů, které hrají úlohu v patogenezi psoriázy. Subset Th1 tvoří především interferon gama (IFNγ) a poté TNFα. Aby takto funkčně polarizovaly také Th17 lymfocyty, musejí být vystaveny určitým cytokinům (IL‑17A/F, TNFα, IL‑6, IL‑22) a mají určité chemokinové receptory, které zajistí, že ze sekundárních lymfatických orgánů migrují do kůže, kde splní negativní úlohu. Stále trochu mimo stojí subset Th22 lymfocytů, které mají zvláštní schopnost - přes receptory pro arylované hydrokarbony, jež jsou schopny identifikovat různé chemické substance, často i s karcinogenním potenciálem, spustit zánět v kůži s cílem ochrany před těmito nebezpečnými látkami.
Myeloidní dendritické buňky jsou mj. ovládány IL‑23, který je složen ze dvou podjednotek, z nichž jedna je sdílena rovněž s IL‑12 (který je cílem jiných biologických léků). Interleukin 23 završuje polarizaci k subsetu Th17, který prostřednictvím cytokinů IL‑17A a IL‑17F vyústí v poškozující zánět v kůži nemocných s psoriázou.
Rodina cytokinů IL‑17
Jak už bylo řečeno, podle současných znalostí zahrnuje rodina IL‑17 šest členů (IL‑17A až IL‑17F). V patogenezi psoriázy jsou experimentálními důkazy nejvýznamněji doloženy IL‑17A a IL‑17F. Receptory jsou membránové heterodimery, které mají společný řetězec IL‑17RA a proměnlivý beta řetězec. Buněčnými zdroji cytokinů IL‑17 jsou: 1) specifická imunita - T lymfocyty polarizované do subsetu Th17, T lymfocyty CD8+, T lymfocyty subsetu TcRγδ; 2) vrozená imunita - neutrofilní granulocyty, ILC3, makrofágy, mastocyty.
Interleukin 17A je odpovědný za iniciaci poškozujícího zánětu, IL‑17F je řádově méně biologicky potentní než IL‑17A, ale v psoriatické lézi je produkován ve značné míře. Blokáda IL‑17F (IL‑17A/IL‑17F) tlumí efektivně poškozující zánět v psoriáze.
V odpovědi na IL‑17A/IL‑17F dochází k deregulované proliferaci keratinocytů (IL‑36), deregulované diferenciaci keratinocytů (Krt‑16). Vytvářejí se DAMP (tvorba antimikrobiálních peptidů – defenziny, katelicidin, LL‑37; uvolnění rodiny proteinů S100 – psoriasin); produkují chemokiny, které zajistí migraci buněk imunitního systému do poškozené kůže (CCL20, CXCL1/2/8). Dochází k akumulaci neutrofilních granulocytů a produkci prozánětlivých cytokinů.
Bimekizumab je unikátní ve schopnosti selektivně inhibovat IL‑17A a IL‑17F v homodimerech i heterodimerech. Tato humanizovaná protilátka IgG1 má vysokou afinitu k terčovým molekulám. Normalizace exprese genů regulovaných osou IL‑23/IL‑17 byla potvrzena porovnáním kůže nepostižené/postižené/postižené po léčbě u pacientů s psoriázou. Bimekizumab ovlivňuje proliferaci keratinocytů, snižuje produkci kalcium vázajících proteinů včetně psoriasinu, zasahuje do tvorby regulačních cytokinů (IL‑23p19/IL‑23p40) a efektorových cytokinů (IL‑17A/IL‑17F) a inhibuje tvorbu chemokinů, které jsou odpovědné za vstup imunocytů do léze (CXCL1/8/20).
Prezentace s využitím publikace: Krejsek J, Andrýs C, Krčmová I. Imunologie člověka. Hradec Králové: Garamon, 2016.
Současný pohled na biologickou léčbu psoriázy
Profesorka MUDr. Jana Třešňák Hercogová, CSc., MHA, IFAAD, (Dermatologie prof. Hercogové s.r.o., Praha) uvedla svůj příspěvek exkurzem do minulosti: „Podle publikace amerických autorů z roku 1984 byla psoriáza považována za celoživotní onemocnění, které má vliv na emoce, kvalitu života nemocných, ale také je zajímavé to, že roční náklady na pacienta s psoriázou činily pouze 650 dolarů.“ [20]
Psoriáza je sdružena s psoriatickou artritidou, dříve jsme však nevěděli, že je rovněž příznakem řady chorob, které se k ní mohou vázat, a tudíž chceme‑li pacienty úspěšně léčit, měli bychom zohlednit všechny další konkrétní faktory. Pohled na patogenezi a léčbu psoriázy se v čase mění. První léky pro terapii psoriázy jistě nebyly systémové, často byla používána také fototerapie. Se změnou pohledu na patogenezi onemocnění – od poruchy keratinizace po imunitně podmíněný zánět – postupně přibývaly nové léky. Byly popsány první interleukiny, objevily se první inhibitory TNF a byla vyvíjena biologická léčiva [1,21-23].
Cíle léčby a kvalita života pacientů
Mnoho let pracujeme v oblasti komunikace s pacienty a ptáme se jich, jak by chtěli být léčeni. Většina nemocných by chtěla být zdravá okamžitě, bez nežádoucích účinků a se setrvalým efektem terapie. S přibýváním biologických léků se mění rovněž cíl léčby. Tyto cíle definované různými odbornými skupinami (např. National Psoriasis Foundation 2017, French Society of Dermatology 2019, British Association of Dermatologists a European Dermatology Forum/EuroGuiDerm Guidelines 2020) nejsou zdaleka jednotné. Pohybují se od PASI75 (75% zlepšení podle indexu) po PASI90 až PASI100, některé systémy zohledňují povrch kůže, jiné dotazník kvality života [24-27].
Co pro pacienty znamená rychlé zhojení kůže? Podle studií představuje ideální stav zhojení v intervalu jednoho měsíce. Pokud tuto otázku položíme pacientům, kteří už mají zkušenost s biologickou léčbou, je předpoklad rychlého efektu ještě vyšší [28]. Zhojení kůže koreluje s kvalitou života vztaženou na příslušné onemocnění. Observační údaje z reálné klinické praxe ukázaly, že 84 % dospělých pacientů (n = 846) se středně závažnou až závažnou ložiskovou psoriázou, kteří při biologické léčbě dosáhli odpovědi PASI100, uvedlo, že nepociťuje dopad onemocnění na kvalitu života související se zdravím (Health‑Related Quality of Life, HRQL) [29]. Některé situace však mají na nemocné odlišný dopad, např. postižení citlivých partií těla (obličej, genitál atp.). V případě psoriázy genitálu 95 % pacientů uvedlo vliv na náladu/emoce, 70 % na fyzické aktivity, 60 % na denní aktivity. Nemocní s palmoplantární psoriázou měli horší kvalitu života než nemocní trpící psoriasis vulgaris [30,31].
Mnoho pacientů po dlouhodobé léčbě lokálními kortikoidy nevěří, že mohou mít zcela zhojenou kůži. Podle klinických studií 95 % nemocných uvedlo, že vymizení všech kožních projevů představuje nejdůležitější cíl léčby; 56 % nemocných, kteří dosud nedosáhli zhojené nebo téměř zhojené kůže, nevědělo, že toho současná léčba umožňuje docílit [32,33].
Inhibitory IL‑17 předčily v hodnocení PASI tildrakizumab, ustekinumab a anti‑TNF přípravky. Síťová metaanalýza z roku 2019 zahrnovala řadu randomizovaných klinických studií (77 studií, téměř 35 000 pacientů sledovaných v letech 2000-2018), které prokázaly krátkodobou účinnost dostupných biologických a nebiologických přípravků u pacientů se středně závažnou až závažnou ložiskovou psoriázou. V jejich rámci byla porovnávána účinnost intervencí na dosažení různých úrovní odpovědi PASI. Ixekizumab, risankizumab, brodalumab a guselkumab vykazovaly nejvyšší úroveň odpovědi při hodnocení krátkodobé účinnosti [34,35].
Zajímavé je srovnání jednotlivých molekul mezi sebou. Dosažení PASI90 v 16. týdnu léčby bylo porovnáváno u bimekizumabu vs. placebo, ustekinumab a adalimumab [36-38]. Při léčbě bimekizumabem dosáhlo PASI90 více než 90 % pacientů oproti placebu (1,2 %), v případě ustekinumabu to bylo 85 % vs. 49,7 %, v případě adalimumabu 86,2 % vs. 47,2 %. Větší účinnost prokázal bimekizumab také v přímém (head‑to‑head) srovnání se secukinumabem. Pokud se podíváme na hodnocení PASI100, byl při srovnání inhibitorů IL‑17, IL‑23 a IL‑12/23 (např. ixekizumab vs. guselkumab, risankizumab vs. ustekinumab, bimekizumab vs. secukinumab) v klinických studiích největší podíl dosažení této odpovědi zaznamenán rovněž u bimekizumabu (62,7 %). Totéž platí pro přímé srovnání bimekizumab vs. secukinumab (v 16. týdnu 61,7 % vs. 48,9 %, ve 48. týdnu 66 % vs. 48,3 %) [36-38].
Rozdíl při léčbě inhibitory IL‑17, IL‑23 a IL‑12/23 byl zjištěn také v rychlosti účinku terapie. Z podobných studií při srovnání odpovědi PASI75 ve 2. týdnu (ixekizumab vs. guselkumab), ve 4. týdnu (risankizumab vs. placebo, secukinumab vs. ustekinumab, bimekuzumab vs. ustekinumab vyšel bimekizumab opět nejvýrazněji (77 %) [37,39–41]. Udržení PASI100 bylo do 264. týdne léčby ixekizumabem doloženo u 46,3 % pacientů, do 120. týdne léčby risankizumabem u 67 % pacientů, u secukinumabu v pátém roce u 41 % osob, v případě bimekizumabu zatím do 100. týdne léčby u 86,3 % osob [42-45].
Volba biologika
„Před rokem vydala Česká akademie dermatovenerologie Doporučené klinické postupy léčby psoriázy v ČR zahrnující biologickou terapii. Již v průběhu jednoho roku se v souvislosti s dynamickým vývojem nových biologik staly neúplnými a budou letos inovovány,“ podotkla profesorka Třešňák Hercogová [46]. Přednášející upozornila na aktualizovanou tabulku z těchto doporučených postupů, která může být pomocníkem při volbě biologika. Vedle přípravků první a druhé volby a kontraindikací uvádí rovněž komorbidity, podle nichž se v praxi přistupuje k rozhodnutí o tom, který lék u konkrétního pacienta zvolit.
V praxi je nutné řídit se také podmínkami úhrady. Bimekizumab prozatím patří do skupiny léků druhé volby, můžeme jej předepsat po předchozí léčbě dvěma konvenčními přípravky včetně fototerapie nebo po předchozí léčbě jiným biologikem [47].
Bimekizumab představuje lék, který budeme využívat v rámci personalizované medicíny, budeme vždy léčit konkrétního pacienta podle zdravotního stavu, komorbidit, věku atp. Na léčbě bimekizumabem oceníme především nižší četnost podávání (po indukci každé dva měsíce), rychlé a úplné zhojení kůže, dosažení PASI100 u vysokého podílu pacientů. Jedná se o léčbu cílenou, budeme ji tedy volit raději než klasické léky, uzavřela přednášející.
Co očekávat od moderní terapie psoriázy – rychlý nástup účinku a setrvale zhojenou kůži?
Na profesorku Třešňák Hercogovou navázal profesor MUDr. Spyridon Gkalpakiotis, Ph.D., MBA, (Dermatovenerologická klinika 3. LF UK a FN Královské Vinohrady, Praha), který se podrobněji zaměřil na výsledky klinických studií a jejich komentář pro klinickou praxi.
Studie jsou v současné době koncipovány tak, aby byly více provázané s klinickou praxí. Můžeme tedy lépe reagovat na preference našich pacientů se středně těžkou a těžkou psoriázou. Jak už uvedla profesorka Třešňák Hercogová, nemocní požadují minimálně v 90 % vysokou pravděpodobnost zhojení kůže, rychlý nástup účinku terapie a setrvalost léčebné odpovědi. Jejich přáním je, aby začaly mizet subjektivní potíže, např. svědění kůže a bolest, a aby léčba fungovala v obtížně léčitelných oblastech (kštice, ruce, genitál atd.). Pacienti očekávají úplné zhojení kůže průměrně během čtyř týdnů od zahájení systémové léčby [28]. Časná odpověď má významnou roli pro udržení setrvalého úplného zhojení kůže. To dokládají např. data ze studií s ixekizumabem – odpověď PASI50 ve druhém týdnu znamenala větší šanci na dosažení odpovědi PASI100 v porovnání s dosažením PASI50 ve čtvrtém týdnu léčby [48]. „Máme tedy prostor přemýšlet, jak pokračovat v léčbě u pacienta, který této hodnoty nedosáhl,“ doplnil přednášející.
Více než polovina pacientů nevěřila, že lze léčbou dosáhnout zhojení kůže. Ze 4 733 respondentů účastnících se průzkumu, kteří dle vlastního hlášení nedosáhli zhojené/téměř zhojené kůže, 56 % nevěřilo, že je možné tohoto cíle léčbou dosáhnout (nesouhlasilo s tím, že by toho bylo v budoucnu možné dosáhnout). Z 3 605 respondentů, kteří dosáhli zhojené kůže, 53 % nevěřilo v docílení takového výsledku, dokud se jim tohoto cíle skutečně nepodařilo dosáhnout [33]. „Snažíme se proto o osvětu, že je k dispozici účinná léčba. Pokud je pacient nedostatečně dobře léčen, měl by případně hledat jiného dermatologa či informace o tom, jaké další možnosti má k dispozici,“ okomentoval profesor Gkalpakiotis.
Úroveň zhojení kůže ovlivňuje kvalitu života související se zdravím. Skóre DLQI (Dermatology Life Quality Index) 0/1 dosáhli nejčastěji pacienti, u nichž došlo k úplnému zhojení kůže - úplné zhojení tedy představuje pro nemocné klinicky významný výsledek. To doložila např. studie, která zkoumala dosažení DLQI 0/1 v ramenech s kombinovanou léčbou v závislosti na rozmezí dosaženého zlepšení PASI v 52. týdnu [49].
Výsledky studií BE VIVID, BE READY, BE SURE, BE RADIANT
Do pivotního klinického hodnocení fáze III, které sledovalo léčbu bimekizumabem, ustekinumabem a adalimumabem vs. placebo, byli zařazeni i pacienti, u nichž selhala léčba jiným inhibitorem IL‑17 nebo TNF. Bimekizumab ukázal v pivotních klinických hodnoceních fáze III superiorní účinnost oproti komparátorům a v klinickém hodnocení fáze IIIb vyšší účinnost s ohledem na odpovědi PASI90 v 16. týdnu. Studie BE VIVID porovnávala bimekizumab s ustekinumabem, BE READY s placebem, BE SURE s adalimumabem a BE RADIANT se secukinumabem [36-38,50,51].
Bimekizumab ukázal rychlejší nástup odpovědi s ohledem na odpověď PASI90 do čtvrtého týdne. Odpověď PASI90 ve čtvrtém týdnu byla zaznamenána u pacientů, kteří po jedné dávce bimekizumabu dosáhli zhojené nebo téměř zhojené kůže. Bimekizumab rovněž prokázal konzistentní vysokou úroveň úplného zhojení kůže v rámci všech klinických studií s ohledem na odpověď PASI100 v 16. týdnu (přibližně 70 % nemocných) a během prvního roku léčby ve srovnání s aktivním komparátorem i u biologicky nenaivních pacientů [36-38,50,51]. „Můžeme to považovat za důkaz, že léčba bude fungovat, pokud změníme přípravek anti‑TNF na bimekizumab například po půlroce terapie z důvodu sekundárního selhání, a rychlost účinku bude stejná jako u naivního pacienta,“ upozornil přednášející.
Při léčbě bimekizumabem byla prokázána setrvalá účinnost po dobu tří let s ohledem na odpověď PASI100 v klinických studiích BE SURE a BE BRIGHT podle randomizace k léčbě. Pacienti randomizovaní k léčbě bimekizumabem si udrželi vysokou míru odpovědi PASI100 až do třetího roku léčby (152. týden). Rychlý nárůst počtu pacientů dosahujících odpovědi PASI100 po převedení z adalimumabu na bimekizumab ve 24. týdnu se udržel až do 152. týdne a hodnoty byly podobné jako u pacientů nerandomizovaných k léčbě bimekizumabem [52]. Pacienti s počáteční odpovědí PASI100 si udrželi tuto odpověď po dobu tří let léčby bimekizumabem podle poolované analýzy údajů z fáze III. Celkem 62,7 % z 989 pacientů randomizovaných k léčbě bimekizumabem s dávkou 320 mg každé čtyři týdny (Q4W) na počátku úvodních studií dosáhlo odpovědi PASI100 v 16. týdnu; 82 % pacientů léčených bimekizumabem, kteří dosáhli PASI100 v 16. týdnu, si tuto odpověď udrželo do třetího roku léčby (96. týden otevřené extenze, OLE) [53].
Bimekizumab prokázal vysokou úroveň zhojení kůže u pacientů, u nichž nebylo dosaženo adekvátní odpovědi na léčbu adalimumabem, ustekinumabem nebo secukinumabem (PASI90 a PASI100, post hoc analýza) [54-56]. Z těchto výsledků vyplývá, že bimekizumab nabízí možnost pro pacienty, u nichž předtím selhala léčba jiným biologikem.
Cílem studie BE READY bylo zjistit u pacientů, kteří dosáhli odpovědi na bimekizumab v 16. týdnu, setrvalost této léčby po jejím vysazení oproti pacientům kontinuálně pokračujícím v léčbě a zhodnotit opětovné dosažení odpovědi po opětovném nasazení léčby bimekizumabem u pacientů, u nichž došlo po vysazení léčby k relapsu. Pacienti léčení bimekizumabem, kteří dosáhli v 16. týdnu odpovědi PASI90, byli opětovně randomizováni k podávání bimekizumabu v dávce 320 mg Q4W, bimekizumabu v dávce 320 mg každých osm týdnů (Q8W) a k podávání placeba. U 67/105 pacientů opětovně randomizovaných k podávání placeba došlo během randomizačního období s vysazením léčby k relapsu a tito nemocní následně vstoupili do 12týdenního únikového ramene s bimekizumabem 320 mg Q4W [57]. „Výsledek přináší zajímavou informaci pro klinickou praxi, jakou dávku nasadit po opětovném zahájení léčby,“ okomentoval profesor Gkalpakiotis.
Do studie BE READY byla zahrnuta řada pacientů, kteří předtím byli léčeni biologickou terapií. U pacientů opětovně randomizovaných k užívání placeba byl medián doby do ztráty odpovědi PASI75 32 týdnů a u odpovědi PASI90 28 týdnů od poslední dávky bimekizumabu. Pacienti, u nichž došlo k relapsu po opětovné randomizaci k užívání placeba, znovu rychle dosáhli odpovědi po opětovném nasazení léčby bimekizumabem. Pro klinickou praxi to znamená, že po vynechání léčby delším než půlrok lze zvážit znovu úvodní dávkování bimekizumabu [57].
Nemocní s počáteční odpovědí BSA (Body Surface Area) ≤ 1 % si udrželi odpověď BSA ≤ 1 % po dobu tří let léčby bimekizumabem dle poolované analýzy údajů ze studie fáze III. Celkem 74,9 % z 989 pacientů randomizovaných k léčbě bimekizumabem Q4W na počátku úvodních studií dosáhlo BSA ≤ 1 % v 16. týdnu; 90,8 % pacientů léčených bimekizumabem, kteří dosáhli BSA ≤ 1 % v 16. týdnu, si tuto odpověď udrželo do třetího roku léčby (96. týden OLE) [53].
Shrnutí
V klinických head‑to‑head hodnoceních fáze III/IIIb prokázal bimekizumab oproti ustekinumabu, adalimumabu nebo secukinumabu vyšší účinnost, přičemž většina pacientů zaznamenala rychlý nástup účinku, úplné zhojení kůže a setrvalou léčebnou odpověď. Inhibice IL‑17F spolu s inhibicí IL‑17A pomocí bimekizumabu vedla k dosažení vyšší úrovně klinické odpovědi v porovnání s inhibicí samotného IL‑17A. Na základě poolovaných údajů z klinických studií fáze III si většina pacientů s počáteční odpovědí v 16. týdnu udržela úplné zhojení kůže po dobu tří let.
Nový inhibitor IL‑17 s pohodlným dávkovacím režimem
V posledním příspěvku prvního bloku se as. MUDr. Martin Tichý, Ph.D., (Klinika chorob kožních a pohlavních FN Olomouc) věnoval psoriáze a jejím komorbiditám, strategii léčby, bezpečnosti léčby bimekizumabem a výhodám jeho dávkování.
Psoriáza, komorbidity a strategie léčby
Psoriáza je závažný stav, který ovlivňuje více než jen kůži. Je to systémové onemocnění, které má etiopatogenetické souvislosti s řadou dalších chorob – komorbidit. Na pacienta musíme pohlížet jako na individualitu a přihlížet k řadě dalších faktorů (akutní stav, velký rozsah postižení kůže, obtížně léčitelné lokality, rezistence, komorbidity jako psoriatická artritida, deprese, obezita aj.), od toho se odvíjí personalizovaná volba léčby. Psoriatická artritida (PsA) postihuje až 40 % pacientů s psoriázou. Určitým indikátorem rozvoje PsA jsou například některé specifické varianty psoriázy - psoriáza nehtů, inverzní psoriáza, psoriáza kštice. Mezi nejčastější komorbidity se kromě PsA řadí onemocnění metabolického syndromu (hypertenze, hyperlipidemie, diabetes mellitus 2. typu, obezita), idiopatické střevní záněty (IBD) a psychické problémy (anxiozita, depresivní syndrom). Dle řady studií je těžká psoriáza považována za nezávislý rizikový faktor rozvoje infarktu myokardu (8 %) [58-63].
Pokud není psoriáza léčena, dochází ke kumulaci komorbidit v průběhu života pacienta, což představuje zátěž pro organismus, dopad na psychiku nemocného a stupňující se sociální problémy [25,64,65]. Psoriáza a s ní spojené komorbidity mají podobné genetické pozadí a podobnou imunopatogenezi, v níž se uplatňují podobné prozánětlivé cytokiny (IL‑2, IL‑6, TNFα, IFNα). Těžká psoriáza a onemocnění s ní spojená jsou příčinou zvýšené mortality – dle některých epidemiologických studií u mužů znamenají průměrné zkrácení doby života o 3,5 roku, u žen o 4,4 roku. Zvlášť rizikoví jsou pacienti s těžkou formou psoriázy a s časným nástupem onemocnění.
Současné cíle v léčbě psoriázy představují dosažení PASI90/100, absolutní PASI ≤ 2, DLQI < 2, PGA (Physician Global Assessment) 0/1 [66]. Prostřednictvím cílené léčby se snažíme zabránit vzniku komorbidit (screening a prevence vzniku) a zvrátit stávající poškození (volba správné terapie s ohledem na stávající komorbidity) [67]. Pro konkrétního pacienta s individuálními potřebami vybíráme lék s nejvhodnějším imunologickým mechanismem působení z odpovídající terapeutické skupiny. Je důležité vědět, jaké vlastnosti a kvality požadujeme od léčivého přípravku (pohodlnější interval podávání, aplikační forma atd.) a jaké výsledky prokazují klinické studie a data z reálné klinické praxe.
Strategie volby biologického přípravku zohledňuje několik parametrů:
- spolehlivost dosažení terapeutického cíle (PASI90/100),
- ovlivnění terapeuticky problematických oblastí a specifických forem psoriázy (palmoplantární psoriáza, inverzní psoriáza, postižení kštice, nehtů),
- udržení dlouhodobé remise,
- rychlost nástupu účinku,
- bezpečnost přípravku,
- komfort léčby (forma aplikace, aplikační interval).
V České republice má aktuálně úhradu 12 originálních biologických přípravků (etanercept, adalimumab, infliximab, certolizumab pegol, secukinumab, ixekizumab, brodalumab, bimekizumab, ustekinumab, guselkumab, risankizumab, tildrakizumab). K dispozici je rovněž řada přípravků biosimilárních [47]. Při rozhodování o volbě léku je nutné brát v úvahu jak hledisko medicínské, tak ekonomické.
Bezpečnost léčby bimekizumabem
Tříletá data léčby bimekizumabem zkoumala poolovaná analýza bezpečnosti klinických studií fáze II a III. Tato data se neliší od dat dvouletých, mezi tři nejčastější nežádoucí účinky léčby bimekizumabem patří nazofaryngitida, orální slizniční kandidóza a běžné respirační infekce [68]. Při léčbě inhibitory IL‑17 se kandidózy vyskytují častěji oproti neléčené populaci, neboť IL‑17 má protektivní úlohu nejen ve vztahu k bakteriálním infekcím, ale také ve vztahu k infekcím kvasinkovým. Kandidóza se objevuje především v oblasti dutiny ústní a orofaryngu [69-71]. Léčbu inhibitory IL-17 není v naprosté většině případů nutné ukončovat, u těžších případů je ale vhodné její krátké přerušení do vyléčení kandidózy. Slizniční kandidózy lze zpravidla dobře zvládnout lokální léčbou, u těžších forem případně systémovou léčbou. Při léčbě bimekizumabem se v klinických studiích v prvním roce vyskytly případy orální kandidózy u 15,4 % pacientů. Čím déle byli pacienti bimekizumabu exponováni, tím menší byla pravděpodobnost, že se u nich orální kandidóza vyvine. Většina těchto nemocných byla úspěšně léčena nystatinem a/nebo flukonazolem. Medián trvání antimykotické léčby (lokální nebo systémové) byl 12 dnů [68].
Přednášející stručně seznámil účastníky s algoritmem pro diagnostiku a management orální kandidózy u pacientů s ložiskovou psoriázou, kteří jsou léčeni inhibitory IL‑17 [72]. Mezi příznaky orální kandidózy patří většinou erytém na orální sliznici, pálení a bolestivost v ústech. Při bolestech a obtížích při polykání je pravděpodobnost sestupu kandidózy do jícnu a pacienta je nutné referovat ke gastroenterologovi k vyloučení ezofageální kandidózy. V případě onemocnění orální kandidózou většinou postačuje ke stanovení diagnózy typický klinický obraz, diagnózu může pomoci upřesnit kultivační vyšetření. Léčba většinou trvá jeden až dva týdny, u lehčích infekcí se doporučuje lokální léčba suspenzí nystatinu nebo klotrimazol v lokální aplikaci, u středně závažných flukonazol systémově.
Dávkování bimekizumabu
Bimekizumab má velmi pohodlné dávkování, v udržovací fázi se aplikuje jednou za osm týdnů (320 mg s.c.). Iniciační fáze probíhá do 16. týdne, kdy se aplikuje 320 mg subkutánně jednou za čtyři týdny. V prvním roce léčby je pacientovi podáno celkem devět dávek léku, v udržovací fázi během dalších let už je to jen šest dávek za rok. U pacientů s tělesnou hmotností ≥ 120 kg, kteří nedosáhli kompletního zhojení kůže v 16. týdnu, může dávka 320 mg každé čtyři týdny po prvních 16 týdnech léčby dále zlepšit odezvu na léčbu po 16. týdnu [73].
Panelová diskuse a sociálně právní aspekty léčby
Problematiku nedostatečně léčených pacientů s psoriázou a potřebu jejich edukace otevřel ve svém příspěvku v rámci panelové diskuse druhého bloku prof. MUDr. Petr Arenberger, DrSc., MBA, FCMA, (Dermatovenerologická klinika 3. LF UK a FNKV, Praha). Současnými doporučenými postupy u ložiskové psoriázy a nutností zohlednění nových léčebných cílů se zabývala prof. MUDr. Petra Cetkovská, Ph.D., (Dermatovenerologická klinika LF UK a FN Plzeň), data pacientů s psoriázou léčených biologickou léčbou z národního registru BIOREP důležitá pro běžnou klinickou praxi prezentovala MUDr. Martina Kojanová, Ph.D., (Dermatovenerologická klinika 1. LF UK a VFN, Praha). Na rozhodovací mechanismus při výběru léčby středně závažné a závažné ložiskové psoriázy se zaměřila MUDr. Alena Machovcová, MBA, Ph.D., (Dermatovenerologické oddělení FN Motol, Praha). Docent MUDr. Filip Rob, Ph.D., (Dermatovenerologická klinika FN Bulovka, Praha) připomněl duální mechanismus účinku nového inhibitoru IL‑17 a MUDr. Jiří Horažďovský, Ph.D., (Kožní oddělení Nemocnice České Budějovice) klíčové výsledky registračních a přímých studií s bimekizumabem. Bezpečnostní profil bimekizumabu a management orálních kandidóz podrobněji komentoval doc. MUDr. Miloslav Salavec, CSc., (Klinika nemocí kožních a pohlavních FN Hradec Králové).
O praktickou zkušenost s léčbou bimekizumabem u pacienta s psoriázou na pracovišti Dermatovenerologické kliniky 3. LF UK a FNKV se podělil profesor Gkalpakiotis. U mladého pacienta byla tato léčba zahájena v polovině prosince 2022 a její efekt byl patrný už po týdnu, zlepšení se po této době projevilo také v oblasti nehtů zmírněním projevů onycholýzy. Nemocný neaplikoval během léčby bimekizumabem žádnou lokální terapii.
Se sociálně právními aspekty léčby psoriázy seznámila zúčastněné Mgr. Hana Potměšilová, odbornice na zaměstnávání osob se zdravotním postižením v ČR. Její prezentace přinesla mnoho užitečných rad pro pacienty i lékaře a upozornila na některá úskalí v souvislosti se statusem osoby se zdravotním znevýhodněním a zdravotním postižením i na novinky v sociální sféře.
Závěrem
Profesor Thaçi označil v rámci diskuse novou biologickou terapii za začátek konce psoriázy. V blízké budoucnosti bude třeba soustředit se na „misi k remisi“, tedy nejen kontrolovat onemocnění a zmírňovat příznaky, ale nabídnout pacientovi vizi úplného uzdravení. Léčba psoriázy se tak zařadí k moderní precizní medicíně, která zahrne cíle terapie, pacientovy požadavky a řadu dalších faktorů. Neméně důležité je to, že biologická terapie skutečně snižuje celkové náklady na léčbu pacientů s psoriázou.
Literatura
[1] Lynde CW, Poulin Y, Vender R, et al. Interleukin 17A: toward a new understanding of psoriasis pathogenesis. J Am Acad Dermatol 2014; 71: 141−150.
[2] Oliver R, Krueger JG, Glatt S, et al. Bimekizumab for the treatment of moderate‐to‐severe plaque psoriasis: efficacy, safety, pharmacokinetics, pharmacodynamics and transcriptomics from a phase IIa, randomized, double‐blind multicentre study. Br J Dermatol 2022; 186: 652−663.
[3] Adams R, Maroof A, Baker T, et al. Bimekizumab, a Novel Humanized IgG1 Antibody That Neutralizes Both IL‑17A and IL‑17F. Front Immunol 2020; 11: 1894.
[4] Iznardo H, Puid L. Dual inhibition of IL‑17A and IL‑17F in psoriatic disease. Ther Adv Chronic Dis 2021; 12: 20406223211037846.
[5] Kolbinger F, Loesche C, Valentin M‑A, et al. β‑Defensin 2 is a responsive biomarker of IL‑17A‑driven skin pathology in patients with psoriasis. J Allergy Clin Immunol 2017; 139: 923−932.
[6] Cheng JB, Sedgewick AJ, Finnegan AI, et al. Transcriptional Programming of Normal and Inflamed Human Epidermis at Single‑Cell Resolution. Cell Rep 2018; 25: 871−883.
[7] Johnston A, Fritz Y, Dawes SM, et al. Keratinocyte overexpression of IL‑17C promotes psoriasiform skin inflammation. J Immunol 2013; 190: 2252−2262.
[8] Pfaff CM, Marquardt Y, Fietkau K, et al. The psoriasis‑associated IL‑17A induces and cooperates with IL‑36 cytokines to control keratinocyte differentiation and function. Sci Rep 2017; 7: 15631.
[9] Maggi L, Santarlasci V, Capone M, et al. Distinctive features of classic and nonclassic (Th17 derived) human Th1 cells. Eur J Immunol 2012; 42: 3180−3188.
[10] Foster AM, Baliwag J, Chen CS, et al. IL‑36 promotes myeloid cell infiltration, activation, and inflammatory activity in skin. J Immunol 2014; 192: 6053−6061.
[11] Cole S, Murray J, Simpson C, et al. Interleukin (IL)‑12 and IL‑18 Synergize to Promote MAIT Cell IL‑17A and IL‑17F Production Independently of IL‑23 Signaling. Front Immunol 2020; 11: 585134.
[12] Glatt S, Helmer E, Haier B, et al. First‑in‑human randomized study of bimekizumab, a humanized monoclonal antibody and selective dual inhibitor of IL‑17A and IL‑17F, in mild psoriasis. Br J Clin Pharmacol 2017; 83: 991−1001.
[13] Glatt S, Baeten D, Baker T, et al. Dual IL‑17A and IL‑17F neutralisation by bimekizumab in psoriatic arthritis: evidence from preclinical experiments and a randomised placebo‑controlled clinical trial that IL‑17F contributes to human chronic tissue inflammation. Ann Rheum Dis 2018; 77: 523532.
[14] UCB Data on file. Research report 40001882.
[15] Reich K, Papp KA, Matheson RT, et al. Evidence that a neutrophil‑keratinocyte crosstalk is an early target of IL‑17A inhibition in psoriasis. Exp Dermatol 2015; 24: 529−535.
[16] UCB Data on file. Research report 40001876.
[17] Krueger J, et al. Genome Informatics 2020; Poster presentation.
[18] Langowski JL, Zhang X, Wu L, et al. IL‑23 promotes tumour incidence and growth. Nature 2006; 442: 461−465.
[19] He D, Li H, Yusuf N, et al. IL‑17 promotes tumor development through the induction of tumor promoting microenvironments at tumor sites and myeloid‑derived suppressor cells. J Immunol 2010; 184: 2281−2288.
[20] Krueger GG, Bergstresser PR, Lowe NJ, et al. Psoriasis. J Am Acad Dermatol 1984; 11: 937−947.
[21] Watanabe H, Kawaguchi M, Fujishima S, et al. Functional characterization of IL‑17F as a selective neutrophil attractant in psoriasis. J Invest Dermatol 2009; 129: 650−656.
[22] Menter A, Korman NJ, Elmets CA, et al. Guidelines of care for the management of psoriasis and psoriatic arthritis. Section 3. Guidelines of care for the management and treatment of psoriasis with topical therapies. J Am Acad Dermatol 2009; 60: 643−659.
[23] Rønholt K, Iversen L. Old and New Biological Therapies for Psoriasis. Int J Mol Sci 2017; 18: 2297.
[24] Armstrong AW, Siegel MP, Bagel J, et al. From the Medical Board of the National Psoriasis Foundation: Treatment targets for plaque psoriasis. J Am Acad Dermatol 2017; 76: 290−298.
[25] Amatore F, Villani A‑P, Tauber M, et al. French guidelines on the use of systemic treatments for moderate‑to‑severe psoriasis in adults. J Eur Acad Dermatol Venereol 2019; 33: 464−483.
[26] Smith CH, Yiu ZZN, Bale T, et al. British Association of Dermatologists guidelines for biologic therapy for psoriasis 2020: a rapid update. Br J Dermatol 2020; 183: 628−638.
[27] Nast A, Smith C, Spuls PI, et al. EuroGuiDerm Guideline on the systemic treatment of Psoriasis vulgaris − Part 1: treatment and monitoring recommendations. Eur Acad Dermatol Venereol 2020; 34: 2461−2498.
[28] Gorelick J, Shrom D, Sikand K, et al. Understanding Treatment Preferences in Patients with Moderate to Severe Plaque Psoriasis in the USA: Results from a Cross‑Sectional Patient Survey. Dermatol Ther (Heidelb) 2019; 9: 785−797.
[29] Lacour J‑P, Bewley A, Hammond E, et al. Association Between Patient‑ and Physician‑Reported Outcomes in Patients with Moderate‑To‑Severe Plaque Psoriasis Treated with Biologics in Real Life (PSO‑BIO‑REAL). Dermatol Ther (Heidelb) 2020; 10: 1099−1109.
[30] Cather JC, Ryan C, Meeuwis K, et al. Patients’ Perspectives on the Impact of Genital Psoriasis: A Qualitative Study. Dermatol Ther (Heidelb) 2017; 7: 447−461.
[31] Chung J, Duffin KC, Takeshita J, et al. Palmoplantar psoriasis is associated with greater impairment of health‑related quality of life compared with moderate to severe plaque psoriasis. J Am Acad Dermatol 2014; 71: 623−632.
[32] Blome C, Gosau R, Radtke MA, et al. Patient‑relevant treatment goals in psoriasis. Arch Dermatol Res 2016; 308: 69−78.
[33] Armstrong AW, Jarvis S, Boehncke W‑H, et al. Patient perceptions of clear/almost clear skin in moderate‑to‑severe plaque psoriasis: results of the Clear About Psoriasis worldwide survey. J Eur Acad Dermatol Venereol 2018; 32: 2200−2207.
[34] Sawyer LM, Malottki K, Sabry‑Grant C, et al. Assessing the relative efficacy of interleukin‑17 and interleukin‑23 targeted treatments for moderate‑to‑severe plaque psoriasis: A systematic review and network meta‑analysis of PASI response. PloS ONE 2019; 14: e0220868.
[35] Armstrong AW, Puig L, Joshi A, et al. Comparison of Biologics and Oral Treatments for Plaque Psoriasis: A Meta‑analysis. JAMA Dermatol 2020; 156: 258−269.
[36] Gordon KB, Foley P, Krueger JG, et al. Bimekizumab efficacy and safety in moderate to severe plaque psoriasis (BE READY): a multicentre, double‑blind, placebo‑controlled, randomised withdrawal phase 3 trial. Lancet 2021; 397: 475−486.
[37] Reich K, Papp KA, Blauvelt A, et al. Bimekizumab versus ustekinumab for the treatment of moderate to severe plaque psoriasis (BE VIVID): efficacy and safety from a 52‑week, multicentre, double‑blind, active comparator and placebo controlled phase 3 trial. Lancet 2021; 397: 487−498.
[38] Warren RB, Blauvelt A, Bagel J, et al. Bimekizumab versus Adalimumab in Plaque Psoriasis. N Engl J Med 2021; 385: 130−141.
[39] Blauvelt A, Leonardi C, Elewski B, et al. A head‑to‑head comparison of ixekizumab vs. guselkumab in patients with moderate‑to‑severe plaque psoriasis: 24‑week efficacy and safety results from a randomized, double‑blinded trial. Br J Dermatol 2021; 184: 1047−1058.
[40] Blauvelt A, Leonardi C, Gooderham M, et al. Efficacy and Safety of Continuous Risankizumab Therapy vs Treatment Withdrawal in Patients With Moderate to Severe Plaque Psoriasis. A Phase 3 Randomized Clinical Trial. JAMA Dermatol 2020; 156: 649−658.
[41] Bagel J, Nia J, Hashim PW, et al. Secukinumab is Superior to Ustekinumab in Clearing Skin in Patients with Moderate to Severe Plaque Psoriasis (16‑Week CLARITY Results). Dermatol Ther (Heidelb) 2018; 8: 571−579.
[42] Leonardi C, Reich K, Foley P, et al. Efficacy and Safety of Ixekizumab Through 5 Years in Moderate‑to‑Severe Psoriasis: Long‑Term Results from the UNCOVER‑1 and UNCOVER‑2 Phase‑3 Randomized Controlled Trials. Dermatol Ther (Heidelb) 2020; 10: 431−447.
[43] Papp KA, Lebwohl MG, Puig L, et al. Long‑term efficacy and safety of risankizumab for the treatment of moderate‑to‑severe plaque psoriasis: interim analysis of the LIMMitless open‑label extension trial beyond 3 years of follow‑up. Br J Dermatol 2021; 185: 1135−1145.
[44] Bissonnette R, Luger T, Thaçi D, et al. Secukinumab demonstrates high sustained efficacy and a favourable safety profile in patients with moderate‑to‑severe psoriasis through 5 years of treatment (SCULPTURE Extension Study). J Eur Acad Dermatol Venereol 2018; 32: 1507−1514.
[45] UCB Data on file. Strober 2021. AAD FiRST Oral presentation.
[46] Hercogová J, Vašků V, Zelenková D, et al. Psoriáza. Doporučený diagnostický a léčebný postup. Čes Dermatovenereol 2021; 11: 3−11.
[47] https://www.sukl.cz
[48] Augustin M, Gallo G, See K, et al. Early Response is Associated With Stable Long‑Term Response in Psoriasis Patients Receiving Ixekizumab or Ustekinumab. J Drugs Dermatol 2022; 21: 122−126.
[49] Langley RB, et al. Complete skin clearance translates to substantial and durable benefits in health‑related quality of life and perceived symptoms for patients with plaque psoriasis in the BE VIVID phase 3 trial. EADV Congress 2021; Poster P1414.
[50] Reich K, Warren RB, Lebwohl M, et al. Bimekizumab versus Secukinumab in Plaque Psoriasis. N Engl J Med 2021; 385: 142−152.
[51] Reich K, Warren R, Lebwohl M, et al. Bimekizumab Efficacy and Safety Versus Secukinumab in Patients with Moderate‑to‑Severe Plaque Psoriasis: Results from the Phase IIIb Trial BE RADIANT. AAD Congress 2021; Poster 29010.
[52] Thaçi D, et al. Bimekizumab efficacy and safety through three years in patients with moderate to severe plaque psoriasis: Long‑term results from the BE SURE randomised controlled trial and the BE BRIGHT open‑label extension. EADV Congress 2022; Poster P1572.
[53] Strober B, et al. Bimekizumab maintenance of response through three years in patients with moderate to severe plaque psoriasis who responded at Week 16: Results from the BE BRIGHT open‑label extension. EADV Congress 2022; Poster P1491.
[54] Strober B, et al. Bimekizumab efficacy in patients with moderate to severe plaque psoriasis receiving continuous bimekizumab or switching from adalimumab: Results from the phase 3 BE SURE trial. AAD Congress 2021; Poster 27374.
[55] Papp KA, et al. Bimekizumab efficacy and safety up to two years in patients with moderate to severe plaque psoriasis switching from ustekinumab: Interim results from the BE BRIGHT open‑label extension trial. EADV Congress 2021; Poster P1416.
[56] Lebwohl M, et al. Bimekizumab efficacy and safety in patients with moderate to severe plaque psoriasis who switched from secukinumab: Results from the open‑label extension period of the BE RADIANT phase 3b trial. AAD Congress 2022; Poster 33817.
[57] Blauvelt A, Wu J, Reich K, et al. Bimekizumab effi cacy in patients with moderate to severe plaque psoriasis during the randomized withdrawal and retreatment phase of BE READY, a phase 3 trial. AAD Congress 2021; Poster 27380.
[58] Mease PJ, Armstrong AW. Managing Patients with Psoriatic Disease: The Diagnosis and Pharmacologic Treatment of Psoriatic Arthritis in Patients with Psoriasis. Drugs 2014; 74: 423−441.
[59] Gladman DD, Antoni C, Mease PJ, et al. Psoriatic arthritis: epidemiology, clinical features, course, and outcome. Ann Rheum Dis 2005; 64(Suppl 2): ii14−17.
[60] Danielsen K, Wilsgaard T, Olsen AO, et al. Elevated odds of metabolic syndrome in psoriasis: a population-based study of age and sex differences. Br J Dermatol 2015; 172: 419−427.
[61] Dowlatshahi EA, Wakkee M, Arends LR, Nijsten T. The prevalence and odds of depressive symptoms and clinical depression in psoriasis patients: a systematic review and meta-analysis. J Invest Dermatol 2014; 134: 1542−1551.
[62] Loftus EV Jr., Colombel J-F, Feagan BG, et al. Long-term Effi cacy of Vedolizumab for Ulcerative Colitis. J Crohns Colitis 2016; 11: 400−411.
[63] Xiao J, Chen L-H, Tu Y-T, et al. Prevalence of myocardial infarction in patients with psoriasis in central China. J Eur Acad Dermatol Venereol 2009; 23: 1311−1315.
[64] Smith CH, Jabbar-Lopez ZK, Yiu ZZ, et al. British Association of Dermatologists guidelines for biologic therapy for psoriasis 2017. Br J Dermatol 2017; 177: 628−636.
[65] Menter A, Strober B, Kaplan DH, et al. Joint AAD-NPF guidelines of care for the management and treatment of psoriasis with biologics. J Am Acad Dermatol 2019; 80: 1029−1072.
[66] Nast A, Smith C, Spuls PI, et al. EuroGuiDerm Guideline on the systemic treatment of Psoriasis vulgaris − Part 2: specifi c clinical and comorbid situations. J Eur Acad Dermatol Venereol 2021; 35: 281−317.
[67] Korman NJ. Management of psoriasis as a systemic disease: what is the evidence? Br J Dermatol 2020; 182: 840−848.
[68] Gordon KB, Langley RG, Warren RB, et al. Bimekizumab Safety in Patients With Moderate to Severe Plaque Psoriasis: Pooled Results From Phase 2 and Phase 3 Randomized Clinical Trials. JAMA Dermatol 2022; 158: 735−744.
[69] Saunte DM, Mrowietz U, Puig L, Zachariae C. Candida infections in patients with psoriasis and psoriatic arthritis treated with interleukin- 17 inhibitors and their practical management. Br J Dermatol 2017; 177: 47−62.
[70] Conti HR, Gaff en SL. IL-17-Mediated Immunity to the Opportunistic Fungal Pathogen Candida albicans. J Immunol 2015; 195: 780−788.
[71] Jabra-Rizk MA, Kong EF, Tsui C, et al. Candida albicans Pathogenesis: Fitting within the Host-Microbe Damage Response Framework. Infect Immun 2016; 84: 2724−2739.
[72] Armstrong AW, Soliman AM, Betts KA, et al. Long-Term Benefi t-Risk Profi les of Treatments for Moderate-to-Severe Plaque Psoriasis: A Network Meta-Analysis. Dermatol Ther (Heidelb) 2022; 12: 167−184.
[73] SPC Bimzelx. Dostupné na: https://www.ema.europa.eu/en/documents/ product-information/bimzelx-epar-product-information_ cs.pdf