Bivalentní vakcína proti lidským papilomavirům
Cervarix je vakcína proti nádorovému onemocnění – karcinomu děložního čípku vyvolanému lidskými papilomaviry typu 16, 18. Podobně jako dříve uvedený přípravek Silgard prokázala i tato vakcína svoji prakticky 100% účinnost na základě řady studií s přímým protektivním účinkem u více než 70 % případů onemocnění karcinomem děložního čípku. Zkříženě však kryje dalších přibližně 8 % případů. Vakcína dosahuje výborných výsledků zejména s ohledem na vysoké perzistující hladiny protilátek. Účinek vakcíny je nutno kombinovat s aktivním scree-ningem, neboť jen takto zatím může její podání umožnit efektivní kontrolu výskytu tohoto závažného karcinomu. Nejvýhodnější období pro aplikaci vakcíny je před zahájením pohlavního života, vakcinovat je však možno v širokém věkovém pásmu 10–45 (55) let.
Úvod
Po několikaletém úsilí a celosvětové registraci kvadrivalentní vakcíny proti lidským papilomavirům (human papillomavirus – HPV, viz obr. 1) byla 21.
května 2007 v Austrálii licencována druhá vakcína proti karcinomu děložního čípku pod komerčním názvem Cervarix. Radostné přijetí přípravku Silgard (na stránkách časopisu Remedia o něm již bylo referováno [1]), podnícené jeho parametry a možností efektivně zavést první plošné očkování proti nádorovému onemocnění, však zkalila vysoká cena preparátu, která plošné programy limituje i v nejbohatších zemích světa. Právě v souvislosti s konkurenčním produktem se spekulovalo o možném pozitivním vlivu na cenové hladiny.
Společnost GSK (výrobce vakcíny Cervarix) se však jasně vyjádřila, že nechce jít cestou cenové války s konkurencí a cenu snižovat, ale naopak prokázat kvalitu svého produktu. Současně vyhlásila zahájení přímé komparativní studie obou produktů. Reakce společnosti MSD vychází v tuto chvíli z objektivizované zkušenosti, že nižší hladiny protilátek po aplikaci přípravku Silgard nemusí mít naprosto žádný význam, neboť není stanoven korelát séroprotekce. Na dlouhodobou protektivitu nebo nutnost boosteru však vliv jistě mít mohou.
Inkubační doba, epidemiologie
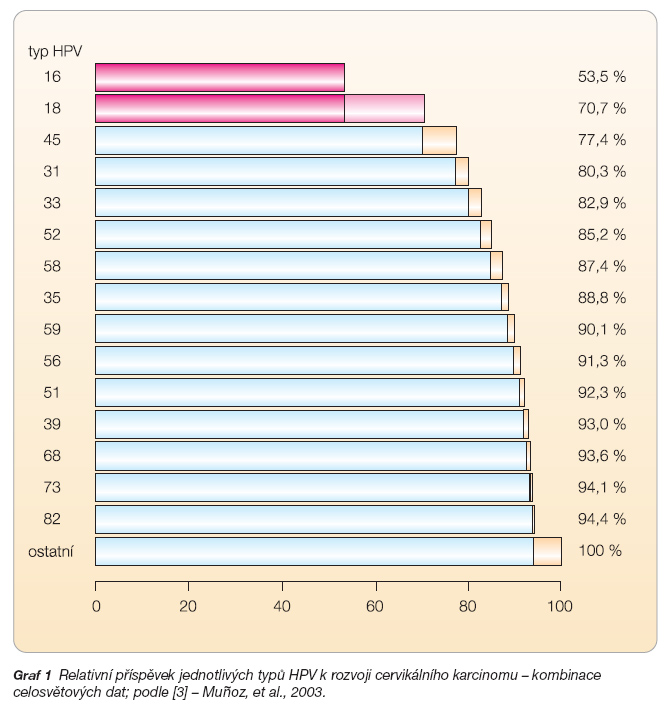
Onemocnění se vyvíjí v řádu několika let, nejkratší doba od infekce do vývoje cervikálního karcinomu (karcinomu děložního čípku) je 2 roky. Zpravidla je však tato doba mnohem delší. Pokud testujeme ženy ve věku 14–59 let, pouze 2,3 % z nich je infikováno vysokorizikovými typy 16 nebo 18 a pouze 0,1 % žen je infikováno oběma typy [1, 2]. Příspěvek jednotlivých typů HPV k rozvoji cervikálního karcinomu ukazuje graf 1 [3].
Mechanismus působení očkovací látky
Klíčovou roli v imunitní odpovědi hraje L1 kapsidový protein, z něhož je zkonstruována VLP (viru podobná částice). Imunodominantní neutralizační epitopy jsou právě na hlavním L1 proteinu obalu, který je v terciární nebo v nativní formě přirozeně poskládán jako multimer a generuje neutralizační protilátky. VLP jsou v elektronovém mikroskopu od infekčních virionů mikroskopicky nerozeznatelné. Mechanismus protekce je založen právě na vysokých titrech typově specifických neutralizačních protilátek [4, 5].
Výsledky vybraných studií
D. M. Harper a kol. prokázala v dvojitě slepé multicentrické randomizované placebem kontrolované studii, že bivalentní vakcína proti HPV 16 a 18 je bezpečná a účinná pro prevenci občasné i trvalé infekce děložního čípku. Podle autorů by vakcinace mohla snížit výskyt nádoru čípku na celém světě až o 70 %. Do studie bylo zahrnuto celkem 1113 žen (průměrný věk 20 let). Tyto ženy byly randomizovány do dvou skupin, které byly očkovány třemi dávkami bivalentní HPV 16/18 VLP vakcíny (560 žen) nebo placebem (553 žen). V následujících 27 měsících byla u žen vyšetřována cervikální cytologie a cervikovaginální vzorky na přítomnost HPV infekce. Cervikální infekce byla definována jako přítomnost HPV 16 nebo HPV 18 DNA alespoň v jednom PCR vyšetření. Přetrvávající infekce cervixu byla definována jako nejméně dva pozitivní výsledky v průběhu šesti měsíců. Výsledky studie ukázaly, že vakcína zprostředkovává signifikantní ochranu proti infekci HPV 16/18. Z počtu žen, které dokončily studii (721 žen, 65 %), byla vakcína účinná proti občasné infekci v 91,6 % případů a 100% účinná proti přetrvávající infekci. Vakcína byla shledána jako dobře tolerovaná, nebyly zjištěny žádné závažné vedlejší účinky spojené s vakcinací. Očkovací látka je vysoce imunogenní a indukovala vysokou hladinu protilátek proti HPV 16/18 [6].
Nová data ze studií fáze III ukazují, že 18 měsíců po podání první dávky schématu mělo 100 % žen do věku 55 let očkovaných vakcínou Cervarix (proti HPV 16 a 18) protilátky proti oběma nejčastějším typům papilomavirů vyvolávajícím karcinom děložního čípku. Vakcína je vysoce imunogenní (hladiny indukovaných protilátek jsou více než desetinásobné ve srovnání s přiro-zenou infekcí) a dobře tolerovaná. Rovněž byla prokázána perzistence protilátek v kategorii žen 15–25 let minimálně po dobu 5,5 let. Studie fáze III probíhala v Německu a Polsku u žen ve věkovém rozmezí 15–55 let. Bylo použito schéma aplikace 0, 1, 6 měsíců. Celkem bylo zahrnuto 517 žen a rozděleno do skupin podle věku: 15–25 (n = 169), 26–35 (n = 83), 36–45 (n = 89), 46–55 let (n = 176). Doposud jsou k dispozici data z klinických studií s téměř 30 000 ženami ve věku 10–55 let reflektující etnicky různorodou po- pulaci. Tato data zahrnují i údaje z dopo-sud nejrozsáhlejší studie hodnotící účinnost, která zahrnula celkem 18 000 žen ve věku 15–25 let [7].
Data prezentovaná na ESPID v Portu v roce 2007 ukázala obdobné výsledky ve skupině 2067 adolescentních dívek. Imunitní odpověď u dívek ve věkové skupině 10–14 let byla statisticky významně vyšší ve srovnání s odpovědí u žen ve věku 15–25 let. Zkřížená protektivita je vyka-zována vůči sérotypům 31, 45, 52 a 58.
Očkovací látka
Očkovací látka Cervarix je k 15. 6. 2007 registrována pouze v Austrálii, další registrace včetně EMEA a FDA probíhají. Vakcína je profylaktickou vakcínou proti HPV, která je připravena na bázi sterilní suspenze rekombinantních HPV proteinů L1 16 a 18 uspořádaných do podoby viru podobné částice (VLP). Produkční metoda je založena na inzerci genů kódujících tyto proteiny do genu baculoviru (Autographa californica).
Složení a forma
Jedna dávka (0,5 ml) obsahuje přibliž-ně: 20 mg Papillomaviri humani typus 16 proteinum L1 a 20 mg Papillomaviri humani typus 18 proteinum L1 adsorbované na 500 mg hydroxidu hlinitého.
Vakcína obsahuje dva adjuvantní systémy MPL a aluminium, označené společně jako ASO4 (3-deacyl monofosforyl lipid A v objemu 50 mg). MPL je detoxifikovanou formou lipidu S. minnesota. ASO4 bylo na základě uskutečněných studií vyhod-noceno jako bezpečné adjuvans při po-užití samostatně; nezvyšovalo toxicitu ani v kombinacích s kandidátními vakcínami. Stávající adjuvancia indukují hlavně Th2 buňkami zprostředkovanou odpověď. Adjuvans ASO4 kromě efektu na humorální odpověď stimuluje také imunitní odpověď zprostředkovanou Th1 buňkami. Stimulace imunitního typu Th1 může výrazně přispět k ochraně organismu proti onemocnění indukovanému HPV, neboť hraje roli ve vyčištění virové infekce. Dále vakcína obsahuje 4,4 mg chloridu sodného a 0,624 mg dihydrogenfosforečnanu sodného.
Indikace a dávkování
Příbalová informace přípravku zatím není k dispozici. Lze vyvozovat, že vakcína bude určena k prevenci vysokého stupně cervikální dysplazie a cervikálního karcinomu vyvolaného lidským papilomavirem typu 16 a 18. Indikace registrovaná v Austrálii je prevence cervikálního karcinomu a prekancerózních lézí vyvolávaných lidským papilomavirem 16 a 18 u žen ve věku 10–45 let. Paralelně byla podána žádost o registraci v Evropě, USA, Kanadě a v četných zemích Asie a Latinské Ameriky.
Základní očkování sestává ze tří samostatných dávek 0,5 ml podaných podle následujícího schématu: 0, 1, 6 měsíců. Dostatečná hladina protilátek přetrvává minimálně 5,5 roku.
Zvláštní upozornění
Nutnost přeočkování dosud nebyla stanovena. Vakcinace nenahrazuje rutinní cervikální screening. Vakcína nemá terapeutický efekt.
Nežádoucí účinky
Vakcína se jeví jako všeobecně bezpečná a velmi dobře tolerovaná. Žádná z žen v klinických hodnoceních fáze IIb nevykazovala závažnou nežádoucí reakci, která by byla odpovědným lékařem považována za reakci ve vztahu k vakcíně. U příjemců vakcíny byly ve srovnání s placebem častěji hlášeny nežádoucí reakce ve vazbě na místo aplikace jako bolestivost, zarudnutí, otok (94 % vs 88 %). Systémové reakce včetně bolestí hlavy, únavy a gastrointestinální příznaky byly hlášeny v obdobné míře u obou skupin (86 %). Většina nežádoucích reakcí byla mírné či střední intenzity [8].
Uchovávání a doba použitelnosti
Přípravek má být uchováván při teplotě 2–8 °C a nesmí zmrznout. Doba použitelnosti činí minimálně 2 roky.
Závěr
Vakcína proti HPV není zatím používána, s výjimkou Austrálie a Itálie, v plošných schématech z důvodu její vysoké ceny. EU se snaží harmonizovat přístup mezi jednotlivými členskými zeměmi, ale doposud k dohodě nedošlo.
V brzké době očekáváme rozhodnutí Německa o plošné vakcinaci proti HPV hrazené pojišťovnami, které může řadu zemí výrazně ovlivnit. Je zcela zřejmé, že i po plošné aplikaci vakcíny a přes zkříženou protekci proti dalším typům papilomavirů bude nezbytné pokračovat v preventivním aktivním screeningu, neboť jedině v kombinaci těchto dvou metod je možné incidenci karcinomu děložního čípku minimalizovat.
Podporováno výzkumným záměrem FVZ0000502.
Seznam použité literatury
- [1] Prymula R. Kvadrivalentní vakcína proti lidským papilomavirům. Remedia 2007, 17: 114–116.
- [2] Franco EL, Duarte-Franco E, Ferenczy A. Cervical cancer: epidemiology, prevention and the role of human papillomavirus infection. CMAJ 2001; 164: 1017–1025.
- [3] Mu~noz N, Bosch FX, De Sanjose S, et al. Epidemiologic classification of human papillomavirus types associated with cervical cancer. N Engl J Med 2003; 348: 518–527.
- [4] Giannini SL, Hanon E, Moris P, et al. Enhanced humoral and memory B cellular immunity using HPV16/18 L1 VLP vaccine formulated with the MPL/aluminium salt combination (ASO4) compared to aluminium salt only. Vaccine 2006, 24: 33–34.
- [5] Stanley M, Lowy DR, Frazer I. Prophylactic HPV vaccines: Underlying mechanisms. Vaccine 2006; 24 (S3): 106–113.
- [6] Harper DM, Franco EL, Wheeler C, et al. Efficacy of a bivalent L1 virus-like particle vaccine in prevention of infection with human papillomavirus types 16 and 18 in young women: a randomised controlled trial. Lancet 2004; 364: 1731–1732, 1757–1765.
- [7] Harper DM, Franco EL, Wheeler CM, et al. Sustained efficacy up to 4.5 years of a bivalent L1 virus-like particle vaccine against human papillomavirus types 16 and 18: follow-up from a randomised controlled trial. Lancet 2006; 367: 1247–1255.
- [8] Koutsky LA, Harper DM. Current findings from prophylactic HPV vaccine trials. Vaccine 2006; 24 (S3): S3/114–S3/121.