Budou v roce 2020 léky na vzácná onemocnění dostupnější?
Přelomová vládní novela zákona č. 48/1997 Sb., o veřejném zdravotním pojištění, přináší zásadní změny. Právní řád bude podle návrhu novely uznávat existenci léčiv pro vzácná onemocnění (tzv. orphan drugs) a stanoví specifické podmínky jejich vstupu do českého systému úhrad. Výrobce léčivého přípravku bude společně s výsledky klinického hodnocení léku dokládat také odhad počtu pacientů a dopad vstupu léčiva na zdravotnický rozpočet. Zároveň bude navrhovat způsob sdílení nákladů na léčbu mezi ním a zdravotními pojišťovnami (tzv. risk‑sharing), které tak získají přesný přehled o maximální nákladnosti léčby.
Léčivé přípravky na vzácná
onemocnění jsou vysoce inovativní a zpravidla velmi nákladné
léky pro úzké skupiny pacientů. Každoročně jich jsou ve vývoji
desítky, jejich dostupnost je však pro českou klinickou praxi
komplikovaná a mnohdy omezená či jsou tyto přípravky
nedostupné. Díky aktuálně projednávané vládní novele zákona
o veřejném zdravotním pojištění se mohou léčivé
přípravky dostat do rukou lékařů a k jejich
pacientům snáze a především dříve. Nově se taktéž
budou na schvalovacím procesu podílet pacientské organizace
a odborné lékařské společnosti, což je ve střední
a východní Evropě zcela unikátní.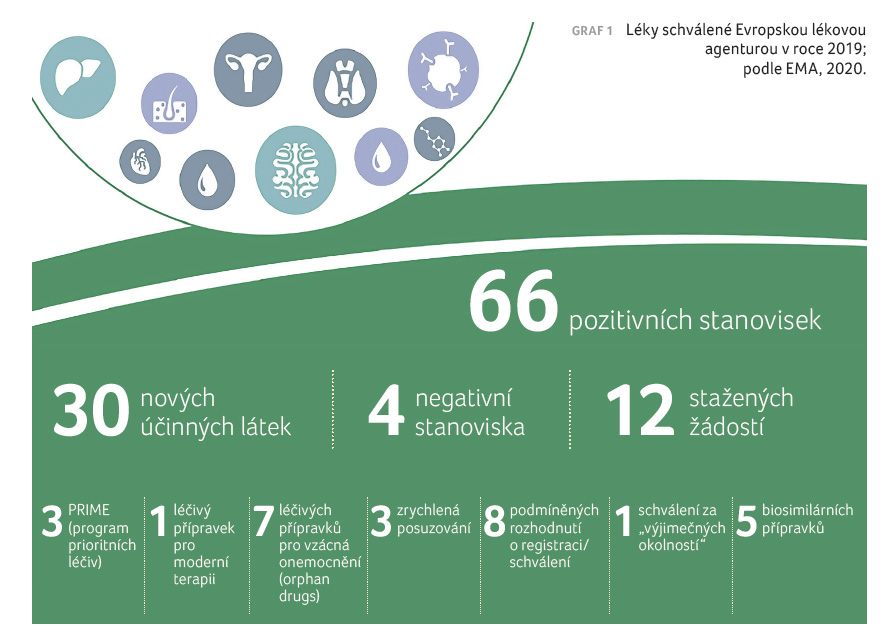
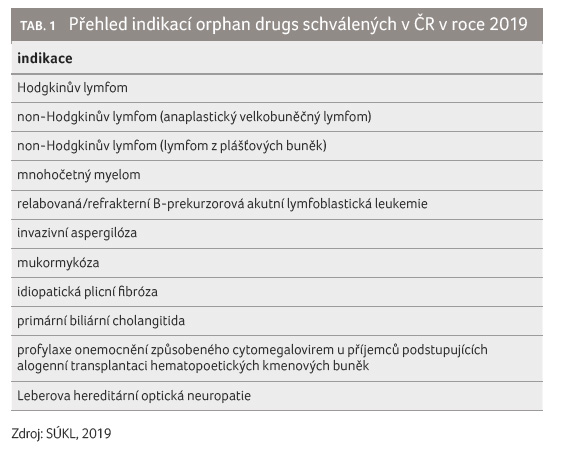
Vzácné onemocnění (rare disease, RD) je takové, které postihuje jednoho člověka ze dvou tisíc osob. V Evropě je více než 30 milionů lidí s RD a polovina z nich jsou děti. Do skupiny vzácných onemocnění patří více než 7 000 různých, většinou závažných až život ohrožujících chorob. V 80 % jsou tyto nemoci podmíněny geneticky. Pouze na 5 % RD existuje schválená léčba. U většiny z nich zatím bohužel léčba není dostupná, u jiných vývoj léčiv značně pokročil. V posledních 40 letech bylo americkým Úřadem pro kontrolu potravin a léčiv (FDA) schváleno 770 léčivých přípravků pro vzácná onemocnění. Ve vývoji je dnes přes 560 dalších léků, především v oblasti léčby nádorových onemocnění, genetických a neurologických poruch, infekčních a autoimunitních onemocnění. V roce 2019 schválila Evropská léková agentura (EMA) sedm léčivých přípravků pro vzácná onemocnění (viz také graf 1). Státní ústav pro kontrolu léčiv v roce 2019 vydal několik rozhodnutí, ve kterých přiznal nebo rozšířil podmínky úhrady léčivým přípravkům pro vzácná onemocnění. Ve většině případů se jednalo o oblast hematoonkologie, ale hodnoceny byly i přípravky z oblasti oftalmologie nebo pneumologie (bližší přehled indikací přináší tab. 1).
Současná česká cesta orphan drugs do praxe
Aktuálně mohou léky pro RD získat úhradu z veřejného zdravotního pojištění v zásadě jen dvěma způsoby. Výrobce (držitel rozhodn
utí o registraci) se může pokusit získat status tzv. vysoce inovativního léčivého přípravku (VILP), který umožňuje dočasnou úhradu, a po určité době dojde k přehodnocení. To znamená, že léčivý přípravek nemusí být dále hrazen a kvůli ceně se pak stane prakticky nedostupným. Druhá cesta pak vede přes známý § 16 zákona č. 48/1997 Sb., o veřejném zdravotním pojištění, což je spojeno s nesmírně zatěžující administrativou a s nejistým výsledkem. O přístupu k léčbě totiž rozhoduje revizní lékař konkrétní zdravotní pojišťovny. Zákonný nástroj pro zajištění terapie ve zcela výjimečných a specifických případech (paragraf 16) je tak často jediným způsobem, jak pacientovi (ne)zajistit adekvátní léčbu.
Včasná dostupnost léků i udržitelnost systému
Posuzovat se však nebude jen vliv léčiv na zdravotnický rozpočet, ale i dopad na sociální rozpočet. Na inovativní léky nelze pohlížet jen jako na výdaje ze zdravotnického rozpočtu, ale je třeba je vnímat jako investici do zdraví. Do hodnocení přínosu a rizika léčivého přípravku by měl být zahrnut jeho přínos například ke snížení počtu přiznaných invalidních důchodů, ke snížení výdajů na sociální dávky či k podpoře dřívějšího návratu pacientů do pracovního procesu.
Novela dále ustanovuje nový poradní orgán při Ministerstvu zdravotnictví ČR, tzv. ministerskou komisi, ve které zasednou zástupci ministerstva a pojišťoven společně se zástupci odborných společností a pacientů. Na základě doporučení komise vydá ministr závazné stanovisko.
Pokud bude novela schválena, dostanou se i orphan drugs „čistou cestou“ včas k pacientům, bez nutnosti opakované žádosti o úhradu a bez rizika, že se jednou úhrada odejme. Zároveň bude díky sdílení nákladů mezi farmaceutickými společnostmi a zdravotními pojišťovnami (např. formou tzv. risk sharing smluv) zajištěna dlouhodobá udržitelnost financování zdravotnického systému.
Redakčně zpracovala MUDr. Marta
Šimůnková