Ceritinib v léčbě nemalobuněčného karcinomu plic
Souhrn:
Ceritinib je nový inhibitor kinázy anaplastického lymfomu (anaplastic lymphoma kinase, ALK) určený pro pacienty s ALK pozitivním nemalobuněčným karcinomem plic, kteří již byli léčeni crizotinibem. Ceritinib inhibuje autofosforylaci ALK, čímž je snížena produkce signálních proteinů a proliferace závislá na buněčné populaci ALK. Účinek ceritinibu byl ověřen dvěma klinickými studiemi fáze II, kde dosáhl celkové odpovědi 37,1 % (95% CI: 29,1–45,7) a mediánu doby bez progrese 5,7 měsíce (95% CI: 5,3–7,4). Nejčastějšími nežádoucími účinky jsou gastrointestinální toxicita, únava, nechutenství, vyšší sérová koncentrace kreatininu, vyrážka a anemie.
Key words: non small cell lung cancer – ALK – ceritinib.
Summary:
Ceritinib is indicated for the treatment of patients with anaplastic lymphoma kinase (ALK) positive advanced non small cell lung cancer previously treated with crizotinib. Ceritinib inhibits autophosphorylation of ALK, ALK mediated phosphorylation of downstream signalling proteins, and proliferation of ALK dependent cancer cells both in vitro and in vivo. Ceritinib was evaluated in two phase II single arm studies in patients with ALK positive non small cell lung cancer previously treated with an ALK inhibitor. Overall response rate with ceritinib was 37.1% (95% CI 29.1–45.7) and median progression free survival was 5.7 months (95% CI 5.3–7.4). The most commonly reported adverse effects were gastrointestinal disorders, fatigue, anorexia, raised blood creatinine, rash, and anaemia.
Úvod
Karcinom plic patří mezi nejčastěji diagnostikované druhy rakoviny a zůstává i hlavní příčinou úmrtnosti u nás i ve světě. Nemalobuněčný karcinom plic (non‑small cell lung cancer, NSCLC) je nejběžnější podskupinou a představuje 80 % všech případů plicních karcinomů. Mezi NSCLC se nejčastěji vyskytují adenokarcinomy, skvamózní karcinomy a méně často velkobuněčn![Graf 1 Genové alterace plicních adenokarcinomů; podle [35] – Alamgeer, et al., 2013. ALK – anaplastic lymphoma kinase; BRAF/PIK3CA – B-raf proto-oncogene/phosphatidylinositol- -4,5-bisphosphate 3-kinase; EGFR – epidermal growth factor receptor; HER2/MEK – epidermal growth factor/mitogen-activated protein kinase; KRAS – Kirsten rat sarcoma viral oncogene; MET – multi- target ed tyrosine kinase; RET – rearranged during transfection proto-oncogene; ROS – reactive oxygen species](https://www.remedia.cz/photo-a-30491---.jpg) é, sarkomatoidní, adenoskvamózní a jiné karcinomy. Tradiční léčbou většiny pacientů s NSCLC zůstává kombinovaná chemoterapie založená na platinovém derivátu. Zlepšující se možnosti molekulárního rozlišení jednotlivých kategorií nemalobuněčných karcinomů umožňují lépe definovat skupiny pacientů, kteří mají prospěch z cílené léčby. Zejména identifikace ovlivnitelné řídící mutace, jako je EGFR (epidermal growth factor receptor, receptor pro epidermální růstový faktor) a ALK (anaplastic lymfoma kinase, kináza anaplastického lymfomu), mohou pomoci rozhodnout, zda daný pacient s NSCLC bude mít prospěch z účinné a méně toxické cílené léčby (graf 1).
é, sarkomatoidní, adenoskvamózní a jiné karcinomy. Tradiční léčbou většiny pacientů s NSCLC zůstává kombinovaná chemoterapie založená na platinovém derivátu. Zlepšující se možnosti molekulárního rozlišení jednotlivých kategorií nemalobuněčných karcinomů umožňují lépe definovat skupiny pacientů, kteří mají prospěch z cílené léčby. Zejména identifikace ovlivnitelné řídící mutace, jako je EGFR (epidermal growth factor receptor, receptor pro epidermální růstový faktor) a ALK (anaplastic lymfoma kinase, kináza anaplastického lymfomu), mohou pomoci rozhodnout, zda daný pacient s NSCLC bude mít prospěch z účinné a méně toxické cílené léčby (graf 1).
Inhibice ALK
Od doby objevu ALK v roce 1994 uplynulo již více než dvacet let. V roce 2007 byla identifikována translokace EML4‑ALK (EML4 – echinoderm microtubule associated protein lik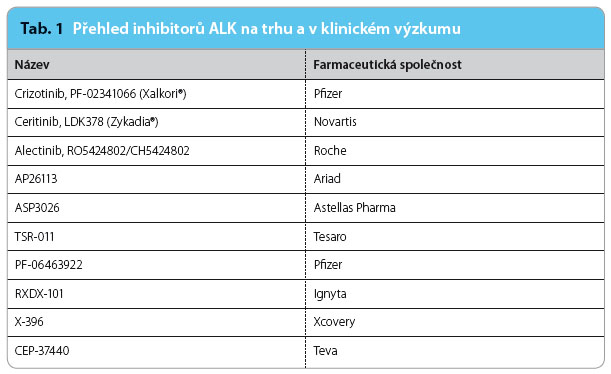 e 4) u NSCLC a čtyři roky poté do léčby pacientů s pozitivitou ALK úspěšně vstoupil crizotinib. Následně v roce 2010 byl identifikován ceritinib jako potentní inhibitor ALK druhé generace, který je od roku 2014 ve zrychleném řízení registrován pro léčbu ve Spojených státech amerických a od května 2015 i v zemích Evropské unie. Od poloviny loňského roku byla léčba ceritinibem zpřístupněna i pacientům v České republice pomocí tzv. časného přístupu. Přehled inhibitorů ALK a jejich základních vlastností ukazuje tab. 1 a 2.
e 4) u NSCLC a čtyři roky poté do léčby pacientů s pozitivitou ALK úspěšně vstoupil crizotinib. Následně v roce 2010 byl identifikován ceritinib jako potentní inhibitor ALK druhé generace, který je od roku 2014 ve zrychleném řízení registrován pro léčbu ve Spojených státech amerických a od května 2015 i v zemích Evropské unie. Od poloviny loňského roku byla léčba ceritinibem zpřístupněna i pacientům v České republice pomocí tzv. časného přístupu. Přehled inhibitorů ALK a jejich základních vlastností ukazuje tab. 1 a 2.
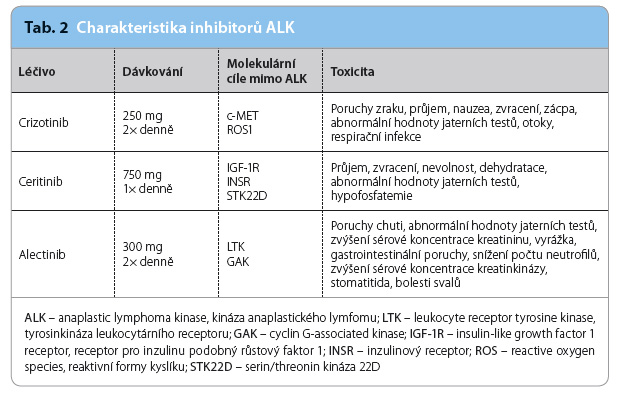 Tyrosinkinázový receptor ALK patří mezi důležité biomarkery a terapeutické cíle v léčbě NSCLC; je jedním z rodiny inzulinových receptorů lokalizovaných na chromosomu 2 [1,2]. Aktivace ALK se děje cestou genové fúze. Translokace EML4‑ALK je nejčastějším takovým genovým upořádáním [3]. Intracelulární kinázová doména ALK fúzuje s N‑koncem domény EML4 a následně kóduje cytoplazmatický chimérický protein s kinázovou aktivitou, který pak reguluje růst tumoru (obr. 1). Translokace EML4‑ALK se vyskytuje u pacientů s NSCLC převážně v mladším věku, u nekuřáků a u mladších mužů s adenokarcinomem. Její přítomnost současně vylučuje přítomnost mutace EGFR nebo KRAS [3,4]. Translokace EML4‑ALK se vyskytuje přibližně u 5 % adenokarcinomů a jen zcela ojediněle mezi skvamózními NSCLC [5,6].
Tyrosinkinázový receptor ALK patří mezi důležité biomarkery a terapeutické cíle v léčbě NSCLC; je jedním z rodiny inzulinových receptorů lokalizovaných na chromosomu 2 [1,2]. Aktivace ALK se děje cestou genové fúze. Translokace EML4‑ALK je nejčastějším takovým genovým upořádáním [3]. Intracelulární kinázová doména ALK fúzuje s N‑koncem domény EML4 a následně kóduje cytoplazmatický chimérický protein s kinázovou aktivitou, který pak reguluje růst tumoru (obr. 1). Translokace EML4‑ALK se vyskytuje u pacientů s NSCLC převážně v mladším věku, u nekuřáků a u mladších mužů s adenokarcinomem. Její přítomnost současně vylučuje přítomnost mutace EGFR nebo KRAS [3,4]. Translokace EML4‑ALK se vyskytuje přibližně u 5 % adenokarcinomů a jen zcela ojediněle mezi skvamózními NSCLC [5,6].![Obr. 1 Nitrobuněčná signalizace, která se uplatňuje v progresi EML4-ALK-pozitivního nemalobuněčného karcinomu plic; podle [20] – Gainor, et al., 2013. Amplifi kace ALK i EGFR-signalizace spouští buněčnou proliferaci a přežití. Fúzní protein EML4-ALK aktivuje kaskádu RAS/RAF/MEK a PI3K/AKT. Vazba ligandu na EGFR spouští nitrobuněčnou signální kaskádu včetně proliferace PI3K/AKT, STAT a RAS/RAF/MEK. ALK – anaplastic lymphoma kinase, kináza anaplastického lymfomu; EGFR – epidermal growth factor receptor, receptor pro epidermální růstový faktor; EML4 – echinoderm microtubule associated protein like 4](https://www.remedia.cz/photo-a-30494---.jpg)
První z cílených přípravků zaměřených na inhibici ALK, který prokázal klinickou aktivitu u EML4‑ALK‑pozitivních pacientů s NSCLC, byl crizotinib a nadále zůstává standardem v léčbě těchto pacientů [7–12]. Stanovení translokace EML4‑ALK se provádí metodou FISH (fluorescenční hybridizace in situ) a IHC (imunohistochemie). Hodnocení provádějí laboratoře s prokázanou zkušeností v používání specifické technologie. Dle společného mezioborového konsensu by na přestavbu genu ALK měli být testováni všichni pacienti, u kterých je zvažována léčba inhibitorem ALK, je u nich stanovena morfologická diagnóza adenokarcinomu, NSCLC spíše blízkého adenokarcinomu či blíže nespecifikovaného NSCLC (not otherwise specified, NOS NSCLC) a nebyla u nich prokázána přítomnost mutace genu EGFR.
Příčiny selhání léčby inhibitory ALK
Mezi hlavní limitace léčby crizotinibem patří relaps onemocnění v centrální nervové soustavě [13–15]. Přestože existují jednotlivé případy pacientů s ALK‑pozitivním NSCLC s metastatickým postižením mozku, u nichž byla zaznamenána odezva na léčbu crizotinibem, je právě špatný průnik přes hematoencefalickou bariéru hlavní příčinou léčebného selhání. V retrospektivní analýze souhrnných údajů z klinických studií PROFILE 1005 a PROFILE 1007 [16] byla četnost odpovědí na léčbu crizotinibem v centrální nervové soustavě u pacientů s ALK‑pozitivním NSCLC a s dříve léčenými nebo neléčenými metastázami do mozku pouze 7 % a mozek byl nejčastějším místem recidivy plicní rakoviny. Vysoká míra recidivy právě v centrální nervové soustavě u pacientů léčených crizotinibem je nejspíše důsledkem špatného pronikání léčiva skrze hematoencefalickou bariéru, což bylo ověřeno i stanovením nízké koncentrace crizotinibu v mozkomíšním moku.
Dalším omezením účinnosti je rezistence vůči crizotinibu. Pro pacienty s ALK‑pozitivním NSCLC dosahuje medián přežití bez progrese onemocnění (progression free survival, PFS) při léčbě crizotinibem 8–10 měsíců. Na selhání se podílí více mechanismů rezistence, nejčastější z nich jsou popsány v tab. 3. Sekundární mutace v kinázové doméně ALK byly detekovány u přibližně 30 % pacientů, nejčastěji se jednalo o mutace L1196M a G1269A. Amplifikace přeskupených lokusů AL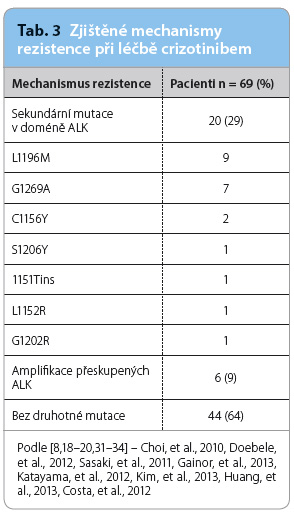 K byla zjištěna u 10 % pacientů. Aktivace alternativních receptorových tyrosinkináz, jako je EGFR a KIT, byla pozorována v menším množství případů a u zbývajících pacientů nebyl mechanismus rezistence zjištěn [16–20]. Mezi několik potenciálních přístupů, které by mohly zpozdit nebo překonat tuto odolnost, patří alternativní dávkovací schémata, tyrosinkinázové inhibitory další generace, inhibitory HSP90 (heat shock protein 90) a rovněž kombinace inhibitorů ALK a tyrosinkinázových inhibitorů s další léčbou (s cytotoxickou chemoterapií, s monoklonálními protilátkami, s proapoptotickými léky, s imunoterapií). Pro tuto kombinovanou léčbu je však v současnosti k dispozici relativní nedostatek údajů.
K byla zjištěna u 10 % pacientů. Aktivace alternativních receptorových tyrosinkináz, jako je EGFR a KIT, byla pozorována v menším množství případů a u zbývajících pacientů nebyl mechanismus rezistence zjištěn [16–20]. Mezi několik potenciálních přístupů, které by mohly zpozdit nebo překonat tuto odolnost, patří alternativní dávkovací schémata, tyrosinkinázové inhibitory další generace, inhibitory HSP90 (heat shock protein 90) a rovněž kombinace inhibitorů ALK a tyrosinkinázových inhibitorů s další léčbou (s cytotoxickou chemoterapií, s monoklonálními protilátkami, s proapoptotickými léky, s imunoterapií). Pro tuto kombinovanou léčbu je však v současnosti k dispozici relativní nedostatek údajů.
Ceritinib je schopen účinně inhibovat ALK‑rezistentní mutace L1196M, G1269A, I1171T a S1206Y, ale není účinný při inhibici ALK nesoucí mutace G1202R a F1174C.49. Současně ceritinib vykazuje silnou aktivitu pouze k IGF‑1R (insulin‑like growth factor receptor) a jeho selektivita pro ALK je násobně vyšší než pro jiné kinázy [21,22].
Stejně jako u pacientů léčených crizotinibem, tak i u pacientů léčených ceritinibem dochází k recidivě z důvodu rezistence. Dosud byly zjištěny získané mutace v doméně ALK, a to G1202 a F1174. Skutečnost, že běžně se vyskytující mutace ALK rezistentní na léčbu crizotinibem (L1196M, G1269A) nebyly pozorovány při podávání ceritinibu, naznačuje, že různé druhy rezistence se objeví v závislosti na selekčním tlaku nádorových klonů rezistentních k tyrosinkinázovým inhibitorům.
Alectinib
Alectinib je dalším zkoumaným inhibitorem ALK, který by měl být podobně jako ceritinib selektivnější a účinnější než crizotinib a aktivně působí nejen proti ALK, ale i proti dalším kinázám (LTK – leukocyte receptor tyrosine kinase, GAK – cyclin G‑associated kinase), naopak mu však chybí aktivita proti MET, ROS (reactive oxygen species) nebo proti IGF‑1R a INSR (insulin receptor) [23–25]. Preklinické studie demonstrují aktivitu u rezistentních mutací L1196M, C1156Y (54) a též u aktivující mutace F1174La R1275Q, což naznačuje potenciál pro léčbu neuroblastomu, kde se tyto mutace nacházejí.
Ceritinib v klinickém hodnocení
Ceritinib je perorální vysoce selektivní inhibitor ALK a jejích onkogenních variant (fúze ALK a mutace ALK) a působí rychlou a trvající odpověď u ALK‑pozitivních NSCLC.
Anaplastická lymfomová kináza patří mezi tyrosinkinázy inzulinového receptoru. Současné poznatky naznačují, že ALK je zahrnuta do neuronální buněčné diferenciace a regenerace, do formování synapsí a do migrace svalových buněk; může se sloučit s ostatními geny k vytvoření abnormálního fúzního proteinu, který podporuje nádorový růst u některých maligních onemocnění včetně NSCLC. Ceritinib je schválen Evropskou komisí pro léčbu dospělých pacientů s ALK‑pozitivním pokročilým NSCLC, kteří již byli dříve léčeni inhibitorem ALK – crizotinibem. Ceritinib je jedním z prvních přípravků, které byly schváleny americkým Úřadem pro kontrolu potravin a léčiv (Food and Drug Administration, FDA) ve zrychleném řízení a který byl komerčně dostupný v USA dříve než za tři a půl roku poté, co první pacient vstoupil do klinického hodnocení.
V klinické studii fáze I ASCEND‑1 [26] bylo zjištěno, že ceritinib vede ke zmenšení nádoru u pacientů s ALK‑pozitivním NSCLC bez ohledu na to, zda byli tito pacienti již léčeni inhibitorem ALK. Ceritinib vykazuje účinnost i u pacientů s mozkovými metastázami, které jsou nejčastějším místem relapsu při léčbě inhibitory ALK. V první fázi této studie bylo zahrnuto celkem 255 pacientů, z toho 246 pacientů s ALK‑pozitivním NSCLC, z nichž 67 % podstoupilo alespoň dvě předchozí linie léčby a 66 % z nich již bylo léčeno inhibitory ALK. Pacientům byl podáván ceritinib v dávce 750 mg denně. Během sedmi měsíců pokračovací fáze (follow‑up) dosáhla u pacientů léčených ceritinibem celková míra odezvy 58,5 % (95% CI: 52,1–64,8) a medián PFS 8,2 měsíce (95% CI: 7,06–1,10). Medián trvání léčebné odpovědi činil 9,7 měsíce (95% CI: 7,0–11,4) a medián první zaznamenané odpovědi byl 6 týdnů od zahájení léčby. Ve skupině 163 pacientů, kteří užívali 750 mg ceritinibu denně a byli dříve léčeni crizotinibem, byla celková četnost odpovědí 54,6 % (95% CI: 46,6–62,4) a PFS 6,9 měsíce (95% CI: 4,86–8,38). U 83 pacientů, kterým nebyla podávána předchozí léčba inhibitory ALK, byla celková četnost odpovědí (overall response rate, ORR) 66,3 % (95% CI: 55,1–76,3 %). U 124 pacientů, kteří měli v době zařazení do studie mozkové metastázy, dosáhla celková míra odezvy 54,0 % (95% CI: 44,9–63,0) a medián PFS 6,9 měsíce (95% CI: 5,39–8,41). Zmenšení nádoru bylo pozorováno u 50,0 % pacientů (95% CI: 39,7–60,3) s mozkovými metastázami, kteří byli již v minulosti léčeni inhibitory ALK, a 69,2 % pacientů (95% CI: 48,2–85,7) s mozkovými metastázami, kteří nebyli dříve léčeni inhibitorem ALK, dosáhlo zmenšení nádoru po léčbě ceritinibem. K přerušení léčby z důvodu nežádoucích účinků došlo u 10 % pacientů a u 59 % pacientů byla nutná alespoň redukce jedné dávky. Mezi nejčastější nežádoucí účinky, vyskytující se u více než poloviny pacientů, patřily průjem, nevolnost, zvracení, bolesti břicha a únava.
V navazující fázi II klinického hodnocení prokázal ceritinib ve studiích Ascend‑2 [27] a Ascend‑3 [28] protinádorový účinek u pacientů s ALK‑pozitivním NSCLC, kteří byli léčeni crizotinibem, respektive byli léčeni poprvé. Celková míra léčebných odpovědí (ORR) pozorovaná v těchto studiích byla 38,6 % a 63,7 %. Srovnatelné výsledky ORR byly přitom pozorovány i u pacientů s ALK‑pozitivním NSCLC, kteří vstoupili do studie s metastatickým postižením mozku (33 % a 58 %) [27,28].
ASCEND‑2 byla otevřená multicentrická studie fáze II s jedním ramenem, která zahrnovala 140 dospělých pacientů s ALK‑pozitivním NSCLC, kteří byli předtím léčeni chemoterapií a crizotinibem. Kromě ORR dosahující 38,6 % (95% CI: 30,5–47,2 %) byl u pacientů ve studii prokázán medián trvání odpovědi 9,7 měsíce (95% CI: 7,1–11,1 měsíce) a medián PFS 5,7 měsíce (95% CI: 5,4–7,6 měsíce). Nejčastějšími nežádoucími příhodami byly nevolnost (81,4 %), průjem (80,0 %), a zvracení (62,9 %) [27].
ASCEND‑3 byla otevřená jednoramenná multicentrická studie fáze II, která zahrnovala 124 pacientů s ALK‑pozitivním NSCLC, jimž byly podány až tři linie chemoterapie a kteří neměli předchozí zkušenosti s léčbou inhibitory ALK. Kromě ORR dosahující 63,7 % (95% CI: 54,6–72,2 %) prokázali pacienti ve studii medián trvání odpovědi 9,3 měsíce (95% CI: 9,1, N/A – not available, nedostupné) a medián PFS 11,1 měsíce (95% CI: 9,3, N/A). Nejčastějšími nežádoucími účinky byly průjem (82,3 %), nauzea (74,2 %) a zvracení (66,9 %) [28].
Do obou studií byl zařazen vysoký počet pacientů s metastatickým postižením mozku – 71,4 % (Ascend‑2) a 40,3 % (Ascend‑3), přičemž výsledky v podobě četnosti odpovědí, doby bez progrese a léčebné odpovědi byly stejné jako v celé populaci [27,28].
Data ze studie ASCEND‑2 ukazují na účinnost ceritinibu u pacientů s ALK‑pozitivním NSCLC, kteří již absolvovali předchozí léčbu inhibitorem ALK, zatímco ASCEND‑3 ukazuje účinnost u pacientů léčených inhibitorem ALK poprvé. Též léčebné výsledky u pacientů s metastatickým postižením mozku při zahájení léčby jsou podobné jako v celé léčené populaci a fakt, že až u 50 % pacientů s ALK‑pozitivním NSCLC se v průběhu léčby objeví mozkové metastázy, je současně i největší výzvou v léčbě ALK‑pozitivních NSCLC.
Závěr
Tak jako se stává ceritinib další slibnou možností léčby pro pacienty s ALK‑pozitivním NSCLC, je i v jeho případě účinnost limitována rezistencí. Mnohé další inhibitory ALK se nacházejí v různých fázích klinického vývoje a některé z těchto látek vykazují účinnost jak v centrální nervové soustavě, tak i v případech rezistence vůči crizotinibu. S příchodem nových léků ale vyvstává i řada otázek. Například zda se podávání účinnějších inhibitorů v první linii projeví i v podobě lepší a déletrvající odpovědi na léčbu, nebo se naopak rychleji rozvine rezistence, a také zda bude rezistence zkřížená i pro ostatní inhibitory. V neposlední řadě bude zajímavé, zda kombinace inhibitorů ALK s jinými přípravky, např. s cytostatiky, s imunoterapií a s jinými tyrosinkinázovými inhibitory, bude účinnější a lépe tolerovaná.
Na tyto a další otázky nám snad odpoví pokračující klinické studie s ceritinibem a alectinibem. Dnes je zřejmé, že pacienti s nádory nesoucími léčebně ovlivnitelnou řídící mutaci (např. ALK, EGFR) mají významně lepší přežití než pacienti s nádory bez takto ovlivnitelné mutace (např. KRAS) [29,30]. Je pravděpodobné, že s příchodem nových inhibitorů ALK a díky slibným možnostem kombinované léčby se přežití u pacientů s ALK‑pozitivní plicní rakovinou bude i nadále zlepšovat. Bohužel nové přípravky představují vysoké náklady, a tedy značné břemeno pro financování zdravotnictví. Účinnost nádorové genotypizace a snížení nákladů na vývoj léků zůstane proto nadále prioritou.
Seznam použité literatury
- [1] Lynch TJ, Bell DW, Sordella R, et al. Activating mutations in the epidermal growth factor receptor underlying responsiveness of non small cell lung cancer to gefitinib. N Engl J Med 2004; 350: 2129–2139.
- [2] Paez JG, Janne PA, Lee JC, et al. EGFR mutations in lung cancer: correlation with clinical response to gefitinib therapy. Science 2004; 304: 1497–1500.
- [3] Pao W, Miller V, Zakowski M, et al. EGF receptor gene mutations are common in lung cancers from “never smokers” and are associated with sensitivity of tumors to gefitinib and erlotinib. Proc Natl Acad Sci U S A 2004; 101: 13306–13311.
- [4] Kwak EL, Bang YJ, Camidge DR, et al. Anaplastic lymphoma kinase inhibition in non small cell lung cancer. N Engl J Med 2010; 363: 1693–1703.
- [5] Soda M, Choi YL, Enomoto M, et al. Identification of the transforming EML4 ALK fusion gene in non small cell lung cancer. Nature 2007; 448: 561–566.
- [6] Shaw AT, Yeap BY, Mino Kenudson M, et al. Clinical features and outcome of patients with non -small cell lung cancer who harbor EML4 ALK. J Clin Oncol 2009; 27: 4247–4253.
- [7] Shaw AT, Kim DW, Nakagawa K, et al. Crizotinib versus chemotherapy in advanced ALK positive lung cancer. N Engl J Med 2013; 368: 2385–2394.
- [8] Choi YL, Soda M, Yamashita Y, et al. ALK Lung Cancer Study Group. EML4 ALK mutations in lung cancer that confer resistance to ALK inhibitors. N Engl J Med 2010; 363: 1734–1739.
- [9] Camidge DR, Bang YJ, Kwak EL, et al. Activity and safety of crizotinib in patients with ALK positive non small cell lung cancer: updated results from a phase 1 study. Lancet Oncol 2012; 13: 1011–1019.
- [10] Otterson GA, Riely GJ, Shaw AT, et al. Clinical characteristics of ALK+ NSCLC patients (pts) treated with crizotinib beyond disease progression (PD): potential implications for management [ASCO abstract 7600]. J Clin Oncol 2012; 30 (suppl.): 7600.
- [11] Shaw AT, Yeap BY, Solomon BJ, et al. Effect of crizotinib on overall survival in patients with advanced non small cell lung cancer harbouring ALK gene rearrangement: a retrospective analysis. Lancet Oncol 2011; 12: 1004–1012.
- [12] Kim DW, Ahn MJ, Shi Y, et al. Results of a global phase II study with crizotinib in advanced ALK positive non small cell lung cancer (NSCLC) [ASCO abstract 7533]. J Clin Oncol 2012; 30 (suppl.): Abstr. 7533.
- [13] Kinoshita Y, Koga Y, Sakamoto A, Hidaka K. Long lasting response to crizotinib in brain metastases due to EML4 ALK rearranged non small cell lung cancer. BMJ Case Rep 2013; doi: 10.1136/bcr 2013 200867.
- [14] Maillet D, Martel Lafay I, Arpin D, Perol M. Ineffectiveness of crizotinib on brain metastases in two cases of lung adenocarcinoma with EML4 ALK rearrangement. J Thorac Oncol 2013; 8: e30–e31.
- [15] Gainor JF, Ou SH, Logan J, et al. The central nervous system as a sanctuary sitein ALK positive non small cell lung cancer. J Thorac Oncol 2013; 8: 1570–1573.
- [16] Costa DB, Shaw AT, Ou SH, et al. Clinical experience with crizotinib in patients with advancedALK rearranged non small cell lung cancer and brain metastases in PROFILE 1005 and PROFILE 1007. J Thorac Oncol 2013; 8 (suppl. 2): S294–S295.
- [17] Costa DB, Kobayashi S, Pandya SS, et al. CSF concentration of the anaplastic lymphoma kinase inhibitor crizotinib. J Clin Oncol 2011; 29: e443–e445.
- [18] Doebele RC, Pilling AB, Aisner DL, et al. Mechanisms of resistance to crizotinib in patients with ALK gene rearranged non small cell lung cancer. Clin Cancer Res 2012; 18: 1472–1482.
- [19] Sasaki T, Koivunen J, Ogino A, et al. A novel ALK secondary mutation and EGFR signaling cause resistance to ALK kinase inhibitors. Cancer Res 2011; 71: 6051–6060.
- [20] Gainor JF, Varghese AM, Ou SH, et al. ALK rearrangements are mutually exclusive with mutations in EGFR or KRAS: an analysis of 1,683 patients with non small cell lung cancer. Clin Cancer Res 2013; 19: 4273–4281.
- [21] Marsilje TH, Pei W, Chen B, et al. Synthesis, structure activity relationships, and in vivo efficacy of the novel potent and selective anaplastic lymphoma kinase (ALK) inhibitor 5 chloro N2 (2 isopropoxy 5 methyl 4 (piperidin 4 yl)phenyl) N4 (2 (isopropylsulfonyl) phenyl)pyrimidine 2,4 diamine (LDK378) currently in phase 1 and phase 2 clinical trials. J Med Chem 2013; 56: 5675–5690.
- [22] Chen J, Jiang C, Wang S. LDK378: a promising anaplastic lymphoma kinase (ALK) inhibitor. J Med Chem 2013; 56: 5673–5674.
- [23] Kinoshita K, Asoh K, Furuichi N, et al. Design and synthesis of a highly selective, orally active and potent anaplastic lymphoma kinase inhibitor (CH5424802). Bioorg Med Chem 2012; 20: 1271–1280.
- [24] Sakamoto H, Tsukaguchi T, Hiroshima S, et al. CH5424802, a selective ALK inhibitor capable of blocking the resistant gatekeeper mutant. Cancer Cell 2011; 19: 679–690.
- [25] Seto T, Kiura K, Nishio M, et al. CH5424802 (RO5424802) for patients with ALK rearranged advanced non small cell lung cancer (AF 001JP study): a single arm, open label, phase 1–2 study. Lancet Oncol 2013; 14: 590–598.
- [26] Shaw AT, Kim DW, Mehra R, et al. Ceritinib in ALK rearranged non small cell lung cancer. N Engl J Med 2014; 370: 1189–1197.
- [27] Mok T, Spigel D, Felip E, et al. ASCEND 2: a single arm, open label, multicenter Phase II study of ceritinib in adult patients (pts) with ALK rearranged (ALK+) non small cell lung cancer (NSCLC) previously treated with chemotherapy and crizotinib (CRZ). Abstract #8059. 2015 American Society of Clinical Oncology (ASCO) Annual Meeting, Chicago, IL, USA.
- [28] Felip E, et al. ASCEND 3: a single arm, open label, multicenter Phase II study of ceritinib in ALKi naïve adult patients (pts) with ALK rearranged (ALK+) non small cell lung cancer (NSCLC). Abstract #8060. 2015 American Society of Clinical Oncology (ASCO) Annual Meeting, Chicago, IL, USA.
- [29] Kris M, Johnson BE, Berry L, et al. Treatment with therapies matched to oncogenic drivers improves survival in patients with lung cancers: results from the lung cancer mutation consortium [WCLC abstract PL03.07] J Thorac Oncol 2013; 8 (Suppl. 2): S3.
- [30] Linardou H, Dahabreh IJ, Kanaloupiti D, et al. Assessment of somatic K RAS mutations as a mechanism associated with resistance to EGFR targeted agents: A systematic review and meta analysis of studies in advanced non small cell lung cancer and metastatic colorectal cancer. Lancet Oncol 2008; 9: 962–972.
- [31] Katayama R, Shaw AT, Khan TM, et al. Mechanisms of acquired crizotinib resistance in ALK rearranged lung cancers. Sci Transl Med 2012; 4: 120ra17.
- [32] Kim S, Kim TM, Kim DW, et al. Heterogeneity of genetic changes associated with acquired crizotinib resistance in ALK rearranged lung cancer. J Thorac Oncol 2013; 8: 415–422.
- [33] Huang D, Kim DW, Kotsakis A, et al. Multiplexed deep sequencing analysis of ALK kinase domain identifies resistance mutations in relapsed patients following crizotinib treatment. Genomics 2013; 102: 157–162.
- [34] Costa DB, Kobayashi S. Acquired resistance to the ALK inhibitor crizotinib in the absence of an ALK mutation. J Thorac Oncol 2012; 7: 623–625.
- [35] Alamgeer M, Ganju V, Watkins DN. Novel therapeutic targets in non small cell lung cancer. Curr Opin Pharmacol 2013; 13: 394–401.