Cinacalcetum
Cinacalcet je prvním kalcimimetikem přicházejícím na náš trh. V první části článku je popsána struktura calcium-senzing receptoru, tedy místo účinku kalcimimetik jako jeho agonistů. Druhá část článku podává přehled současných možností terapie sekundární hyperparatyreózy z hlediska ostatních nových preparátů, ať jde o korekci iontových dysbalancí a nové vazače fosfátů, konzervativní léčbu calcitriolem a jeho novými analogy či invazivní výkony typu paratyreoidektomií a sklerotizací. Ve třetí části článku jsou uvedeny základní poznatky o cinacalcetu v klinické praxi.
Calcium-senzing receptor a sekundární hyperparatyreóza
Objev tzv. calcium-senzing receptoru (CaR), tedy receptoru pro kalcium na membráně buněk příštítných tělísek v roce 1993, se výrazně zapsal do vývoje našeho poznání mechanismů kalciové homeostázy a patofyziologie vzniku sekundární hyperparatyreózy. Calcium-senzing receptor je protein o 121 kDa a má 3 hlavní části: 1) extracelulární o 612 aminokyselinách vázající ligandy, 2) hydrofobní transmembránovou část o 250 aminokyselinách a 3) cytosomální C-terminál přibližně o 250 aminokyselinách [1]. Aktivace CaR extracelulárními kalciovými ionty vede k aktivaci kaskády proteinkináz a fosfolipáz a následně inhibuje sekreci parathormonu z hlavních buněk příštítných tělísek. Naopak aktivace CaR je snížena nízkou hladinou sérového ionizovaného kalcia a následně dochází ke zvýšení sekrece PTH. Zvýšený parathormon (PTH) za normální situace zvyšuje uvolňování vápníku a fosforu z kostí, redukuje renální vylučování kalcia, zvyšuje vylučování fosforu a stimuluje produkci calcitriolu v ledvinách [2]. Při renálním selhání jsou všechny tyto účinky narušeny a hypokalcémie, hyperfosfatémie, nedostatek aktivního metabolitu vitaminu D a rezistence skeletu na PTH jsou hlavními pilíři vzniku sekundární hyperparatyreózy. Calcium-senzing receptor není omezen jen na tkáň příštítných tělísek, ale nachází se i v dalších tkáních – v tlusté části ascendentní Henleovy kličky a ve sběracím kanálku v ledvinách, ve střevě, mozku, plicích, kostech, štítné žláze atd. V některých tkáních byla jeho funkce objasněna (např. v ledvinách), jinde na vysvětlení svého významu teprve čeká [3]. Mutace či inaktivace CaR je příčinou vzniku některých vrozených chorob – např. familiární hypokalciurické hyperkalcémie (FHH) a dalších. Americká doporučení optimálního postupu (K-DOQI Guidelines) pro léčbu kostního a minerálového metabolismu zaměřují pozornost na 4 cílové veličiny, jejichž optimálních hodnot by mělo být správnou léčbou dosaženo [4]. Jde o sérové hladiny PTH, vápníku, fosforu a kalciumfosfátového součinu (Ca-P), u nichž byl prokázán vliv na zvýšenou kardiovaskulární mortalitu u nemocných s chronickým selháním ledvin. Analýza DOPPS databáze, která zahrnuje téměř 8 000 hemodialyzovaných nemocných z Evropy, Spojených států amerických i Japonska, ukázala, že cílových hodnot bylo dosaženo jen u 27 % nemocných pro PTH, 44 % pro fosfor, 51 % pro kalcium a 62% pro Ca-P součin při stávající konvenční terapii [5].
Přehled stávajících možností terapie sekundární hyperparatyreózy
Úprava iontových dysbalancí
V průběhu chronické renální insuficience (CHRI) je pravidelným jevem vývoj negativní kalciové bilance, které je třeba předcházet ještě před zjištěním hypokalcémie. Děje se tak při glomerulární filtraci pod 0,8 ml/s, kdy je průkazný nedostatek calcitriolu (1,25-(OH)2D3), klesá střevní resorpce kalcia a hladiny PTH dále narůstají. Není-li současně zvýšená fosfatémie, podáváme po určitou dobu effervescentní formy kalcia. Ve fázi rozvinuté ledvinové nedostatečnosti s hyperfosfatémií podáváme uhličitan nebo octan vápenatý, jehož molekula je sice chudší na kalcium, avšak střevní kapacita octanu vázat fosfát je dvakrát větší než u uhličitanu. Calcium chloratum u hemodialyzovaných nemocných nepoužíváme, potencuje metabolickou acidózu. Běžnou dávkou calcitriolu do 0,5 µg/den per os se podporuje absorpce kalcia, ale i fosforu. Hyperkalcémie je méně častým jevem, avšak o to závažnějším. Objevuje se jako možný důsledek iatrogenně vyvolaného předávkování výše uvedenými léky nebo je projevem pokročilé sekundární hyperparatyreózy (HPT). Po jejím zjištění se redukuje až vysazuje stávající dávka kalcia a calcitriolu a snažíme se zvýšit mineralizaci skeletu calcitoninem i.v. a/nebo bisfosfonáty. Nejzávažnější případy je nutné řešit hemodialýzou se sníženým obsahem kalcia v dialyzačním roztoku a v případě dekompenzované hyperparatyreózy urgentní paratyreoidektomií (PTE). Hyperfosfatémie je nejproblémovější, život limitující abnormalitou vnitřního prostředí s dopadem na vývoj sekundární HPT, metastatických kalcifikací nejen makroskopických, ale i mikrokalcifikací ve stěně tepen a omezující účinnost léčby vitaminem D. Hyperfosfatémie spolu s vysokým sérovým Ca-P součinem je rizikovým faktorem přežívání nemocných v chronickém dialyzačním léčení. Soubor opatření zaměřených proti nárůstu fosfatémie začíná omezením přísunu bílkovin a potravin s vysokým obsahem fosforu. Nedílnou součástí terapie hyperfosfatémie je použití některého ze střevních vazačů fosfátů. V naší praxi je to především uhličitan vápenatý ve vyšších dávkách. Dříve používaný hydroxid hlinitý byl opuštěn pro nebezpečí hliníkové intoxikace. Značná pozornost se dnes věnuje skupině tzv. nových vazačů fosfátů – látek neobsahujících vápník, hliník ani hořčík, a zbavených tedy nežádoucí hyperkalcémie a hyperaluminémie. Hlavním zástupcem těchto vazačů je syntetický neabsorbovatelný polymer, sevelamer hydrochlorid. Tento preparát na bázi pryskyřice má i vedlejší příznivý účinek – snižuje hladinu LDL cholesterolu. Dalším novým vazačem fosfátů, který neobsahuje vápník, je uhličitan lanthanu, který se občas objevuje i v ČR v rámci výzkumných studií. Posledním typem fosfátových adsorbentů jsou preparáty obsahující trojmocné železo (např. Fe3+ oxid-hydroxid dextran), které jsou však zatím jen ve fázi výzkumu. U všech adsorbentů se zdůrazňuje užívání společně s jídlem. Nezbytnou součástí úpravy iontových dysbalancí je korekce metabolické acidózy.
Konzervativní léčba hyperparatyreózy
Také poznatky o receptorech pro calcitriol v sekrečních buňkách příštítných tělísek (PT) byly léčebně využity. Calcitriol působí na úrovni genové transkripce parathormonu snížením konverze mRNA na prekurzory PTH. Předpokládá se, že vysokými dávkami farmaka podaného nárazově per os nebo i.v. lze dosáhnout natolik účinné hladiny calcitriolu v cirkulaci, že je možné potlačit zvýšenou syntézu a sekreci PTH nezávisle na sérovém kalciu. Konvenční způsob terapie calcitriolem (0,25–0,50 µg/den) pokrývá jen jeho nedostatečnou produkci v ledvinách. Pulzní nárazové dávky jsou přibližně až 10x vyšší a aplikují se 2–3x týdně, zpravidla intravenózně. Vlastní calcitriol poslední dobou nahradil v p.o. podávání pacientům s nepostiženým jaterním parenchymem alfacalcidol (1α-(OH)D3). Pulzní terapie calcitriolem nezaručuje konzervativní zvládnutí všech forem sekundární HPT. Už ze širokého dávkovacího rozpětí je patrné, že úspěch léčení je mj. závislý na velikosti dávky calcitriolu. Pro dosažení léčebného úspěchu by měly být otestovány i vysoké dávky farmaka i.v. S tím úzce souvisí stupeň pokročilosti HPT daný hladinami PTH a velikostí příštítných tělísek. Při PTH nad 800–1000 pg/ml a tělíscích větších než 1 cm v zobrazovacích metodách je výsledek medikamentózního léčení značně nejistý a zpravidla je nutno přistoupit k paratyreoidektomii. Možnosti farmakologického léčení sekundární HPT nejsou vyčerpány calcitriolem. Jsou syntetizována nová analoga calcitriolu, jejichž předností je méně výrazná hyperkalcemická (i hyperfosfatemická) reakce při potlačení sekrece PTH na vzájemně téměř srovnatelné úrovni. Náležejí k nim doxercalciferol (1α-(OH)D2), který je stejně jako výše zmíněný alfacalcidol konvertován v játrech na dihydroxyderivát, a dále zejména v Japonsku používaný maxacalcitol (22-oxacalcitriol), americký paricalcitol (19-nor-1,25-(OH)2D2), falecalcitriol (1,25-(OH)2-26,27-F6D3) a další. Mimo alfacalcidol a paricalcitol však nejsou ostatní analoga calcitriolu u nás v současné době dostupná. Zcela novou skupinou léčiv k terapii sekundární hyperparatyreózy jsou kalcimimetika, jimž je věnován prostor v ostatních částech článku. Výsledky posledních prací dokumentují prioritní úlohu kalciových receptorů v regulaci funkce PT a naznačují, že kalcimimetika by se mohla v budoucnu stát základním lékem v léčbě HPT.
Nefarmakologické možnosti terapie
Paratyreoidektomie (PTE) I když v posledním desetiletí byly formulovány další poznatky o patogenezi renální osteopatie, především ve vztahu k sekundární HPT, a o způsobech jejího léčení, je chirurgický zákrok na PT nadále žádaným výkonem. Při selhání konzervativní léčby provádíme buď totální paratyreoidektomie s autoimplantací částí tkáně do svalových snopců (nejčastěji v oblasti předloktí), nebo parciální PTE. V dnešní době je nedílnou součástí totální PTE kryokonzervace tkáně příštítných tělísek, která umožňuje event. reimplantaci tkáně v případě pooperační hypoparatyreózy. Čím radikálnější výkon na PT je proveden, tím vyšší je riziko následné hypoparatyreózy, naopak čím méně radikální výkon, tím větší riziko nedostatečného účinku a recidivy hyperparatyreózy ze zbytkové tkáně PT s nutností reoperací.
Sklerotizace příštítných tělísek (percutaneous ethanol injection therapy – PEIT)
Metoda označovaná také jako chemická paratyreoidektomie je vhodná u nemocných, u nichž je operace či reoperace na PT nezbytná, klasická PTE se však jeví jako rizikový zákrok. U těchto nemocných je možné se pokusit destruovat tkáň dobře přístupných PT přímou perkutánní aplikací koncentrovaného ethanolu kontrolovanou sonograficky. Tento postup nemusí být vždy optimální, protože nelze očekávat, že se zdaří infiltrovat veškerou zbytnělou tkáň, vyjma případů solitárního adenomu. Navíc jsou možné komplikace z úniku ethanolu do okolí PT s následnou parézou n. laryngeus recurrens. Proto k jejímu provedení přistupujeme až po vyčerpání všech možností konzervativního a chirurgického léčení včetně modifikací ve vedení anestezie.
První kalcimimetikum – cinacalcet
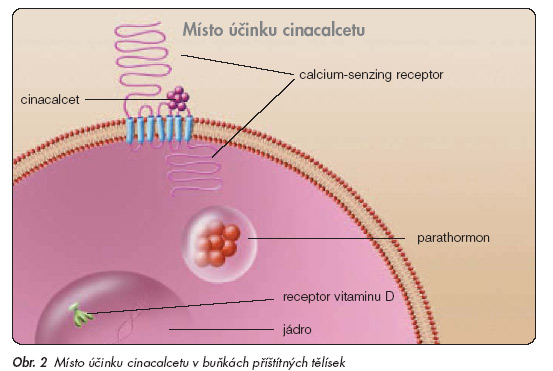
Kalcimimetika jsou zcela novou skupinou léčiv, která lze využít k potlačení hyperparatyreózy, jde o agonisty calcium- senzing receptoru (obr. 2).
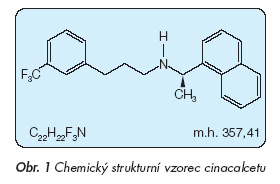
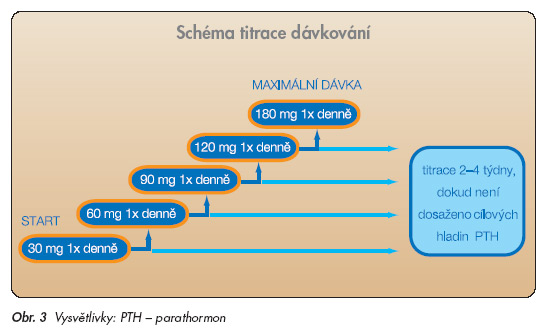
Známe 2 typy kalcimimetik. I. typ tvoří kalcimimetika, která ovlivňují extracelulární část receptoru – jedná se především o dvoja trojmocné ionty – vápník, hořčík a hliník. II. typ tvoří kalcimimetika, která ovlivňují transmembránovou část receptoru, indukují jeho konformační změny, a zvyšují tím senzitivitu receptoru pro kalcium. Přítomnost kalcia je nezbytná k aktivaci CaR. Pro úplnost nutno dodat, že dnes existují i antagonisté CaR, pro něž se vžil název kalcilytika a která stimulují sekreci PTH [6]. Původní výzkum se zaměřoval na kalcimimetika tzv. první generace – nejvíce popisovanou substancí se stal preparát R568 (tecalcet), jehož výzkum byl později zastaven ve prospěch kalcimimetik druhé generace [7]. Prvním zástupcem druhé generace kalcimimetik II. typu přicházejícím na náš trh je cinacalcet, původně nazývaný AMG073. Cinacalcet je chemicky N-[1-(R)-(1naphthyl) ethyl]-3-[3-(trifluoromethyl)phenyl]- -1-aminopropan hydrochlorid (obr. 1). Cinacalcet je rychle absorbován ze zažívacího traktu a vrcholu koncentrace dosahuje 2–6 hodin po p.o. podání. Přibližně 97 % cinacalcetu je vázáno na plazmatické proteiny, a díky tomu není odstraňován dialýzou. Poločas rozpadu je od 30 do 40 hodin, proto je možné podávání 1x denně. Rovnovážných hladin léku v séru je dosaženo cca po 7 dnech. Cinacalcet se metabolizuje v játrech a jeho metabolity jsou biologicky inaktivní, jsou vylučovány do cirkulace a následně (u zdravých dobrovolníků) eliminovány ledvinami. Renální insuficience ani dialýza neovlivňují sérové koncentrace cinacalcetu, a není tudíž nutná úprava dávkování. U středně těžké a těžké jaterní insuficience (Child-Pugh B a C) je několikanásobně zvýšena AUC a prodloužen poločas. Účinek na snížení PTH je závislý na velikosti dávky, proto se doporučuje zahájit podávání léku v dávce 30 mg 1x denně a následně titrovat vhodnou dávku u každého nemocného zvyšováním o 30 mg na 60, 90, 120 či až 180 mg 1x denně (obr. 3) [8,9].
Výrobce dokumentuje v rozsáhlých klinických studiích III. fáze na více než 1 100 dialyzovaných nemocných v USA, Kanadě, Austrálii a EU výbornou účinnost cinacalcetu, zejména při redukci sérových hladin PTH (primární end-point) [10], ale i v ostatních veličinách podstatných při úpravě kalciumfosfátového metabolismu (hladiny vápníku, fosforu a Ca-P). Základní 3 mezinárodní studie III. fáze byly prováděny jako randomizované, dvojitě slepé studie srovnávané s placebem u nemocných v chronickém renálním selhání se sekundární hyperparatyreózou léčených hemodialýzou nebo peritoneální dialýzou. Účinek cinacalcetu byl jednoznačně prokázán jak za situace samostatného použití, např. při vysokém Ca-P, kdy jsou preparáty vitaminu D kontraindikovány, tak i při různých kombinacích s vazači fosfátů včetně sevelameru a při současné terapii vitaminem D. Další studie se zabývala prodloužením podávání cinacalcetu až na 3 roky, po celou tuto dobu nebyla zaznamenána žádná degradace účinků léčby. Prokázána byla dále redukce biochemických markerů kostního metabolismu (kostní isoenzym ALP, sérová hladina N telopeptidu kolagenu) a snížení rizika fraktur a paratyreoidektomie. Popsán byl i vzestup denzity kostního minerálu v oblasti krčku kyčelního kloubu po 1roční léčbě cinacalcetem [11]. Zatímco v terapii sekundární hyperparatyreózy se používají řádově desítky mg/den, je známo i použití cinacalcetu u několika pacientů s primární hyperparatyreózou a s karcinomem PT, v těchto případech se pak jedná spíše o stovky mg/den. Tolerance tohoto léku byla v klinických studiích srovnatelná s placebem s výjimkou gastrointestinálních obtíží (nauzea, zvracení, průjem a bolesti břicha), které se objevovaly u 2–5 % pacientů a v převážné většině případů vymizely po několika dávkách, aniž by bylo nutno léčbu přerušovat. Podmínkou podávání kalcimimetik je samozřejmě monitorace hladin sérového kalcia tak, aby se předešlo event. hypokalcémii s následnou možností křečových projevů. Také cíl léčby – pokles hladin PTH – by měl být včas zachycen a dávka kalcimimetika následně snížena či vysazena. Při podávání cinacalcetu byl u cca 30 % mužů pozorován pokles sérových hladin testosteronu nejasného významu a etiologie. Cinacalcet je metabolizován na cytochromu P-450 (zejména CYP3A4 a CYP1A2), a léčba může být tedy ovlivněna interakcí s dalšími léčivy (ketoconazol, itraconazol, rifampicin, ciprofloxacin apod.), dávka musí být tedy v těchto případech pečlivě titrována. U kuřáků je indukován CYP1A2, proto je u nich clearance cinacalcetu pozorována cca o třetinu vyšší než u nekuřáků. O případném vlivu cinacalcetu na těhotné a kojící ženy není zatím dostatek informací. Zavedení cinacalcetu jako prvního představitele nové skupiny léků – kalcimimetik – do klinické praxe otvírá nové možnosti kauzální konzervativní léčby sekundární hyperparatyreózy (ale i ostatních typů hyperparatyreóz a karcinomu PT) a v budoucnu by se tento preparát mohl stát základním lékem první volby při těchto onemocněních.
Seznam použité literatury
- [1] Brown EM. Calcium receptor and regulation of parathyroid hormone secretion. Rev Endocrinol Metab Dis 2000;1:307–15.
- [2] Nemeth EF, Heaton WH, Miller M, et al. Pharmacodynamics of the type II calcimimetic compound cinacalcet HCl. J Pharmacol Exp Ther 2004;308:627–35.
- [3] Frazao JM, Martins P, Coburn JW. The calcimimetics agents: perspective for treatment. Kidney International 2002;61(suppl. 80): S149–S154.
- [4] NKF-K/DOQI clinical practice guidelines for bone metabolism and disaese in chronic kidney disease. Am J Kidney Dis 2003;42(suppl.3): S1–S201.
- [5] Moe SM, Chertow GM, Coburn JW, et al. Achieving NKF-K/DOQI bone metabolism and disease treatment goals with cinacalcet HCl. Kidney Int 2005;67:760–71.
- [6] Goodman WG. Recent developments in the management of secondary hyperparathyroidism. Kidney Int 2001;59:1187–201.
- [7] Ureňa P. Use of calcimimetics in uremic patients with secondary hyperparatyhroidism: review. Artif Organs 2003;27:759–64.
- [8] Block GA, Martin KJ, de Francisco ALM, et al. Cinacalcet for secondary hyperparathyroidism in patients receiving hemodialysis. N Engl J Med 2004;350:1516–25.
- [9] De Francisco ALM, Suranyi M, Cunningha, J, et al. Oral cinacalcet HCl (AMG073) for treatment of hemodialysis patients with secondary hyperparathyroidism: results of European/Australian Phase 3 study. J Am Soc Nephrol 2003;14:462A.
- [10] Goodman WG, Hladik GA, Turmer SA, et al. The calcimimetics agent AMG 073 lowers plasma parathyroid hormone levels in hemodialysis patients with secondary hyperparathyroidism J Am Soc Nephrol 2002;13:1017–24.
- [11] Quarles L, Spiegel D, Curzi M, et al. The effects of one-year treatment with calcimimetic AMG-073 on bone health in ESRD patients with secondary hyperparathyroidism (SHPT). J Am Soc Nephrol 2002;13:572A–3A.