Čtyřletá data účinnosti a bezpečnosti léčby ofatumumabem u relabující roztroušené sklerózy – studie ALITHIOS
ALITHIOS představuje probíhající otevřenou extenzní studii, která byla zahájena roku 2018 k posouzení dlouhodobé účinnosti a bezpečnosti léčby ofatumumabem u pacientů s relabující roztroušenou sklerózou. Recentní publikace přináší čtyřletá data o efektivitě a bezpečnosti léku [1].
Úvod
Ofatumumab je plně humánní monoklonální protilátka anti‑CD20 schválená pro léčbu pacientů s relabující roztroušenou sklerózou (RS) [2,3]. Schválení léku proběhlo na základě výsledků studií fáze III ASCLEPIOS I a ASCLEPIOS II, které prokázaly jeho účinnost ve srovnání s teriflunomidem a příznivý bezpečnostní profil až po dobu 2,5 roku [4,5]. Při léčbě ofatumumabem bylo dosaženo primárního cílového ukazatele v podobě snížení roční míry relapsů (annual relapse rate, ARR) – 51 % v ASCLEPIOS I a 58 % v ASCLEPIOS II (oba p < 0,001) – a byla doložena vyšší účinnost oproti teriflunomidu u většiny sekundárních cílových ukazatelů [4].
Pro další posouzení poměru přínosů a rizik léčby ofatumumabem u relabující RS a její dlouhodobé bezpečnosti byli pacienti ze studií s tímto lékem (ASCLEPIOS I/II, APLIOS a APOLITOS) [4,6,7] převedeni do otevřené extenze fáze IIIb ALITHIOS, kde pokračovali v terapii ofatumumabem nebo přešli od placeba/teriflunomidu k ofatumumabu. Po 3,5 roku sledování ve studii ALITHIOS byl ofatumumab dobře tolerován bez nových bezpečnostních signálů [8]. Nové údaje naznačují, že včasné zahájení vysoce účinné léčby relabující RS zlepšuje dlouhodobé výsledky terapie v porovnání s jejím opožděným zahájením či eskalací z terapie s nižší účinností [9–11].
Uspořádání studie a charakteristika pacientů
Pro probíhající studii ALITHIOS byly definovány dvě skupiny pacientů. První zahrnula pacienty randomizované k podávání ofatumumabu ve studiích ASCLEPIOS I/II a na základě analýzy bezpečnosti nemocné, kteří dostali ≥ 1 dávku ofatumumabu ve studiích ASCLEPIOS I/II, APLIOS nebo APOLITOS. Do druhé skupiny byli na základě analýzy účinnosti a bezpečnosti zařazeni pacienti, kterým byl ve studiích ASCLEPIOS I/II podáván teriflunomid a ve studii ALITHIOS byli převedeni na ofatumumab [1].
Primární cílové ukazatele zahrnují ARR; potvrzené zhoršení disability (confirmed disability worsening, CDW), průměrný počet T1 gadolinium enhancujících (Gd+) lézí na jeden magnetickorezonanční (MR) snímek; počet nových/zvětšujících se T2 lézí za rok; koncentrace lehkých řetězců neurofilament (sNfL) oproti výchozí hodnotě v klinických studiích ASCLEPIOS I/II za 3–12 měsíců po výchozím stavu a poté každých šest měsíců; status NEDA‑3 (no evidence of disease activity) – absence šestiměsíčního CDW, potvrzených relapsů a aktivity na MR (žádné nové T1 Gd+ léze nebo nové/zvětšující se T2 léze) v základní sledovací periodě a v extenzi, v prvním roce, po prvním roce a celkově.
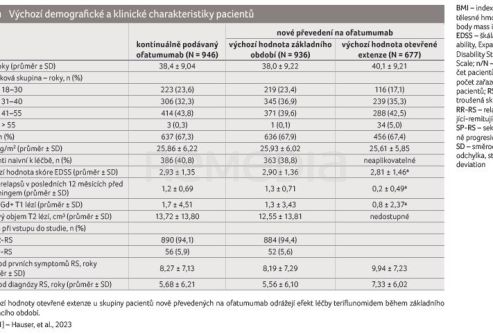 Do analýzy účinnosti bylo celkem zařazeno 1 882 pacientů – ve studiích ASCLEPIOS I/II bylo 936 nemocných randomizováno k léčbě teriflunomidem a 946 nemocných k léčbě ofatumumabem. Celkem 72,6 % pacientů (n = 677 pro teriflunomid, n = 690 pro ofatumumab) vstoupilo do studie ALITHIOS. Základní demografické údaje a charakteristiky pacientů shrnuje tabulka 1 [1]. V otevřené extenzi byly nejčastějšími důvody pro přerušení léčby ofatumumabem nežádoucí účinky a rozhodnutí pacienta.
Do analýzy účinnosti bylo celkem zařazeno 1 882 pacientů – ve studiích ASCLEPIOS I/II bylo 936 nemocných randomizováno k léčbě teriflunomidem a 946 nemocných k léčbě ofatumumabem. Celkem 72,6 % pacientů (n = 677 pro teriflunomid, n = 690 pro ofatumumab) vstoupilo do studie ALITHIOS. Základní demografické údaje a charakteristiky pacientů shrnuje tabulka 1 [1]. V otevřené extenzi byly nejčastějšími důvody pro přerušení léčby ofatumumabem nežádoucí účinky a rozhodnutí pacienta.
Do analýzy bezpečnosti bylo zařazeno 1 969 pacientů. Základní demografické údaje a charakteristiky pacientů byly u obou skupin (osoby s kontinuálně podávaným ofatumumabem a osoby nově převedené na léčbu ofatumumabem) srovnatelné.
Celková expozice ofatumumabu činila 4 032,5 pacientoroku a průměrná expozice ofatumumabu pro obě skupiny 2,9, resp. 1,9 roku. Průměrná adherence k léčbě ofatumumabem přesahovala 95 %.
Hodnocení klinické účinnosti
Relapsy onemocnění
U první skupiny pacientů s kontinuálně podávaným ofatumumabem byla zachována nízká ARR po dobu až čtyř let. V základním sledování byla zaznamenána adjustovaná ARR 0,11 (95% interval spolehlivosti [CI] 0,08–0,13) a v extenzi 0,05 (95% CI 0,04–0,07) – 49,4 %; p < 0,001. Ve druhé skupině byla ARR snížena o 71,7 % v extenzi oproti základní periodě (p < 0,001); adjustovaná ARR činila 0,23 (95% CI 0,18–0,28), resp. 0,06 (95% CI 0,05–0,09). Kumulativní počet potvrzených relapsů byl v první skupině (n = 269; 3 123,4 roku) o 43,4 % nižší ve srovnání s druhou skupinou (n = 475; 3 042,2 roku) [1].
Potvrzené zhoršení disability
Kumulativní míra tříměsíčního a šestiměsíčního CDW (3/6mCDW) zůstala nízká ve skupině s kontinuální léčbou ofatumumabem oproti skupině pacientů nově převedených na ofatumumab (3mCDW ve 48. měsíci: 19,1 %, resp. 23,1 %, p = 0,021; 6mCDW ve 48. měsíci: 15,8 %, resp. 18,9 %, p = 0,066). Kumulativní počet 3/6mCDW byl o 17,9 % a 16,0 % nižší v první skupině oproti skupině druhé (3mCDW: n = 156 vs. n = 190; 6mCDW: n = 131 vs. n = 156) [1].
Hodnocení MR aktivity
Téměř úplné potlačení aktivity na MR bylo po dobu čtyř let zaznamenáno u první skupiny pacientů. Adjustovaný průměrný počet Gd+ T1 lézí/MR snímek v základním sledování činil 0,02 (95% CI 0,02–0,03) a v extenzi 0,01 (95% CI 0,00–0,02), došlo ke snížení o 65,0 % (p = 0,003). Pro druhou skupinu byl tento parametr redukován o 97,4 % (p < 0,001) z 0,55 (95% CI 0,47–0,65) v základním období na 0,01 (95% CI 0,01–0,02) v otevřené extenzi. Kumulativní počet Gd+ T1 lézí byl v první skupině (n = 66) o 95 % nižší (p < 0,001) oproti druhé skupině (n = 1 310). Kontinuální léčba ofatumumabem vedla k 87,9% snížení (p < 0,001) adjustované četnosti nových/zvětšujících se T2 lézí za rok (základní období 0,66, 95% CI 0,59–0,74; extenze 0,08, 95% CI 0,07–0,10). Redukce byla doložena rovněž u druhé skupiny, kde se adjustovaná četnost nových/zvětšujících se T2 lézí snížila z 4,31 (95% CI 3,92–4,74) v základním období na 0,58 (95% CI 0,51–0,65) v otevřené extenzi (86,6 %; p < 0,001). Kumulativní počet nových/zvětšujících se T2 lézí v první skupině (n = 1 361) poklesl o 83,5 % (p < 0,001) v porovnání s druhou skupinou (n = 8 229) [1].
Koncentrace sNfL
V základním sledovacím období byly koncentrace sNfL nižší pro ofatumumab v porovnání s teriflunomidem (12. měsíc: 8,03 pg/ml vs. 10,25 pg/ml; 24. měsíc: 7,96 pg/ml vs. 9,97 pg/ml; oba p < 0,001). V otevřené extenzi zůstaly koncentrace sNfL nízké u pacientů s kontinuální léčbou ofatumumabem (24. měsíc: 8,50 pg/ml). Při přechodu z teriflunomidu na ofatumumab koncentrace sNfL poklesly; u pacientů nově léčených ofatumumabem zůstaly koncentrace sNfL vyšší oproti skupině s kontinuální léčbou až šest měsíců po převedení (9,07 pg/ml vs. 8,31 pg/ml; p < 0,001), ale po 24 měsících byly nízké v obou skupinách (8,23 pg/ml vs. 8,50 pg/ml). Prospěch z nepřetržité léčby ofatumumabem byl u daného cílového ukazatele patrný po dobu až 48 měsíců [1].
Status NEDA‑3
Pravděpodobnost udržení stavu NEDA‑3 po dobu až čtyř let byla více než třikrát vyšší při časném zahájení léčby ofatumumabem. Větší podíl pacientů z první skupiny si udržel NEDA‑3 v průběhu základního sledování: 36,7 % oproti 16,1 % (poměr šancí [OR] 3,53; 95% CI 2,76–4,51; p < 0,001); v otevřené extenzi to bylo 78,8 % oproti 51,0 % (OR 3,89; 95 % CI 3,01–5,02; p < 0,001) a celkově 30,5 % oproti 12,6 % (OR 3,51; 95% CI 2,69–4,57; p < 0,001).
Z důvodu hodnocení efektu ofatumumabu na rychlé potlačení zánětlivé aktivity na MR byl status NEDA‑3 stanoven v prvním roce léčby. V základním období byla pravděpodobnost udržení NEDA‑3 během prvního roku přibližně trojnásobně vyšší u ofatumumabu oproti teriflunomidu (47,9 % vs. 25,1 %; OR 3,38; 95% CI 2,70–4,23; p < 0,001) a 10krát vyšší po této době (84,2 % vs. 36,9 %; OR 9,98; 95% CI 7,76–12,84; p < 0,001). V otevřené extenzi udrželo v průběhu prvního roku status NEDA‑3 celkem 85,8 % pacientů z první skupiny a 58,6 % pacientů ze skupiny druhé (OR 4,68; 95% CI 3,54–6,18; p < 0,001). Následně se podíl pacientů s NEDA‑3 ve druhé skupině zvýšil na 86,4 % a byl srovnatelný s první skupinou (90,4 %; OR 1,55; 95% CI 1,07–2,22; p = 0,019) [1].
Bezpečnost
Bezpečnost léčby ofatumumabem byla v souladu s předchozími zjištěními [4,8] a neobjevily se žádné nové bezpečnostní signály. Celkově byl v souboru pacientů ≥ 1 nežádoucí účinek (adverse event, AE) zaznamenán u 86,23 % osob; míra incidence adjustovaná na expozici (exposure‑adjusted event rate, EAIR) byla 135,11 na 100 pacientoroků (95% CI 128,83–141,69). Ve studiích ASCLEPIOS I/II byl během základního sledovacího období při léčbě ofatumumabem ≥ 1 AE doložen u 83,61 % pacientů a EAIR činila 188,55 (95% CI 175,86–202,16). Výskyt AE vedoucích k přerušení léčby byl nízký. Nejčastěji hlášenými AE byly infekce a infestace, EAIR závažných infekcí zůstala stabilní. Pouze malý podíl závažných infekcí tvořily infekce 4. stupně (0,3 %).
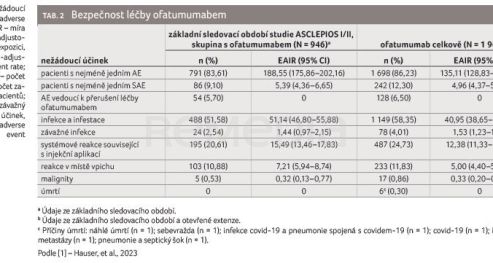 Dále autoři studií hodnotili sérové koncentrace imunoglobulinu G a M, počet lymfocytů a koncentrace neutrofilů, systémové reakce související s injekční aplikací a výskyt malignit. Bezpečnostní profil shrnuje tabulka 2 [1]. V průběhu extenze bylo hlášeno šest úmrtí (z počtu 1 969 osob), která však nesouvisela s léčbou ofatumumabem.
Dále autoři studií hodnotili sérové koncentrace imunoglobulinu G a M, počet lymfocytů a koncentrace neutrofilů, systémové reakce související s injekční aplikací a výskyt malignit. Bezpečnostní profil shrnuje tabulka 2 [1]. V průběhu extenze bylo hlášeno šest úmrtí (z počtu 1 969 osob), která však nesouvisela s léčbou ofatumumabem.
Diskuse
Uvedená průběžná analýza poskytuje nové poznatky o dlouhodobé účinnosti a bezpečnosti léčby ofatumumabem u pacientů s relabující RS a dokládá příznivý profil přínosů a rizik. Nízká četnost relapsů při léčbě ofatumumabem ve studiích ASCLEPIOS I/II [4] byla v otevřené extenzi dále redukována, navíc téměř kompletní potlačení aktivity na MR a nízké riziko CDW prokázaly setrvalou účinnost ofatumumabu po dobu čtyř let.
Včasné zahájení vysoce účinné léčby u relabující RS zlepšuje dlouhodobé výsledky ve srovnání s opožděně zahájenou terapií nebo s přechodem z méně efektivní terapie [9–11]. Porovnání kontinuální léčby ofatumumabem s přechodem na ofatumumab z teriflunomidu prokázalo kumulativní přínos (až čtyři roky) časného zahájení terapie ofatumumabem s ohledem na kumulativní počet relapsů a počet Gd+ T1 lézí a nových/zvětšujících se T2 lézí. Rovněž šance na udržení stavu NEDA‑3 byla v průběhu extenze třikrát vyšší při časném zahájení léčby. Po prvním roce léčby v základním sledovacím období byl u vysokého podílu pacientů (84,2 %) z první skupiny zachován stav NEDA‑3 a tento trend pokračoval i po celou dobu otevřené extenze. Oproti tomu pouze 36,9 % pacientů randomizovaných k léčbě teriflunomidem udrželo po roce status NEDA‑3. Největší rozdíly mezi oběma skupinami v souvislosti s NEDA‑3 byly zaznamenány u parametrů nových/zvětšujících se T2 lézí a Gd+ T1 lézí. Pacienti původně randomizovaní k léčbě teriflunomidem byli vystaveni vyššímu riziku, že neudrží NEDA‑3 v prvním roce, především z důvodu aktivity na MR. Extenze prokázala, že i u pacientů původně léčených teriflunomidem se při delší léčbě zvyšuje šance na udržení NEDA‑3 – byl prokázán vzestup na 9/10 pacientů a stav byl setrvalý až po dobu čtyř let.
Výsledky analýzy potvrzují také význam přechodu z terapie s nízkou účinností na léčbu ofatumumabem. Ve druhé skupině pacientů došlo k výraznému snížení ARR spolu s téměř úplným potlačením aktivity Gd+ T1 lézí, k významnému poklesu četnosti nových/zvětšujících se T2 lézí, trvalé redukci koncentrací sNfL a zvýšila se pravděpodobnost udržení stavu NEDA‑3.
Kumulativní údaje o bezpečnosti ukazují, že léčba ofatumumabem je pacienty s relabující RS dobře snášena a nebyla zjištěna žádná nová rizika. Tolerance léčby ofatumumabem se projevila vysokou mírou adherence k terapii a nízkým výskytem přerušení léčby v základním sledování i v otevřené extenzi. Hodnoty EAIR, výskyt AE a závažných AE byly v souladu s dříve hlášenými příhodami ve studiích ASCLEPIOS I/II [4]. Celkově byla bezpečnost léčby v souladu s předchozími průběžnými analýzami s dobou trvání až 3,5 roku [8].
Závěr
Prezentované analýzy údajů o dlouhodobé efektivitě ofatumumabu z otevřené extenze ALITHIOS posilují důkazy o prospěchu ze včasného zahájení léčby vysoce účinnou terapií u pacientů s relabující RS [4,10] a potvrzují příznivý bezpečnostní profil dlouhodobého užívání až po dobu čtyř let. Časné zahájení vysoce účinné léčby, jako je ofatumumab, může pomoci snížit zátěž onemocněním, redukovat riziko progrese relabující RS a přispět k dlouhodobějšímu zlepšení kvality života [12].
Literatura
[1] Hauser SL, Zielman R, Gupta AD, et al. Efficacy and safety of four‑year ofatumumab treatment in relapsing multiple sclerosis: The ALITHIOS open‑label extension. Mult Scler J 2023; 29: 1452–1464.
[2] US Food and Drug Administration. Kesimpta (ofatumumab) prescribing information. Dostupné na: https://www.novartis.us/sites/www.novartis.us/files/kesimpta.pdf.
[3] European Medicines Agency. Kesimpta SmPC. Dostupné na: https://www.ema.europa.eu/en/documents/productinformation/kesimpta‑epar‑product‑information_en.pdf.
[4] Hauser SL, Bar‑Or A, Cohen JA. Ofatumumab versus teriflunomide in multiple sclerosis. N Engl J Med 2020; 383: 546–557.
[5] Novartis Press Release. FDA approves Novartis Kesimpta (ofatumumab), the first and only selfadministered, targeted B‑cell therapy for patients with relapsing multiple sclerosis. Dostupné na: https://www.novartis.com/news/media‑releases/fda‑approves‑novartis‑kesimptaofatumumab‑first‑and‑only‑self‑administered‑targetedb‑cell‑therapy‑patients‑relapsing‑multiple‑sclerosis.
[6] Bar‑Or A, Wiendl H, Montalban X, et al. Rapid and sustained B‑cell depletion with subcutaneous ofatumumab in relapsing multiple sclerosis: APLIOS, a randomized phase‑2 study. Mult Scler 2022; 28: 910–924.
[7] Kira JI, Nakahara J, Sazonov DV, et al. Effect of ofatumumab versus placebo in relapsing multiple sclerosis patients from Japan and Russia: Phase 2 APOLITOS study. Mult Scler 2021; 28: 1229–1238.
[8] Hauser SL, Cross AH, Winthrop K, et al. Safety experience with continued exposure to ofatumumab in patients with relapsing forms of multiple sclerosis for up to 3.5 years. Mult Scler 2022; 28: 1576–1590.
[9] Harding K, Williams O, Willis M, et al. Clinical outcomes of escalation vs early intensive disease‑modifying therapy in patients with multiple sclerosis. JAMA Neurol 2019; 76: 536–541.
[10] He A, Merkel B, Brown JWL, et al. Timing of high‑efficacy therapy for multiple sclerosis: A retrospective observational cohort study. Lancet Neurol 2020; 19: 307–316.
[11] Iaffaldano P, Lucisano G, Caputo F, et al. Long‑term disability trajectories in relapsing multiple sclerosis patients treated with early intensive or escalation treatment strategies. Ther Adv Neurol Disord 2021; 14: 17562864211019574.
[12] Ziemssen T, De Stefano N, Sormani MP, et al. Optimizing therapy early in multiple sclerosis: An evidence‑based view. Mult Scler Relat Disord 2015; 4: 460–469.