Úvod
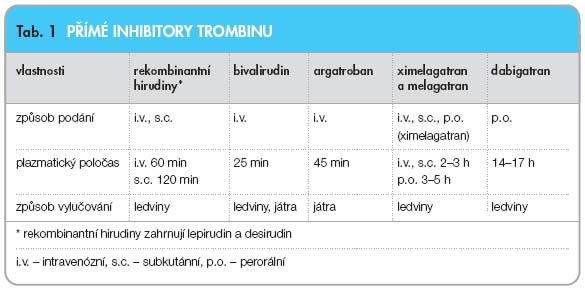
Dabigatran je nový perorální přímý inhibitor trombinu. Dabigatran je jedním z nejprogresivnějších nových antikoagulancií v klinickém výzkumu. Začátkem roku 2008 vydala EMEA (European Medicines Agency) pozitivní doporučení pro jeho použití v prevenci venózního tromboembolismu (VTE) po totálních náhradách kolenního a kyčelního kloubu v Evropské unii. Dabigatran je vedle ximelagatranu, který nebyl pro svoji hepatotoxicitu doporučen pro využití v klinické praxi, jediným perorálně podávaným inhibitorem trombinu (
tab. 1
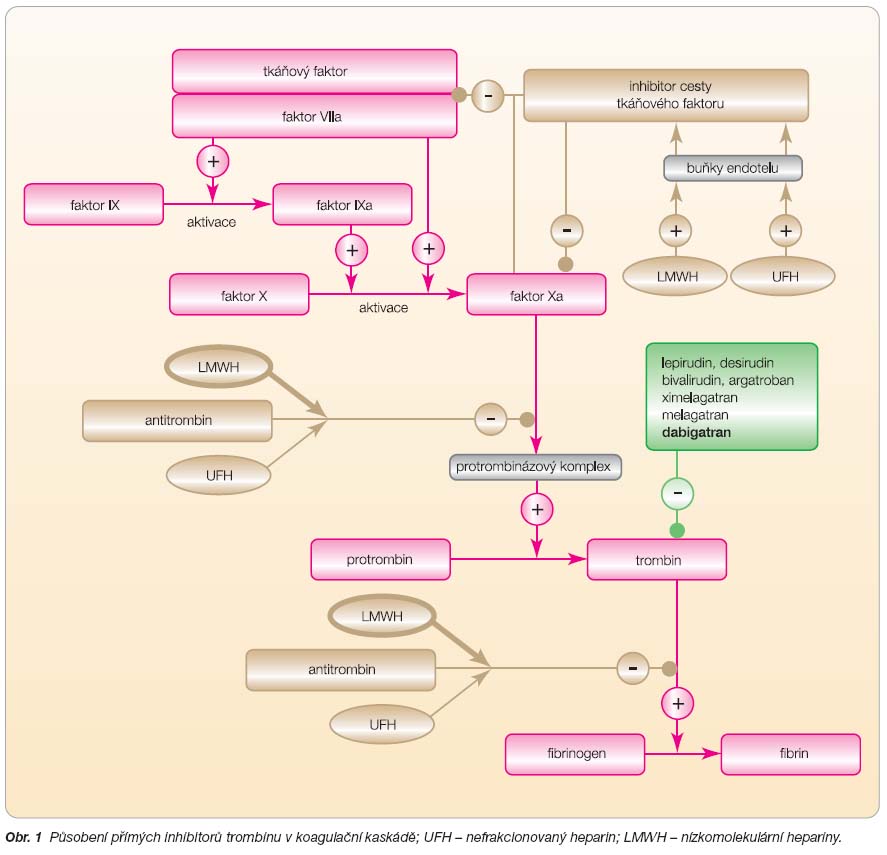
). Dabigatran specificky a cíleně inhibuje volný i vázaný trombin a zabraňuje tvorbě krevní sraženiny (
obr. 1
).
Farmakologický profil
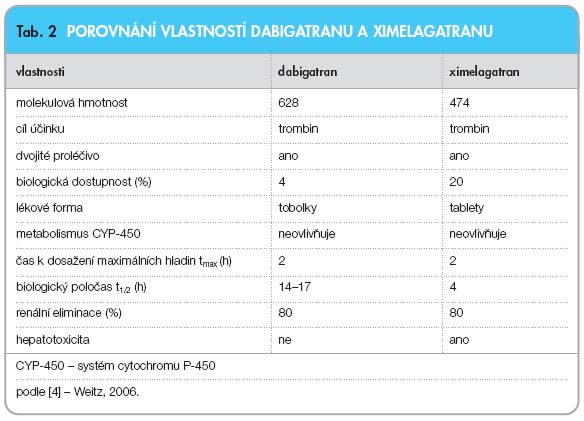
Dabigatran etexilát (BIBR 1048, m. h. 628) je dvojité proléčivo, které se enzymatickou přeměnou (hydrolytické štěpení katalyzované esterázou) po absorpci v trávicím traktu mění na aktivní metabolit dabigatran (BIBR 953, m. h. 471) [1, 2]. Biologická přeměna dabigatran etexilátu na dabigatran začíná ve střevě, do portální žíly vstupuje proléčivo i aktivní látka. V játrech je přeměna dokončena (konjugace na farmakologicky aktivní acylglukuronid) a přibližně 20 % léčiva je vyloučeno biliárním systémem. Systém cytochromu P-450 hraje v metabolismu dabigatranu jen malou roli, což je výhodné – riziko lékových interakcí je tedy nízké. Biologická dostupnost dabigatranu (etexilátu) je jen kolem 4 %, k dosažení potřebných plazmatických koncentrací léčiva je tedy nutno podávat relativně vysoké dávky [3]. Dabigatran se poměrně málo váže na plazmatické bílkoviny (34–35 %).
Vstřebávání dabigatranu v žaludku a v tenkém střevě závisí na kyselém prostředí, je sníženo o cca 20–25 % u pacientů, kteří jsou léčeni inhibitory protonové pumpy [4]. Naopak při současném podávání dabigatranu a amiodaronu je
potřeba významně redukovat dávky kvů
li
nebezpečí interakce s přenašečem glyko
proteinu P. S ohledem na dlouhý poločas amiodaronu může potenciál pro lékovou interakci přetrvávat týdny po ukončení léčby amiodaronem. U pacientů, kteří současně užívají dabigatran a amiodaron, je nutno snížit dávku dabigatranu na 150 mg denně. Je nutná opatrnost při podávání silných inhibitorů glykoproteinu P, jako je verapamil, klarithromycin a další. Léčba inhibitorem glykoproteinu P chinidinem je při podávání dabigatranu kontraindikována [5].
Dabigatran má rychlý nástup účinku (přibližně do 2 hodin po podání u zdravých dobrovolníků), poločas účinku je kolem
8 hodin po jednorázovém podání a zvy
šu
je se na 14–17 hodin během opakované
ho podávání [6, 7]. Pro tento dlouhý poločas účinku je možné v některých indikacích podávat dabigatran jen jednou denně. Dabigatran je v nezměněné formě z 80 % vylučován ledvinami [1, 2]. V důsledku toho se může zvyšovat jeho plazmatická koncentrace při renální insuficienci. Dabigat
ran by neměl být podáván pacientům
s clearance kreatininu nižší než 30 ml/min; je dialyzovatelný. Dabigatran prodlužuje aktivovaný parciální tromboplastinový test (aPTT), ale toto ovlivnění není závislé na dávce. Naopak minimálně ovlivňuje tromboplastinový test (protrombinový čas, INR). Přesto není nutné účinek léku laboratorně monitorovat [4].
Na základě omezených klinických
zkušeností [8, 9] bylo zjištěno pouze mini
mální zvýšení hodnot jaterních testů
(≥ 3násobné zvýšení sérové hladiny alanin aminotransferázy a ≥ 2násobné zvýšení hladiny bilirubinu) ve srovnání s léčbou ximelagatranem. Přesto se nedoporučuje podávat dabigatran nemocným s poruchami funkce jater, kteří dosahují více než dvojnásobku horní hranice normálních hodnot jaterních testů.
Tab. 2
a
tab.
3
porovnávají a rozlišují vlastnosti a účin
ky dabigatranu a ximelagatranu, resp. war
farinu a nízkomolekulárních heparinů (LMWH).
Klinické studie
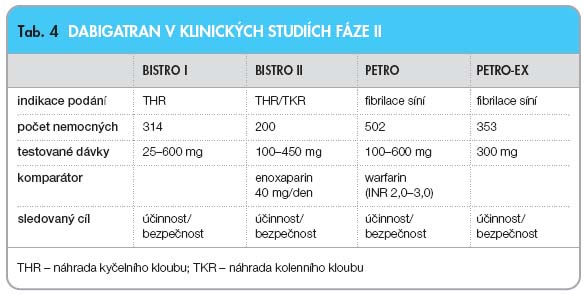
V klinických studiích fáze II s dabigatranem byla stanovována dávka a také bezpečnost a účinnost léčiva. Byly prováděny studie v rámci prevence VTE po totální náhradě kolenního a kyčelního kloubu (BISTRO I a BISTRO II) [8, 9] v porovnání s enoxaparinem a také bylo sledováno využití dabigatranu v prevenci tromboembolie u nemocných s fibrilací síní ve srovnání s warfarinem (PETRO a PETRO-EX) [10, 11] (
tab. 4
). Ve studii BISTRO II byla prokázána účinnost a bezpečnost dabigatranu (byl podáván 1–4 hodiny po operaci po dobu 6–10 dní) u obou sledovaných skupin (elektivní náhrada kolenního
a kyčelního kloubu) v závislosti na dávce. Dávka 300 mg a 450 mg denně byla účinnější, ale její podávání bylo provázeno vyšším výskytem závažných krvácení ve srovnání s enoxaparinem podávaným v dávce 40 mg denně. Optimální denní dávka dabigatranu byla stanovena v rozmezí 100–300 mg denně [9]. Ve studiích
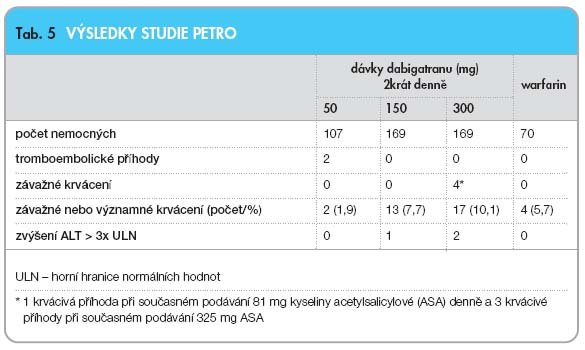
PETRO a PETRO-EX byl dabigatran
v dáv-
ce 150 mg dvakrát denně stejně účin
ný
j
ako
warfarin v terapii rizikových pacientů
s fibrilací síní, léčba byla dobře snášena
a bez projevů hepatotoxicity [10, 11] (
tab. 5
).
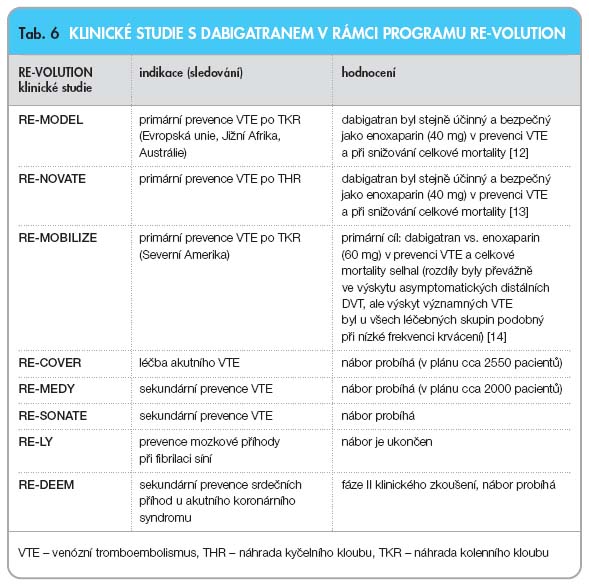
V rámci rozsáhlého (více než 34 000 pacientů) programu klinických studií RE-VOLUTION je sledována bezpečnost a účinnost dabigatranu v pěti hlavních léčebných oblastech (viz také
tab. 6)
:
1. �Primární prevence VTE (studie jsou ukončeny)
2. �Léčba akutního VTE (probíhá nábor)
3. �Sekundární prevence VTE (probíhá nábor)
4. �Prevence mozkové příhody u fibrilace síní (nábor je ukončen)
5.
�Sekundární prevence srdečních příhod u nemocných s akutním koronárním syndromem (probíhá nábor)
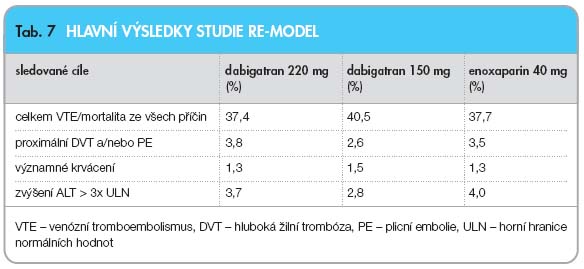
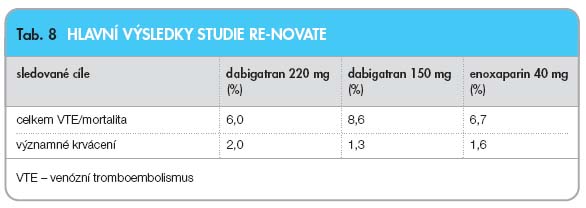
V roce 2007 byly publikovány výsledky dvou rozsáhlých dvojitě slepých randomizovaných studií (RE-NOVATE a RE-MODEL) [12, 13]. K potvrzení vhodné dávky bylo využito paralelního uspořádání skupin. Pacienti podstupující význam
nější elektivní ortopedické operace
(náhra
da kolenního nebo kyčelního kloubu) dostávali dabigatran v dávce 75 mg nebo 110 mg během 1–4 hodin po operaci, poté v dávce 150 mg nebo 220 mg denně při zabezpečené hemostáze nebo
enoxaparin 40 mg den před operací
a poté denně. Ve studii RE-MODEL (s náhradou kolenního kloubu) trvala léčba 6–10 dní, ve studii RE-NOVATE (s náhradou kyčelního kloubu) 28–35 dní. Celkový počet pacientů byl 2076 (koleno), respektive 3494 (kyčel).
Výsledky obou studií ukázaly, že antitrombotický účinek dabigatranu v dávce 220 mg a 150 mg nebyl statisticky slabší než účinek enoxaparinu, pokud jde o celkový počet VTE a mortalitu ze všech příčin. Bodový odhad výskytu významných VTE a mortality spojené s VTE byl u dabigatranu v dávce 150 mg mírně horší než při podávání enoxaparinu. Lepší výsledky byly pozorovány při podávání dávky 220 mg, u které byl bodový odhad výskytu významných VTE mírně lepší než u enoxaparinu (
tab. 7
,
8
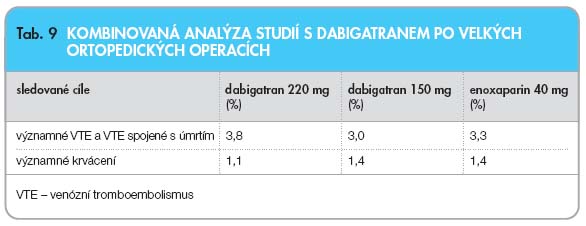
) [12, 13]. Při kombinované analýze všech 3 studií (RE-MODEL, RE-MOBILIZE, RE-NOVATE), které sledovaly účinnost a bezpečnost dabigatranu v primární prevenci VTE u více než
8000 pacientů po náhradě kyčelního nebo kolenního kloubu, nebyl prokázán zvýšený výskyt významných VTE, mortality spojené s VTE ani zvýšený výskyt význam
ného krvácení v porovnání
s enoxaparinem (
tab. 9
) [15].
Na základě výše uvedených klinických studií je dabigatran indikován v prevenci VTE po elektivní náhradě kolenního a kyčelního kloubu. Doporučená dávka je 220 mg jednou denně. Užívají se 2 tobolky s obsa
hem 110 mg léčiva. Perorální léčbu je tře
ba zahájit během 1
–
4 hodin po ukončení ope
race podáním jedné tobolky, poté je nut
no pokračovat 2 tobolkami jednou denně po celkovou dobu 10 dní po elektivní náhradě
kolenního a 28–35 dní po elektivní náhra
dě kyčelního kloubu, pokud nejsou krvácivé komplikace a je zabezpečena hemostáza.
Závěr
Dabigatran výrazně rozšiřuje terapeutické možnosti (vedle použití LMWH, warfarinu a nepřímého inhibitoru faktoru Xa fondaparinuxu) v rámci prevence VTE po elektivních náhradách kolenního a kyčelního kloubu, které jsou zatíženy vysokým rizikem výskytu VTE včetně fatální plicní embolie. Dabigatran představuje perorálně podávaný přímý reverzibilní kompetitivní inhibitor trombinu, jehož předností je pohodlné a pravidelné dávkování jednou denně bez nutnosti titrace, rychlý nástup a pokles účinku. K výhodám patří rovněž příznivý bezpeč
nostní profil bez známek hepatotoxicity, níz
ký potenciál lékových interakcí a fakt, že dabi
gatran neinteraguje významně s potravina
mi. Během léčby není nutná laboratorní kontrola krvácivosti a srážlivosti. Dabigatran je vylučován převážně ledvinami, a proto je léčba kontraindikována u nemocných s těžkou renální nedostatečností.
Práce je podporována výzkumným záměrem MZO 00179906.