Denosumab v léčbě hyperkalcemie
Souhrn:
Hyperkalcemie nádorových onemocnění je paraneoplastickým syndromem a častou komplikací pokročilého karcinomu prsu, plic a mnohočetného myelo-mu. Vznik této komplikace je často spojen se špatnou prognózou. Denosumab představuje možnost léčby pro pacienty s hyperkalcemií refrakterní k podání kyseliny zoledronové nebo pro nemocné, u nichž je léčba bisfosfonáty kontraindikována kvůli zavažnému poškození ledvin.
Key words: hypercalcemia – malignancy – denosumab – zoledronic acid.
Summary:
Hypercalcemia of malignancy is a paraneoplastic syndrome and a frequent complication of advanced breast, lung cancer, and multiple myeloma. The development of this malignancy complication is often associated with poor prognosis. Denosumab is an option for patients with hypercalcemia that is refractory to zoledronic acid or in whom bisphosphonates are contraindicated due to severe renal impairment.
Úvod
Hyperkalcemie je častým paraneoplastickým syndromem provázejícím nádorová onemocnění. K jejímu rozvoji dochází u 3–30 % všech pacientů s nádorovým onemocněním [1]. Výskyt hyperkalcemie u onkologicky nemocných je spojen s pokročilým onemocněním a s velmi špatnou prognózou. V případě, že hyperkalcemie není léčena, dosahuje medián přežití 2–6 měsíců od jejího zjištění [2]. Zvýšená sérová koncentrace vápníku ovlivňuje funkci celé řady orgánů. Postihuje nervový a kardiovaskulární systém, zhoršuje renální funkce. Prevalence nádorové hyperkalcemie závisí na typu nádoru. Nejčastěji je diagnostikována u pokročilého karcinomu prsu, plicních nádorů, nádorů hlavy a krku a u mnohočetného myelomu. V případě kostního metastatického postižení je častá u karcinomu prsu (30–65 %) a u mnohočetného myelomu (30–80 %). Vzácná je u diseminovaného karcinomu prostaty a osteosarkomů [3].
Hyperkalcemie u nádorových onemocnění
Tělo je za normálních okolností před hyperkalcemií dobře chráněno. Při vzestupu sérové koncentrace ionizovaného kalcia se prostřednictvím kalcium senzitivního receptoru potlačí sekrece parathormonu a tím i tvorba aktivního metabolitu vitaminu D kalcitriolu. Hyperkalcemie rovněž stimuluje C buňky štítné žlázy k výdeji kalcitoninu. Tyto hormonální změny pak korigují sérovou koncentraci kalcia snížením střevní absorpce, kostní resorpce a ledvinné reabsorpce kalcia.
V případě metastatického postižení skeletu je nejčastěji se vyskytujícím patogenetickým mechanismem hyperkalcemie zvýšená kostní resorpce osteoklasty. Tyto buňky jsou stimulovány parathormonem, parathormonu podobným proteinem (parathormone‑related protein, PTHrP) a aktivním metabolitem vitaminu D kalcitriolem. Mnohé cytokiny – interleukiny IL‑1, IL‑1ß, IL‑6, tumor nekrotizující faktor (tumor necrosis factor, TNF), lymfotoxin a transformující růstový faktor (transforming growth factor, TGF) – rovněž stimulují osteoklastickou resorpci samy nebo ve spolupráci s PTHrP [4].
Hyperkalcemie spojená s nádory může být klasifikována do čtyř skupin. Za prvé jde o lokální osteolytická ložiska s vystupňovanou osteolýzou vedoucí k hyperkalcemii. Faktory vedoucími k hyperkalcemii jsou interleukin 1 a 6, TNF, prostaglandin E2 a RANKL (receptor activator of nuclear factor κ B ligand). Tento mechanismus vzniku hyperkalcemie se uplatňuje u plazmocytomů, karcinomu prsu a lymfomů. Za druhé se může jednat o humorální hyperkalcemii, jež je nejčastější hyperkalcemií u nádorů a je způsobena produkcí PTHrP. Vyskytuje se zejména u skvamózních karcinomů, karcinomů prsu, ledvin, močového měchýře a u některých lymfomů. Za třetí, některé lymfomy mohou prostřednictvím své 1α‑hydroxylázy vést k tvorbě aktivní formy vitaminu D – kalcitriolu, který zvyšuje absorpci kalcia střevem. Konečně, za čtvrté, může jít o ektopickou produkci parathormonu. Osteoklasty maligního onemocnění jsou stimulovány stejnými faktory, které se účastní normální kostní resorpce. Některé tumory (myelom, karcinom prostaty nebo T‑lymfoblastická leukemie) jsou schopny produkovat přímo RANKL [4].
Klinické příznaky hyperkalcemie
Nejčastějšími klinickými příznaky hyperkalcemie jsou poruchy nervového systému a funkcí zažívacího traktu. Z neuromuskulárních příznaků se u nemocných vyskytuje únava, svalová slabost, letargie, křeče, zmatenost, delirium a zřídka kóma. K příznakům postižení trávicího traktu patří nevolnost, anorexie, zvracení, bolest břicha a zácpa. V renální oblasti dochází vlivem hyperkalcemie k polyurii a následně k žízni. Výrazné jsou příznaky srdeční. Mohou se objevit poruchy rytmu – tachyarytmie, bradyarytmie nebo poruchy vedení typu blokády převodu. Výrazná hyperkalcemie může vést k zástavě srdeční činnosti v systole. U nemocných s nádory se hyperkalcemie většinou vyvine rychle a netrvá dlouho pro maligní průběh onemocnění. Je nutné zdůraznit, že přítomnost nebo chybění klinických symptomů závisí na výši kalcemie a rychlosti jejího rozvoje. Většina nemocných nemá žádné klinické příznaky při kalcemii o hodnotě 2,7–3,0 mmol/l, je‑li hyperkalcemie déletrvající. Jsou ale pozorovány veliké individuální rozdíly.
Klinická závažnost hyperkalcemie závisí na koncentraci ionizovaného kalcia. Tato hodnota při normální koncentraci albuminu koreluje s celkovou koncentrací kalcia. U pacientů s metastatickým nádorovým onemocněním, kde je často pozorována nízká hladina albuminu, hrozí riziko klinicky závažné hyperkalcemie i při normální nebo pouze mírně zvýšené koncentraci celkového kalcia. V takových případech je potřeba provést korekce kalcemie podle sérové koncentrace albuminu, tzv. albumin‑corrected serum calcium (CSC) [4].
Léčba hyperkalcemie nádorových onemocnění denosumabem
Terapie hyperkalcemie nádorových onemocnění zahrnuje jak léčbu zaměřenou na snížení sérové koncentrace kalcia, tak léčbu samotné malignity. Historicky úvodní léčba zahrnovala výraznou hydrataci fyziologickým roztokem následovanou podáváním diuretik s cílem zvýšení exkrece kalcia močí za pravidelné monitorace objemu tekutin a elektrolytů [5]. Změna v pohledu na léčbu nastala s příchodem injekční formy bisfosfonátů, které specificky snižují aktivitu osteoklastů indukovanou nádorem [6].
Denosumab je monoklonální protilátka, která se s vysokou specifitou a účinností váže na RANKL a brání jeho působení. Ligand RANKL je produkován osteoblasty a blokáda jeho vazby na receptor RANK vede k inhibici tvorby, funkce a k omezení životnosti osteoklastů. Tím dochází ke snížení osteoresorpce a destrukce kosti způsobené nádorovým bujením.
Účinnost denosumabu byla hodnocena ve třech velkých randomizovaných studiích fáze III u 5 723 nemocných; jedna ze studií zahrnula nemocné s karcinomem prsu, další sledovala nemocné s karcinomem prostaty a třetí ze studií hodnotila účinky 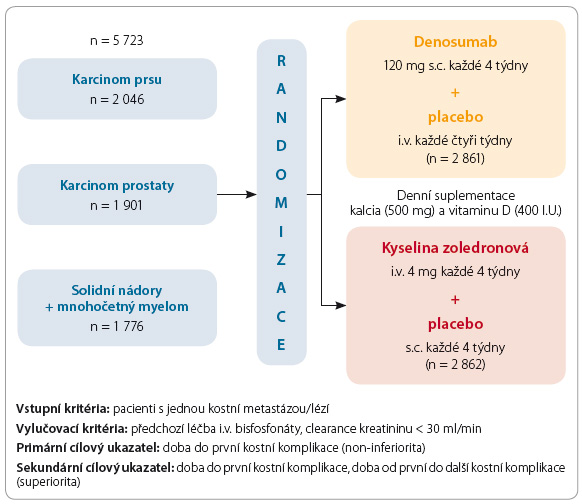 denosumabu u pacientů s mnohočetným myelomem a ostatními solidními nádory včetně karcinomu ledviny a močového měchýře [7]. Primárním cílovým ukazatelem pro hodnocení non‑inferiority ve studiích byla doba do vzniku první kostní komplikace (skeletal‑related event, SRE), která byla definována jako patologická fraktura, radioterapie nebo chirurgie kosti nebo míšní komprese. Pacienti ve studii byli rozděleni do dvou ramen: v prvním rameni byli pacienti léčeni denosumabem v dávce 120 mg subkutánně (s.c.) a placebem intravenózně (i.v.) podávanými každé 4 týdny, ve druhém rameni byla pacientům podávána kyselina zoledronová v dávce 4 mg i.v. a placebo s.c. také každé 4 týdny. Pacientům byl denně suplementován vitamin D a kalcium, obr. 1.
denosumabu u pacientů s mnohočetným myelomem a ostatními solidními nádory včetně karcinomu ledviny a močového měchýře [7]. Primárním cílovým ukazatelem pro hodnocení non‑inferiority ve studiích byla doba do vzniku první kostní komplikace (skeletal‑related event, SRE), která byla definována jako patologická fraktura, radioterapie nebo chirurgie kosti nebo míšní komprese. Pacienti ve studii byli rozděleni do dvou ramen: v prvním rameni byli pacienti léčeni denosumabem v dávce 120 mg subkutánně (s.c.) a placebem intravenózně (i.v.) podávanými každé 4 týdny, ve druhém rameni byla pacientům podávána kyselina zoledronová v dávce 4 mg i.v. a placebo s.c. také každé 4 týdny. Pacientům byl denně suplementován vitamin D a kalcium, obr. 1.
Denosumab prokázal v integrované analýze studií superioritu v prodloužení doby do vzniku první SRE o 18 % ve srovnání s kyselinou zoledronovou (hazard ratio, poměr rizik – HR: 0,82; p < 0,0001 pro superioritu). Medián doby do vzniku první SRE byl o 8,3 měsíce delší pro denosumab ve srovnání s kyselinou zoledronovou [7].
Z nežádoucích účinků se u vyššího počtu nemocných léčených denosumabem vyskytla hypokalcemie (9,5 % ve větvi s denosumabem vs. 4,8 % ve větvi s kyselinou zoledronovou) [7]. Právě vyšší schopnost dosažení hypokalcemie po léčbě denosumabem byla využita k ověření teorie o možnosti ovlivnění refrakterní hyperkalcemie způsobené nádorovým onemocněním.
V preklinických studiích hodnocení osteoprotegerinu na myších modelech hyperkalcemie zprostředkované PTHrP byla inhibice RANKL jednou injekcí osteoprotegerinu příčinou rychlého poklesu sérové koncentrace kalcia [8].
Studie fáze II, kde byla denosumabem léčena hyperkalcemie refrakterní k bisfosfonátům u 33 pacientů se solidními nádory, prokázala 70% odpověď na léčbu klasifikovanou hodnotou korigovaného vápníku v séru (CSC) ≤ 2,9 mmol/l a 64% kompletní remisi v dosažení CSC ≤ 2,7 mmol/l [9].
Ad hoc analýza dvou studií fáze III srovnávala vliv denosumabu a kyseliny zoledronové na prevenci nebo oddálení vzniku hyperkalcemie, která byla definována jako CSC > 2,9 mmol/l [3]. Vyhodnoceny byly randomizované, dvojitě zaslepené studie, které zahrnuly v rameni s denosumabem 1 912 pacientů a v rameni s kyselinou zoledronovou 1 910 nemocných s nádory prsu (54 %), mnohočetným myelomem (5 %) a s jinými solidními nádory (nemalobuněčný plicní karcinom 18 %) kromě karcinomu prostaty. Cílem bylo stanovení doby do první hyperkalcemie během studie a doby mezi první a následnou hyperkalcemií během studie. Dále stanovení podílu nemocných, u kterých došlo k hyperkalcemii, a podílu nemocných s opakovanou zkušeností s hyperkalcemií.
Denosumab signifikantně oddálil dobu do první hyperkalcemie ve srovnání s kyselino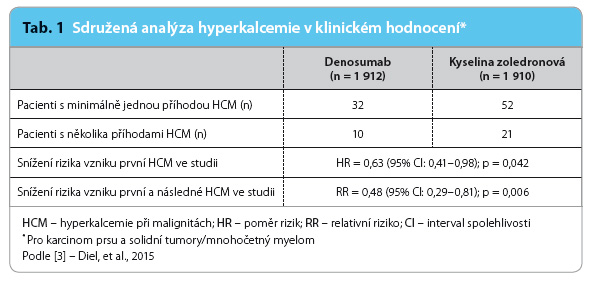 u zoledronovou (HR: 0,63; confidence interval, interval spolehlivosti – 95% CI: 0,41–0,98; p = 0,042). Většina nemocných jak v rameni s denosumabem, tak v rameni s kyselinou zoledronovou měla jednu zkušenost s hyperkalcemií během sledování. Riziko vzniku opakované hyperkalcemie bylo denosumabem redukováno o 52 % (risk ratio, relativní riziko – RR: 0,48; 95% CI: 0,29–0,81; p = 0,006), tab. 1. Nemocní léčení denosumabem měli zkušenost s nižším stupněm hyperkalcemie dle CTCAE (Common Terminology Criteria for Adverse Events) verze 3.0, než jaký prodělali nemocní léčení kyselinou zoledronovou, tab. 2. Pacienti léčení denosumabem měli statisticky signifikantně nižší riziko rozvoje hyperkalcemie související s nádorovým onemocněním (1,7 %) ve srovnání s pacienty léčenými kyselinou zoledronovou (2,7 %). Hyperkalcemie byla častější u nemocných s pokročilým k
u zoledronovou (HR: 0,63; confidence interval, interval spolehlivosti – 95% CI: 0,41–0,98; p = 0,042). Většina nemocných jak v rameni s denosumabem, tak v rameni s kyselinou zoledronovou měla jednu zkušenost s hyperkalcemií během sledování. Riziko vzniku opakované hyperkalcemie bylo denosumabem redukováno o 52 % (risk ratio, relativní riziko – RR: 0,48; 95% CI: 0,29–0,81; p = 0,006), tab. 1. Nemocní léčení denosumabem měli zkušenost s nižším stupněm hyperkalcemie dle CTCAE (Common Terminology Criteria for Adverse Events) verze 3.0, než jaký prodělali nemocní léčení kyselinou zoledronovou, tab. 2. Pacienti léčení denosumabem měli statisticky signifikantně nižší riziko rozvoje hyperkalcemie související s nádorovým onemocněním (1,7 %) ve srovnání s pacienty léčenými kyselinou zoledronovou (2,7 %). Hyperkalcemie byla častější u nemocných s pokročilým k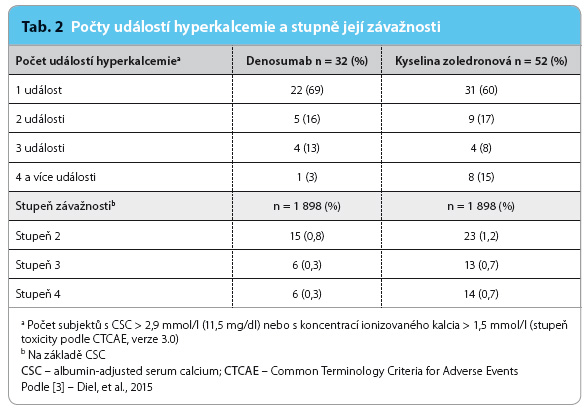 arcinomem prsu (1,3 %), v četnosti výskytu hyperkalcemie následovali nemocní s nemalobuněčným plicním karcinomem (0,5 %) a s mnohočetným myelomem (0,2 %). Nežádoucí účinky a závažné nežádoucí účinky byly v obou léčebných ramenech stejné. Zajímavý rozdíl byl zjištěn pouze v počtu osteonekróz. U pacientů s jednou nebo s více než jednou zkušeností s hyperkalcemií byla po léčbě denosumabem prokázána osteonekróza v 6,3 % ve srovnání s 0 % u pacientů léčených kyselinou zoledronovou.
arcinomem prsu (1,3 %), v četnosti výskytu hyperkalcemie následovali nemocní s nemalobuněčným plicním karcinomem (0,5 %) a s mnohočetným myelomem (0,2 %). Nežádoucí účinky a závažné nežádoucí účinky byly v obou léčebných ramenech stejné. Zajímavý rozdíl byl zjištěn pouze v počtu osteonekróz. U pacientů s jednou nebo s více než jednou zkušeností s hyperkalcemií byla po léčbě denosumabem prokázána osteonekróza v 6,3 % ve srovnání s 0 % u pacientů léčených kyselinou zoledronovou.
Závěr
Denosumab, plně humánní monoklonální protilátka, podobně jako osteoprotegerin interferuje s cestou RANK/RANKL a s vyšší účinností než bisfosfonáty působí přímo na aktivitu osteoklastů. Většina nemocných léčených pro hyperkalcemii související s pokročilým nádorovým onemocněním dobře reaguje na léčbu bisfosfonáty. Přibližně u 25 % pacientů je ale účinek neadekvátní nebo pacienti na podání bisfosfonátu neodpovědí vůbec. Ze studií vyplývá, že rezistentní hyperkalcemie je výsledkem inkompletní inhibice kostní resorpce a/nebo zvýšené renální reabsorpce kalcia v důsledku zvýšené produkce PTHrP řízené nádorem [10]. Léčba hyperkalcemie denosumabem při pokročilém nádorovém onemocnění je ve srovnání s léčbou injekčně podávanými bisfosfonáty mnohem účinnější. Výhoda léčby denosumabem spočívá také v tom, že jeho farmakokinetické a farmakodynamické vlastnosti nezhoršují funkci ledvin, jeho podání není provázeno reakcí akutní fáze a subkutánní aplikace významně zlepšuje kvalitu života onkologicky nemocných. Podání denosumabu v léčbě hyperkalcemie je doporučeno v jiném dávkovacím režimu, než je obvyklé při prevenci kostních komplikací u metastatického postižení skeletu. Aplikováno je 120 mg denosumabu s.c. každé 4 týdny s přídatnou dávkou 120 mg ve dnech 8 a 15 během prvního měsíce léčby.
Seznam použité literatury
- [2] Rosner MH, Dalkin AC. Onco nephrology: the pathophysiology and treatment of malignancy associated hypercalcemia. Clin J Am Soc Nephrol 2012; 7: 1722–1729.
- [3] Diel IJ, Body JJ,Stopeck AT, et al. The role of denosumab in the prevention of hypercalcemia of malignancy in cancer patients with metastatic bone disease. Eur J Cancer 2015; 51: 1467–1475.
- [4] Broulík P. Hyperkalcemie: na co je potřeba myslet a jaká vyšetření provést? Interni Med 2011; 13: 314–331.
- [5] LeGrand SB, Leskuski D, Zama I. Narrative review: furosemide for hypercalcemia: an unproven yet common practice. Ann Intern Med 2008; 149: 259–263.
- [6] Body JJ, Bartl R, Burckhardt P, et al. Current use of bisphosphonates in oncology. International Bone and Cancer Study Group. J Clin Oncol 1998; 161: 3890–3899.
- [7] Lipton A, Fizazi K, Stopeck AT, et al. Superiority of denosumab to zoledronic acid for prevention of skeletal releated events: a combined analysis of 3 pivotal, randomi-sed, phase 3 trials. Eur J Cancer 2012; 48: 3082–3092.
- [8] Morony S, Warmington K, Adamu S, et al. The inhibition of RANKL causes greater suppression of bone resorption and hypercalcemia compared with bisphosphonates in two models of humoral hypercalcemia of malignancy. Endocrinology 2005; 146: 3235–3243.
- [9] Hu MI, Glezerman IG, Leboulleux S, et al. Denosumab for treatment of hypercalcemia of malignancy. J Clin Endocrinol Metab 2014; 99: 3144–3152.
- [10] Walls J, Ratcliffe WA, Howell A, Bundred NJ. Parathyroid hormone and parathyroid hormone related protein in investigation of hypercalcaemia in two hospital populati-ons. Clin Endocrinol (Oxf) 1994; 414: 407–413.