Dlouhodobá účinnost a bezpečnost sekukinumabu v terapii ankylozující spondylitidy
Pětiletá extenze studie fáze III MEASURE 1 byla zaměřena na účinnost a bezpečnost sekukinumabu podávaného v dávce 150 mg pacientům trpícím ankylozující spondylitidou (AS). Toto chronické zánětlivé onemocnění je charakterizováno progresivním ireverzibilním strukturálním poškozením sakroiliakálních a spinálních kloubů, tvorbou syndesmofytů a ztuhlostí páteře, disabilitou a snížením fyzických funkcí a kvality života. Prevalence AS je udávána v rozmezí 0,1‒1,4 % z celkové populace. Onemocnění je spojeno s významnou morbiditou a invaliditou, a znamená tak velkou socioekonomickou zátěž.
Nesteroidní antirevmatika představují
prvoliniovou léčbu AS. Terapie onemocnění je však komplikována
nedostatečnou účinností běžně užívaných chorobu
modifikujících léků (disease modifying antirheumatic
drugs, DMARDs), jako jsou sulfasalazin nebo metotrexát.
Do armamentaria léčiv pro AS přibyly inhibitory tumor
nekrotizujícího faktoru alfa (TNFα), jež následně prokázaly
prodlouženou účinnost. Přerušení terapie však bylo spojeno
s rychlým relapsem choroby a při dlouhodobé léčbě
docházelo ke ztrátě efektu inhibitorů TNFα.
Klíčovými faktory při léčbě pacientů trpících AS je zmírnění aktivity nemoci a projevů zánětu a prevence progresivního strukturálního poškození, abychom u nemocných dosáhli dlouhodobého udržení kvality života a fyzických funkcí. Sekukinumab, plně humánní monoklonální protilátka přímo inhibující interleukin 17A (IL 17A), prokázal významnou a trvalou účinnost v léčbě AS napříč fázemi III studií MEASURE, s nízkou mírou radiografické progrese během čtyř let ve studii MEASURE 1. Sekukinumab tak byl na základě výsledků studií schválen jako biologický DMARD pro léčbu AS.
Po dvou letech průběhu hlavní
studie bylo 274 pacientů, kteří užívali každé čtyři týdny
subkutánně sekukinumab v dávce 150 mg nebo 75 mg
(po úvodní intravenózní dávce nebo léčbě placebem
do týdne 16/24), zařazeno do tříleté extenze studie
(NCT01863732). Eskalace dávky ze 75 na 150 mg byla
povolena ve 156. týdnu nebo po něm na základě
rozhodnutí ošetřujícího lékaře. Hodnocení ve 260. týdnu
(po pěti letech) zahrnovalo kritérium ASAS20/40 (20%/40%
zlepšení podle Assessment of SpondyloArthritis International
Society) a další data týkající se účinnosti. Bezpečnost
byla hodnocena u všech pacientů, kteří obdrželi jednu nebo
více dávek studijní medikace.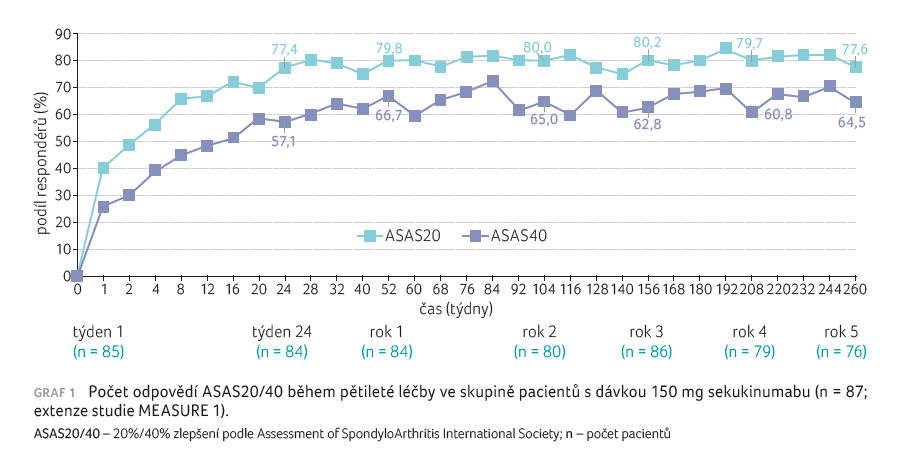
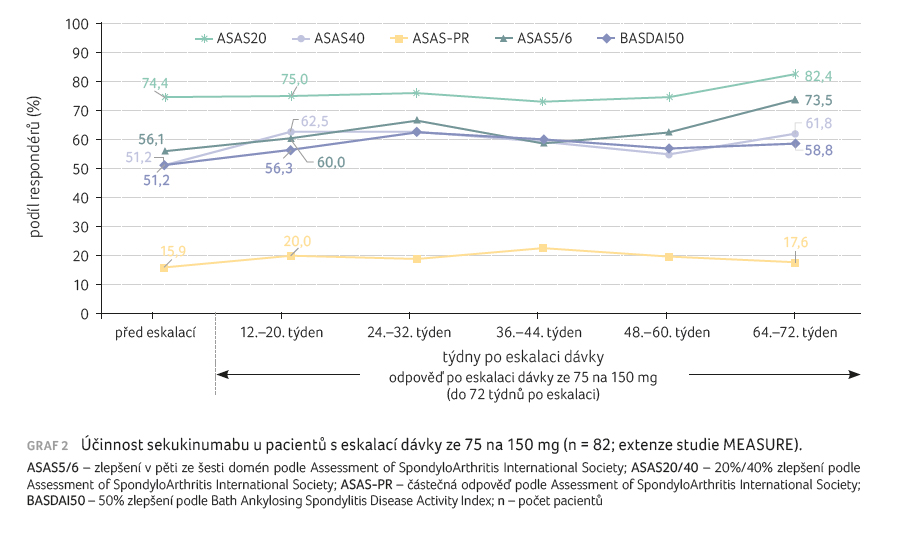
Odpověď ASAS20/40 (77,6 %/64,5 %) byla během pětileté terapie setrvalá u pacientů, kteří byli původně randomizováni do větve s léčbou 150 mg sekukinumabu (graf 1). V celkové skupině nemocných, kteří dostávali sekukinumab v dávce 150 mg (tedy včetně těch, kteří byli převedeni z placeba), činila odpověď ASAS20/40 po pěti letech 78,6 %/65,2 %. Zlepšení v odpovědích ASAS20/40, ASAS PR (částečná remise), ASAS5/6, BASDAI50 (Bath Ankylosing Spondylitis Disease Activity Index) bylo zaznamenáno u pacientů s eskalací dávky sekukinumabu ze 75 na 150 mg (graf 2). Mezi nejběžnějšími nežádoucími reakcemi byly hlášeny nazofaryngitida, bolest hlavy, průjem a infekce horních cest dýchacích.
Klinické zlepšení bylo během pěti let setrvalé napříč všemi cílovými ukazateli. Více než polovina pacientů (82/146, 56,2 %) původně randomizovaných k užívání sekukinumabu v dávce 75 mg vyžadovala během studie eskalaci dávky na 150 mg na základě rozhodnutí ošetřujícího lékaře (dávka 75 mg byla
suboptimální pro mnoho nemocných). Výsledky studie představují nejdelší publikovaná data pro inhibitor IL 17A užívaný v léčbě AS a jsou důležité jako doklad více než pětileté účinnosti dané látky. Přes 80 % pacientů, kteří vstoupili do extenze studie, dokončilo pětiletou léčbu a byl tak prokázán trvalý klinický prospěch z dlouhodobé léčby sekukinumabem. Klinické zlepšení bylo doloženo v obou hodnocených podskupinách – u pacientů TNF naivních i u pacientů, kteří předchozí anti TNF léčbu netolerovali nebo u nich nebyla zaznamenána dostatečná odpověď na terapii. Tato data jsou v souladu s výsledky předešlých studií a podporují tak výhodnost dlouhodobé léčby sekukinumabem u nemocných, kteří byli sledováni v uvedených podskupinách. V této kohortě pacientů s aktivní AS léčených sekukinumabem činil výskyt specifických nežádoucích účinků podle ukazatele EAIR (exposure adjusted incidence rate) – uveitidy a zánětlivých střevních onemocnění – 1,8, resp. 0,5 na 100 pacientoroků a během pětiletého období sledování nedošlo k jeho nárůstu. Sekukinumab byl po celou dobu dobře tolerován a jeho bezpečnostní profil byl shodný s předchozími hlášeními a s nedávnou poolovanou analýzou dlouhodobých dat u pacientů s psoriázou, psoriatickou artritidou a s AS.
Sekukinumab prokázal trvalou účinnost ve všech doménách AS, včetně příznaků a symptomů, fyzických funkcí a objektivních známek zánětu během pětiletého sledování. Efekt sekukinumabu byl zesílen při eskalaci dávky ze 75 mg na 150 mg, tedy na schválenou dávku.
Redakčně zpracovala PhDr. Nikola Homolová Richtrová