Dronedaron
Dronedaron je nové antiarytmikum III. skupiny se strukturou podobnou amiodaronu. Má příznivý efekt v prevenci paroxysmů fibrilace a flutteru síní. Při probíhající fibrilaci síní pak snižuje frekvenci komor. Riziko nežádoucích účinků je nízké. V klinických studiích nebyl pozorován proarytmický efekt, neovlivňuje funkci štítné žlázy. Dlouhodobý účinek a bezpečnost dronedaronu musí být ověřeny ještě dalšími studiemi. Platí to zejména pro pacienty se srdečním selháním.
Úvod
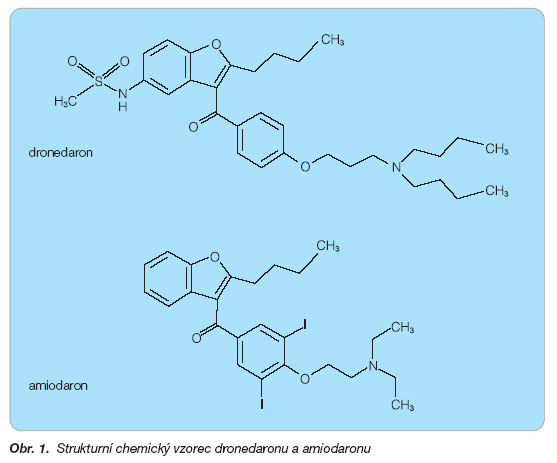
Dronedaron je nové antiarytmikum III. skupiny (tab. 1). Patří do skupiny derivátů amiodaronu. Podobnost chemické struktury s amiodaronem vyvolává očekávání podobného klinického působení a přitom – díky chybějícímu jodu v molekule – nižšího výskytu nežádoucích účinků.
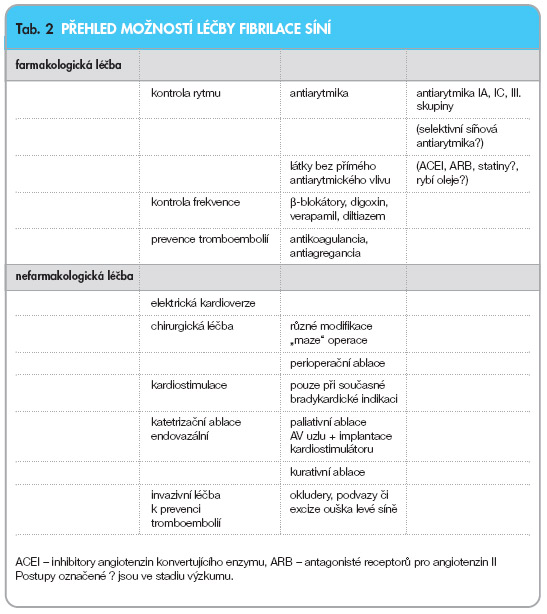
Současná úloha antiarytmik spočívá zejména v léčbě supraventrikulárních arytmií. Nejčastější supraventrikulární arytmií je fibrilace síní postihující téměř 1 % dospělé populace. V léčbě fibrilace síní se používají antiarytmika ke kontrole srdečního rytmu, tedy k prevenci recidiv u paroxysmální fibrilace síní a k prevenci recidiv po provedené kardioverzi (tab. 2). Mimo kontrolu rytmu se používá tzv. kontrola frekvence, tedy léky zpomalující frekvenci komor při fibrilaci síní. Oba postupy se mohou kombinovat. Jsou srovnatelné z hlediska kvality života, morbidity i mortality [1, 2].
Mortalita pacientů se sinusovým rytmem je nižší než mortalita pacientů s fibrilací síní. To však neplatí, pokud je sinusový rytmus udržen antiarytmiky, která jsou v současné době dostupná. Přínos sinusového rytmu je tedy snížen nežádoucími účinky antiarytmik. Pokud budeme mít k dispozici metody k udržení sinusového rytmu bez výraznějších nežádoucích účinků, může být kontrola rytmu výhodnější než kontrola srdeční frekvence. To platí jak pro nefarmakologickou, tak pro farmakologickou léčbu fibrilace síní včetně léčby novými antiarytmiky [3].
Ze studií s inhibitory ACE i ARB (antagonisté receptorů pro angiotenzin II) vyplývá, že podávání těchto preparátů při indikaci srdečního selhání, primární či sekundární prevenci ICHS snižuje také výskyt fibrilace síní. To znamená, že antiarytmický účinek mohou mít i léky jiných lékových skupin.
Z možností nefarmakologické léčby fibrilace síní se nejrychleji rozvíjí katetrizační ablace. Její uplatnění je však vzhledem k vysoké prevalenci fibrilace síní zatím malé. V roce 2005 bylo v ČR provedeno 420 katetrizačních ablací pro fibrilaci síní, což představuje asi necelé 1 % všech pacientů s touto arytmií. Dominantní tedy zůstává a v nejbližších letech jistě zůstane farmakoterapie.
Ostatní supraventrikulární arytmie mají podstatně nižší prevalenci a také ablace u těchto arytmií je podstatně jednodušší, má vysokou úspěšnost (nad 95 %) a nízké riziko komplikací. Proto zde ablace často představuje léčbu první volby. Antiarytmika se používají méně často. Jejich role je u ojedinělých atak arytmií a při preferenci pacientem.
U komorových arytmií je současné postavení antiarytmik více omezené než u arytmií supraventrikulárních. K většině případů komorových arytmií dochází u pacientů se strukturálním onemocněním srdce, zejména s dysfunkcí levé komory srdeční. Antiarytmika I. skupiny u těchto pacientů nemohou být používána, protože zvyšují mortalitu. Amiodaron mortalitu nemění, jeho efekt je u pacientů s komorovými arytmiemi shodný s placebem [4].
V sekundární prevenci komorových arytmií je indikována implantace kardioverteru-defibrilátoru (ICD). Tato léčba se stále častěji používá také v primární prevenci. Kromě klasických ICD se u pacientů se srdečním selháním často používají i přístroje s možností resynchronizace kontrakce levé komory srdeční (tzv. biventrikulární stimulace).
Amiodaron se u pacientů s ICD používá k snížení frekvence komorových arytmií, a tedy ke snížení počtu výbojů ICD. Snížení frekvence komor při arytmii amiodaronem může vést k lepší účinnosti antitachykardické stimulace, a tedy opět k omezení četnosti či snížení energie výbojů. V neposlední řadě má amiodaron vliv i na snížení výskytu supraventrikulárních arytmií. Sníží tak počet neoprávněných výbojů ICD při falešné detekci komorové arytmie pro probíhající arytmii supraventrikulární. Kromě amiodaronu byl pozitivní vliv u pacientů s ICD pozorován také u sotalolu, dofetilidu či azimilidu. Paušální podávání antiarytmik u pacientů s ICD však není v žádném případě indikováno. Zbytečné užívání anti-arytmik vystavuje pacienty riziku jejich nežádoucích účinků [4, 5].
Farmakodynamické vlastnosti
Dronedaron (N,N-dibutyl-3-[4-([2-butyl-5-methylsulfonamido] benzofuran-3-yl-karbonyl) fenoxy] propylamin) je nový syntetický dejodovaný derivát amiodaronu (obr. 1). Stejně jako amiodaron vykazuje efekt všech čtyř tříd podle Vaughanovy-Williamsovy klasifikace. To znamená, že blokuje sodíkový kanál, má antiadrenergní vlastnosti, prodlužuje délku akčního potenciálu a má negativně chronotropní efekt na buňky v sinoatriálním a atrioventrikulárním uzlu [6, 7].
Dronedaron ovlivňuje řadu buněčných kanálů, opět podobně jako amiodaron. Blokuje kanály I(Kr), I(Ks), I(to), I-K(Ach) a rychlý sodíkový kanál, působí také jako antagonista kalcia.
Účinek dronedaronu v experimentu
Dronedaron snižuje výskyt fibrilace komor a jiných arytmií vyvolaných ischémií. V experimentu na prasatech na modelu podvazu koronární tepny snížil výskyt fibrilace komor z 90 % na 30 % (p < 0,05). Podobné výsledky byly popsány také při potlačení reperfuzních arytmií a v experimentech na jiných zvířatech. Při i.v. podání ovlivňuje dronedaron elektrofyziologické vlastnosti síňového i komorového myokardu podobně jako amiodaron. Podobný byl i antiadrenergní efekt. Inhibice je nekompetitivní, jsou inhibovány a- i b-adrenergní receptory. b1-receptory ovlivňoval dronedaron méně než amiodaron, u b2-receptorů je tomu naopak. O adrenergním efektu svědčí i experimenty, ve kterých dronedaron podobně jako amiodaron snižuje tachykardii vyvolanou zátěží a isoprenalinem [8].
V experimentu na psech dronedaron neovlivňuje klidovou funkci levé komory po infarktu myokardu.
Ovlivnění intervalu QT a proarytmický efekt
Prodloužení intervalu QT je spojeno s rizikem proarytmie, zejména se vznikem komorových tachykardií torsade de pointes (TdP). I když amiodaron jako antiarytmikum III. skupiny prodlužuje interval QT, je riziko proarytmie spojené s jeho podáváním nízké (přibližně 2 % pacientů). Blokádou I(Kr) kanálu také dronedaron způsobuje prodloužení akčního potenciálu v myokardu komor. V experimentu na psech prodlužoval dronedaron interval QTc o 31 %, amiodaron o 21 %. Navíc dronedaron zvyšoval různě délku intervalu QT v různých místech myokardu, a tím zvyšoval heterogenitu rozložení intervalu QT. U amiodaronu nebylo zvýšení heterogenity intervalu QT pozorováno. Zvýšení heterogenity je považováno za potenciálně proarytmické. V souladu s tím byly u 3 z 8 pokusných psů pozorovány spontánní epizody tachykardií TdP, u 4 z 8 zvířat byla tato arytmie vyvolatelná. Při léčbě amiodaronem nebyly pozorovány žádné spontánní epizody TdP a indukovány byly tyto epizody jen u jednoho zvířete [9].
Vliv dronedaronu na štítnou žlázu
Ovlivnění funkce štítné žlázy je jedním z nejčastějších a nejzávažnějších nežádoucích účinků amiodaronu. V metaanalýze 13 studií zahrnujících 6500 pacientů léčených amiodaronem (ATMA) byla u 7 % pacientů popisována hypotyreóza a u 1,4 % hypertyreóza. V recentní studii u 2521 pacientů, která porovnávala efekt placeba, amiodaronu a ICD u pacientů se srdečním selháváním, byla ve skupině léčené amiodaronem významně častější hypotyreóza (6 %; p < 0,001). Nežádoucí účinky jsou spojeny s vysokým obsahem jodu, ale je možný i přímý vliv amiodaronu na hormony štítné žlázy.
Vliv amiodaronu a dronedaronu na štítnou žlázu byl sledován v experimentu na potkanech. Podle očekávání vedlo dvoutýdenní podávání amiodaronu ke zvýšení hladiny tyreoidálních hormonů, dronedaron funkci štítné žlázy neovlivnil [10]. Byl popsán antagonistický vliv dronedaronu (resp. jeho metabolitu debutyldronedaronu) na vazbu na tyreoidální hormonální receptor a1. Dronedaron by tak také mohl působit hypotyreózu.
Farmakokinetické vlastnosti
Poločas vylučování dronedaronu je 24 hodin. Vylučuje se stolicí, bez prokazatelných metabolických produktů v moči. Při dávkování 2krát denně dosáhneme vyrovnané hladiny (steady state) za 5–7 dní. Vzhledem k značnému first-pass efektu v játrech je biologická dostupnost dronedaronu přibližně 15 %. Pokud se lék podává společně s jídlem, dosahuje 2–3násobné plazmatické koncentrace.
Metabolismus v játrech probíhá přes cytochromoxidázový (CYP) systém. U některých podskupin pacientů bylo při podávání dronedaronu pozorováno zvýšení biologické dostupnosti metoprololu. Podobná interakce byla popsána se simvastatinem. Data o ostatních interakcích prostřednictvím CYP enzymatického systému jsou zatím omezená [11].
Klinická data
Do konce roku 2005 bylo provedeno několik desítek studií s dronedaronem, a to jak u zdravých dobrovolníků, tak u pacientů. Byly provedeny 4 placebem kontrolované studie u fibrilace a flutteru síní a jedna studie u pacientů se srdečním selháním (tab. 3) [7, 12].
Fibrilace a flutter síní
Ve studii DAFNE (Dronedarone Atrial FibrillatioN study after Electrical cardioversion) byly porovnány tři dávky dronedaronu (400, 600 a 800 mg dvakrát denně) s placebem [13]. Do studie bylo zařazeno 270 pacientů po kardioverzi (medikamentózní či elektrické) pro fibrilaci síní. Dronedaron byl účinný již v dávce 400 mg, kdy se doba do první recidivy FS prodloužila z 5 na 60 dní. Při vyšších dávkách nebyl antiarytmický efekt lepší. Naopak bylo nutné častěji ukončit léčbu pro nežádoucí účinky, převážně gastrointestinální (až 23 % nemocných). Nebyly zjištěny nežádoucí účinky na plíce, oči či štítnou žlázu. V dávce 1600 mg prodlužoval dronedaron interval QT. Autoři studie uzavírají, že dronedaron podávaný v dávce 800 mg/den je účinný a bezpečný lék v prevenci recidiv fibrilace síní po kardioverzi.
V randomizovaných studiích EURIDIS a ADONIS byl sledován efekt a bezpečnost dronedaronu u pacientů s paroxysmální fibrilací a flutterem síní. Do studie EURIDIS (EURopean trial In atrial fibrillation or flutter patients receiving Dronedarone for the maIntenance of Sinus rhythm) bylo v celkem 77 centrech 14 zemí zahrnuto 615 pacientů. Ve studii ADONIS (American-Australian trial with DrONedarone In atrial fibrillation or flutter patients for the maintenance of Sinus rhythm) bylo zahrnuto 629 pacientů ze 115 center. Pacienti v obou studiích byli randomizováni v poměru 2 : 1 k léčbě dronedaronem v dávce 400 mg dvakrát denně a k podávání placeba. Doba sledování byla 12 měsíců. Primárním kritériem vlivu (endpoint) byla doba do první recidivy fibrilace síní definované jako epizoda delší než 10 minut, zaznamenaná v EKG nebo pomocí transtelefonické monitorace. Ve studii EURIDIS byl pozorován významný pokles recidiv arytmií o 22 % (p = 0,138), ve studii ADONIS rovněž významné snížení o 27 % (p = 0,0017). Výsledky obou studií byly kompatibilní. Analýza studie ADONIS ukázala obdobné výsledky v podskupinách pacientů se strukturálním onemocněním srdce, s předchozí léčbou amiodaronem či předchozí kardioverzí.
Sekundárním kritériem (endpointem) uvedených studií byla srdeční frekvence při recidivě fibrilace síní. Průměrná frekvence komor při recidivě arytmie byla 102 tepů/min u dronedaronu a 118 tepů/min u placeba ve studii EURIDIS a 105 tepů/ min v. 117 tepů/min ve studii ADONIS. Data obou studií tedy prokazují příznivý vliv dronedaronu na kontrolu srdeční frekvence.
Výskyt nežádoucích účinků u dronedaronu a placeba se nelišil. Nebyl pozorován žádný proarytmický vliv dronedaronu, žádná epizoda komorové tachykardie torsade de pointes. Nebyly zjištěny známky plicní toxicity ani ovlivnění funkce štítné žlázy. Počet pacientů, kteří ukončili studii pro nežádoucí účinky, byl u dronedaronu a u placeba podobný (7,1 % v. 9,7 %). Mortalita u obou studií byla 1 % při léčbě dronedaronem a 0,7 % při podávání placeba [7].
Bradykardický efekt dronedaronu byl ověřován ve studii ERATO (Efficacy and safety of dRonedArone for The cOntrol of ventricular rate). Do této studie bylo zařazeno 174 pacientů z 35 center z celkem 9 evropských zemí. Podmínkou zařazení byla symptomatická fibrilace síní s trváním alespoň 6 měsíců. Standardními léky použitými ke kontrole srdeční frekvence byly b-blokátory, digoxin a blokátory vápníkových kanálů. Podávání dronedaronu snížilo průměrnou srdeční frekvenci za 24 hodin v klidu o 11,7 tepů/min a při maximální zátěži o 24,5 tepů/min (p < 0,0001). Frekvence závažných nežádoucích účinků při léčbě dronedaronem se nelišila od placeba (16,5 % v. 13,5 %). Nebyl pozorován žádný proarytmický efekt.
Srdeční selhání
Do studie ANDROMEDA (ANtiarrhythmic trial with DROnedarone in Moderate to severe congestive heart failure Evaluation morbidity DecreAse) byli zařazeni pacienti s anamnézou srdeční insuficience a ejekční frakce levé komory < 35 %. Cílem bylo sledování vlivu dronedaronu v prevenci úmrtí či hospitalizace pro srdeční selhání. Po zahrnutí 627 z celkově 1000 plánovaných pacientů byla studie ukončena předčasně (leden 2003) pro vyšší mortalitu ve skupině léčené dronedaronem (24 v. 10 úmrtí ve skupině, která dostávalo placebo). K vzestupu mortality došlo především v důsledku progrese srdečního selhání, nikoliv v důsledku náhlé smrti. K progresi srdečního selhání docházelo častěji po vysazení ACEI při zvýšení hladiny kreatininu po užívání dronedaronu.
Výsledky studie jistě vyžadují další analýzy (nebyly dosud publikovány v akademickém tisku) [7].
Probíhající studie
Ve studii ATHENA (A Trial with dronedarone to prevent Hospitalization or death in patiENts with Atrial fibrillation) je cílem porovnat účinnost léčby dronedaronem (400 mg 2krát denně) s podáváním placeba. Primárním endopointem je hospitalizace z kardiovaskulární příčiny či úmrtí. Sekudárními endpointy jsou celková mortalita, kardiovaskulární mortalita, hospitalizace pro kardiovaskulární a nekardiovaskulární příčiny. Podle plánu bude do studie zahrnuto 3700 pacientů. Doba sledování bude 12 měsíců. Do studie mohou být zahrnuti jak pacienti s paroxysmální fibrilací síní, tak pacienti s perzistující fibrilací po provedené kardioverzi, medikamentózní či elektrické. Srdeční selhání není vylučovacím kritériem. Naopak, do studie jsou zařazeni pacienti s alespoň jedním z následujících rizikových faktorů: věk nad 70 let, hypertenze, diabetes mellitus, anamnéza mozkové příhody, TIA nebo systémové embolizace, dilatace levé síně nebo ejekční frakce levé komory pod 40 %. Studie byla zahájena v červnu 2005, výsledky jsou očekávány na podzim 2007 [7].
Závěr
Co tedy zatím víme o dronedaronu? Je to účinné antiarytmikum v prevenci recidiv fibrilace a flutteru síní. Pokud k recidivě arytmie dojde, je s pomalejší srdeční frekvencí. Také u perzistující či chronické fibrilace síní přispívá dronedaron ke kontrole srdeční frekvence. Podává se 2krát denně v dávce 400 mg. Jeho nežádoucí účinky jsou mírné, nejčastěji gastrointestinální (průjem). Dronedaron zvyšuje plazmatickou hladinu kreatininu. Ke zvýšení dochází časně, po několika dnech podávání, a po vysazení léčby se hladina kreatininu během 14 dní vrací k normě. Vzestup hladiny kreatininu je způsoben vyšší tubulární sekrecí, není ovlivněna glomerulární filtrace či průtok krve ledvinami. Dronedaron v klinických studiích neovlivňuje funkci štítné žlázy, i když některé experimentální práce tuto možnost nevylučovaly. Další experimentální práce naznačovaly možnost proarytmického efektu dronedaronu, zejména ve srovnání s amiodaronem. V žádné z provedených studií nebyl dosud pozorován významnější proarytmický efekt.
Bylo by velmi žádoucí mít k dispozici další antiarytmikum, které by bylo možné použít také u rizikových pacientů se strukturálním onemocněním srdce. Zde je zatím dominantní role amiodaronu, bohužel s řadou nežádoucích účinků. V léčbě se začíná více používat dofetilid a azimilid. Efekt a bezpečnost dronedaronu u těchto pacientů musí ověřit další klinické studie, např. již probíhající ATHENA. Jiné studie pak mohou řešit otázku použití dronedaronu v léčbě komorových arytmií, například v populaci pacientů po implantaci ICD s častými výboji.
Obr. 1. Strukturní chemický vzorec dronedaronu a amiodaronu
Seznam použité literatury
- [1] Čihák R, Heinc P. Doporučení pro léčbu pacientů s fibrilací síní. Cor Vasa 2004; 46: 67–77.
- [2] Reiffel JA, Naccarelli GV. Antiarrhythmic drug therapy for atrial fibrillation: are the guidelines guiding clinical practice? Clin Cardiol 2006; 29: 97–102.
- [3] The Atrial Fibrillation Follow-up Investigation of Rhythm Management. Investigators. Relation-ships Between Sinus Rhythm, Treatment and Survival in the Atrial Fibrillation Follow-Up Investigation of Rhythm Management (AFFIRM) Study. Circulation 2004; 109: 1509–1513.
- [4] Bardy GH, Lee KL, Mark DB, Poole JE, et al. Amio- darone or an Implantable Cardioverter Defibrillator for Congestive Heart Failure. N Engl J Med 2005; 352: 2146.
- [5] Goldberg Z, Lampert J. Implantable cardioverter-defibrillators. JAMA 2006; 295: 809–818.
- [6] LeGrand B. Dronedarone. Drugs 2001; 4:582–585.
- [7] Doggell SA, Hancox JC. Dronedarone: an amio-darone analogue. Expert Opin Investig Drugs 2004; 13: 415–426.
- [8] Djandighian L, Planchenault J, Finance O, et al. Hemodynamic and antiadrenergic effect of dronedarone and amiodarone in animal with healed myocardial infarction. J Cardiovasc Pharmacol 2000; 36: 376–383.
- [9] Van Obstal JM, Schoenmakers M, Verduyn SC, et al. Chronic amiodarone evokes no torsade de pointes arrhythmias despite QT lenghtening in an animal model of acquired long QT syndrome. Circulation 2001; 104: 2722–2727.
- [10] Pantos C, Mourouzis I, Delbruyere M, at al. Effect of dronedarone and amiodarone on plasma thyroid hormones and on basal and postischemic performance of the isolated rat heart. Eur J Pharmacol 2002; 444: 191–196.
- [11] Hynes JB, Luck JC, Wolbrette DL. A review of the pharmacokinetics, electrophysiology and clinical efficacy of dronedarone. Future Cardiology 2005; 1: 135–144.
- [12] Zareba KM. Dronedarone: a new antiarrhythmic agent. Drugs of Today 2006, 42: 75–86.
- [13] Touboul P, Brugada J, Capucci A, et al. Dronedarone for prevention of atrial fibrillation: a dose-ranging study. Eur Heart J 2003; 24: 1481–1487.