Duloxetin – třetí antidepresivum skupiny SNRI
Duloxetin je selektivní inhibitor zpětného vychytávání serotoninu a noradrenalinu indikovaný pro léčbu depresivní poruchy, diabetické periferní neuropatické bolesti a stresové močové inkontinence. Při absorpci dosahuje duloxetin maxima plazmatické koncentrace za 6 hodin. Poločas vylučování je 12 hodin. Doporučené dávkování je v rozmezí 40–120 mg pro die (preferenčně 40–80 mg denně). Šance na dosažení remise při léčbě deprese je srovnatelná s užívanými selektivními inhibitory zpětného vychytávání serotoninu (SSRI). Rovněž profil nežádoucích účinků je podobný antidepresivům skupiny SSRI. Nejčastější příčinou přerušení léčby v klinických studiích z důvodu nežádoucích účinků byl výskyt nauzey. Dalšími nežádoucími účinky duloxetinu jsou sucho v ústech, zácpa, insomnie, motání hlavy, únava, ospalost, zvýšené pocení a snížená chuť k jídlu. Zvýšení krevního tlaku, pokud se vyskytne, je jen mírné. Při léčbě deprese může být duloxetin užitečnou alternativou u nemocných, u nichž nedošlo ke zlepšení stavu při užívání jiné antidepresivní terapie nebo u těch, kteří ji nesnášeli.
Farmakologická skupina
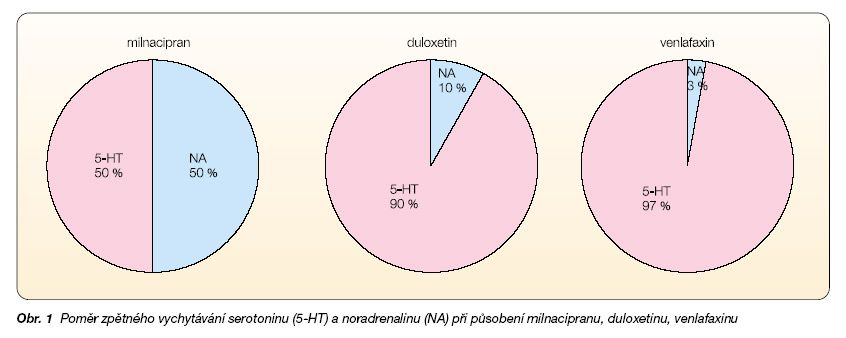
Skupina antidepresiv charakterizovaná selektivní inhibicí zpětného vychytávání serotoninu a noradrenalinu (SNRI) je v současné době reprezentována třemi látkami: venlafaxinem, milnacipranem a duloxetinem. Tyto látky blokují zpětné vychytávání serotoninu (5-HT) a noradrenalinu (NA) ze synaptické štěrbiny v různém vzájemném poměru. Milnacipran je z uvedených tří látek nejvyváženější, blokuje zpětné vychytávání obou látek se srovnatelnou afinitou, ale v porovnání s venlafaxinem a duloxetinem je inhibice zpětného vychytávání obou neurotransmiterů slabší. Působení duloxetinu je spojeno s desetkrát vyšší selektivitou pro 5-HT a venlafaxin přibližně třicetkrát selektivněji blokuje zpětné vychytávání 5-HT v porovnání s NA (obr. 1) [1].
Všechna tři SNRI antidepresiva jsou účinná v léčbě depresivních poruch. SNRI antidepresiva jsou v porovnání se SSRI účinnější v ovlivnění chronické bolesti, a to i takové, která je nezávislá na depresi. Snášenlivost jednotlivých SNRI antidepresiv je rozdílná. U venlafaxinu jsou v porovnání s milnacipranem a duloxetinem výraznější serotoninergní nežádoucí účinky (nauzea, sexuální dysfunkce, problémy při náhlém vysazení) a riziko vyššího krevního tlaku.
Chemické a fyzikální vlastnosti
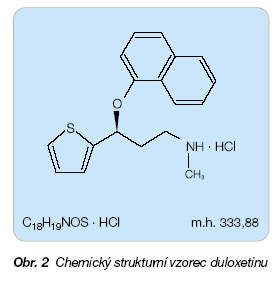
Duloxetin hydrochlorid je selektivní inhibitor zpětného vychytávání serotoninu a noradrenalinu. Chemicky je duloxetin (+)-(S)-N-methyl-g-(1-naftyloxy)-2-thiofenepropylamin hydrochlorid (obr. 2).
Sumární chemický vzorec:
C18H19NOS . HCl
Molekulová hmotnost: 333,88
Duloxetin je připravován ve formě 20mg, 30mg, 40mg a 60mg enterosolventních tvrdých tobolek.
Farmakodynamické vlastnosti
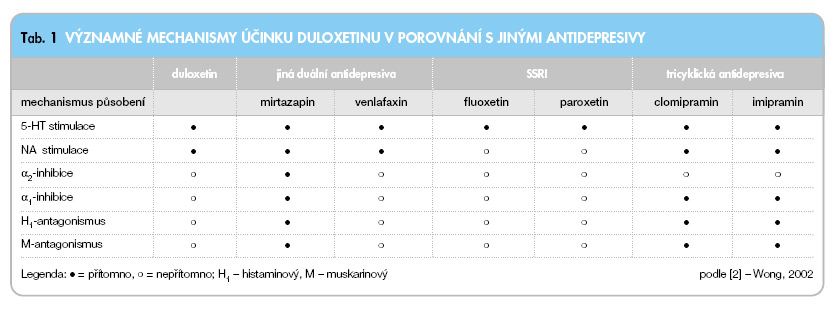
Duloxetin je relativně mohutným inhibitorem zpětného vychytávání 5-HT a NA, blokuje presynaptický transportní mechanismus obou neurotransmiterů. Má slabou afinitu k dopaminovému transportéru a nevýznamně ovlivňuje další neurotransmiterové systémy (muskarinové, histaminové, opiátové, glutamátové a gabaergní – tab. 1). Nevýznamně ovlivňuje sodíkové, kalciové a draslíkové membránové kanály [2].
Výhodným periferním účinkem duloxetinu je augmentační efekt na kontrakci uretrálního sfinkteru se zvýšením kapacity močového měchýře. Tento efekt rozšiřuje indikační oblast duloxetinu o stresovou inkontinenci moči u žen.
Farmakokinetické vlastnosti
Duloxetin je metabolizován oxidačními enzymy (CYP 1A2 a CYP 2D6) s následnou konjugací. Farmakokinetika duloxetinu vykazuje velkou interindividuální variabilitu, částečně kvůli pohlaví, věku, kuřáckým návykům a metabolické aktivitě izoenzymu CYP 2D6. Duloxetin se po perorálním podání dobře absorbuje s cmax za 6 hodin po podání dávky. Perorální biologická dostupnost duloxetinu je v rozmezí od 32 % do 80 % (v průměru 50 %). Jídlo prodlužuje dobu nutnou pro dosažení maximální koncentrace ze 6 na 10 hodin a nepatrně snižuje míru absorpce (asi 11 %). Tyto změny nemají žádný klinický význam. Duloxetin se přibližně z 96 % váže na proteiny lidské plazmy. Váže se jak na albumin, tak i na kyselý a1-glykoprotein. Vazba na proteiny není ovlivněna zhoršenou funkcí ledvin nebo jater [3].
Metabolity duloxetinu se vylučují především močí po extenzivní metabolizaci v játrech. Poločas vylučování je 12 hodin [4]. Oba cytochromy P-450 2D6 a 1A2 katalyzují tvorbu dvou hlavních metabolitů glukuronidového konjugátu 4-hydroxyduloxetinu a sulfátového konjugátu 5-hydroxy-6-methoxyduloxetinu. Na základě studií in vitro jsou cirkulující metabolity duloxetinu považovány za farmakologicky neaktivní. Farmakokinetika duloxetinu u pacientů, kteří jsou slabými metabolizéry CYP 2D6, nebyla speciálně zkoumána.
Indikace, klinické zkušenosti
Duloxetin je užíván ve třech indikacích:
– depresivní porucha
– diabetická periferní neuropatická bolest
– stresová inkontinence moči.
Depresivní porucha
Analýzu šesti dvojitě slepých placebem nebo aktivním komparátorem (fluoxetin a paroxetin) kontrolovaných studií účinnosti a snášenlivosti duloxetinu publikoval Mallinckrodt a kol. [5]. Přehled osmi dvojitě slepých kontrolovaných studií, kterých se účastnilo 2345 depresivních nemocných, shrnují Mallinckrodt a kol. [6] a Švestka [7]. Duloxetin byl v 6 z celkem 8 studií účinnější než placebo a stejně účinný jako fluoxetin a paroxetin. Duloxetin působil také anxiolyticky a zmírňoval u depresivních nemocných bolest. Dobrá dlouhodobá účinnost duloxetinu při léčbě deprese byla prokázána v jednoroční otevřené studii, které se účastnilo 1279 nemocných [8].
Podávání duloxetinu v 8 kontrolovaných studiích bylo spojeno s nízkou incidencí přesmyku do hypomanie (0,2% ve skupině léčené duloxetinem, 0,1% v placebové skupině) [9]. V České republice nebyla do konce roku 2005 ukončena jednání o výši úhrady duloxetinu pro indikaci depresivní poruchy.
Diabetická periferní neuropatická bolest
Duloxetin mírně redukuje bolest u nemocných s diabetickou neuropatií [10], analgetická účinnost však nepřevyšuje ekonomičtější tricyklická antidepresiva [11]. Arnold a kol. [12] popsali dobrý analgetický účinek duloxetinu v dávce 60 a 120 mg pro die ve dvojitě slepé placebem kontrolované studii, které se zúčastnilo 354 žen trpících fibromyalgiemi.
V ČR je duloxetin předepisován neurology k léčbě diabetické neuropatické bolesti u pacientů, kteří neměli dostatečnou terapeutickou odpověď (nedošlo ke zmírnění bolesti alespoň o 50 % dle VAS – Vizuální analogové škály bolesti ) nebo netolerovali léky první volby (amitriptylin, carbamazepin). Kontrola účinnosti léčby duloxetinem v této indikaci je prováděna nejpozději po 4 týdnech a pokud nedošlo k dostatečné terapeutické odpovědi, není léčba dále indikována.
Stresová inkontinence moči
Duloxetin je v ČR registrován rovněž v indikaci močové inkontinence u žen. Je předepisován urologem nebo gynekologem pacientkám starším 18 let s prokázanou stresovou inkontinencí moči I. a II. stupně (urodynamicky, ultrazvukovým vyšetřením), u kterých není primárně indikována chirurgická léčba. Doporučené dávkování je 80 mg pro die (ve dvou denních dávkách po 40 mg). Po 3 měsících léčby duloxetinem je stav pacientky zhodnocen. Pokud frekvence epizod mimovolního úniku moči za týden poklesne pod 50 % (za poslední týden před kontrolou), je léčba duloxetinem plně indikována. Po 6 měsících léčby je stav opět vyhodnocen (kritériem pro toto hodnocení je dotazník s počtem epizod inkontinence), užívání duloxetinu se přeruší na 1 měsíc a stav pacientky je opět vyhodnocen (celkový zdravotní stav, změna frekvence urgencí nebo epizod úniku moči a vedlejší účinky léku). Pokud ústup obtíží přetrvává po dobu alespoň 1 měsíce i po vysazení duloxetinu, je tato léčba ukončena a pacientka bude pozvána na kontrolu za 3 měsíce. Pokud dojde během 1měsíčního přerušení léčby duloxetinem k obnovení obtíží (v původním rozsahu nebo ještě horším), je další podávání duloxetinu indikováno, a to po dobu pokračování účinků léčby, tzn. snížení množství epizod úniku moči pod 50 % výchozí hodnoty. Kontroly pacientky u specialisty (urologa nebo gynekologa) jsou nutné každé 3 měsíce ke zhodnocení účinků léčby a stavu pacientky. Pokud léčba trvá déle než 1 rok, je nutné kontrolní vyšetření pacientky (urodynamické, event. UZ a vyhodnocení PWT – test vážení vložky).
Nežádoucí účinky a kontraindikace
Nejčastěji hlášené nežádoucí účinky u pacientů léčených duloxetinem jsou nevolnost, sucho v ústech a zácpa. Většina častých nežádoucích účinků však je charakterizována jako lehké až středně těžké. Objevují se obvykle na začátku léčby a většinou ustupují během pokračující léčby. Analýzu bezpečnosti a snášenlivosti duloxetinu v osmi kontrolovaných dvojitě slepých studiích publikoval Hudson a kol. [13]. V analyzovaných studiích bylo k léčbě duloxetinem randomizováno 1139 nemocných (40–120 mg/p.d.), v placebových skupinách bylo celkem 777 pacientů. Hodnoceno bylo prvních 9 týdnů léčby a ve dvou studiích dalších 26 týdnů. Výskyt závažných nežádoucích příznaků se v obou skupinách statisticky nelišil (duloxetin 0,3 %, placebo 0,6 %; p = 0,282). Pro nežádoucí účinky předčasně ukončilo léčbu 9,7 % nemocných léčených duloxetinem a 4,2 % nemocných na placebu (p < 0,001).
Nejčastější příčinou přerušení léčby duloxetinem byla nauzea. Minimálně v 5 % a statisticky významně častěji než v placebové skupině se při podávání duloxetinu vyskytovaly následující nežádoucí účinky: nauzea, sucho v ústech, zácpa, nespavost, motání hlavy, únava, ospalost, zvýšené pocení a pokles chuti k jídlu. Ve skupině nemocných léčených duloxetinem byl pozorován pokles tělesné hmotnosti průměrně o 0,5 kg (v placebové skupině se hmotnost zvýšila o 0,2 kg; p < 0,001). U pacientů, kterým bylo podáváno 60–120 mg denně, byla četnost všech mužských i ženských sexuálních nežádoucích účinků 17,7 % u mužů léčených duloxetinem (ve srovnání se 4,0 % u mužů, kterým bylo podáváno placebo) a 2,9 % u žen léčených duloxetinem (ve srovnání s 0,4 % u žen, kterým bylo podáváno placebo).
Thase se spolupracovníky [14] sumarizoval výsledky vyšetření EKG z osmi placebem kontrolovaných studií. Elektrokardiogramy byly hodnoceny u 1139 pacientů léčených duloxetinem a u 777 pacientů, kterým bylo podáváno placebo v rámci 8týdenních klinických studií. Interval QT s korekcí na srdeční frekvenci u pacientů léčených duloxetinem se nelišil od intervalu stanoveného u pacientů, jimž bylo podáváno placebo. U nemocných, kterým byl podáván duloxetin, bylo zaznamenáno mírné, klinicky nevýznamné zvýšení tepové frekvence a systolického tlaku. Efekt na tlak a puls byl srovnatelný s účinky paroxetinu a fluoxetinu (ve studii užité aktivní komparátory). U 1 % nemocných dochází k přechodnému zvýšení sérových hladin alanin transaminázy [15].
Při ukončení podávání duloxetinu byly zaznamenány příznaky z vysazení. Mezi běžné příznaky, obzvláště při náhlém vysazení, patří závratě, nevolnost, nespavost, bolest hlavy a úzkost [16]. V případě ukončení léčby duloxetinem, která trvala déle než 1 týden, se ve snaze snížit riziko příznaků z vysazení obecně doporučuje dávku postupně snižovat alespoň 2 týdny před ukončením léčby. Obecně se doporučuje během tohoto období dávku snížit na polovinu nebo ji podávat každý druhý den.
Zkušenosti s předávkováním duloxetinem u člověka jsou omezené. V klinických studiích uskutečněných před uvedením přípravku na trh nebyly zaznamenány žádné případy smrtelného předávkování duloxetinem. Byly zaznamenány případy akutního požití léčiva v dávkách do 1400 mg – buď samotného, nebo v kombinaci s jinými léčivy. Specifické antidotum duloxetinu není známo. Je třeba zajistit průchodnost dýchacích cest. Doporučuje se monitorovat srdeční parametry a životní funkce a zajistit odpovídající symptomatická a podpůrná opatření. Krátce po požití nebo u symptomatických pacientů může být indikován výplach žaludku. Aktivní uhlí může být prospěšné pro omezení absorpce. Duloxetin má velký distribuční objem a je velmi málo pravděpodobné, že by forsírovaná diuréza, hemoperfuze a výměnná perfuze mohly být přínosné.
Klinická omezení
O podávání duloxetinu těhotným ženám nejsou žádné údaje. Možné reprodukční riziko u člověka není známo. Duloxetin je podle FDA (Food and Drug Administration – USA) zařazen do kategorie C v hodnocení teratogenity. Podobně jako u ostatních serotoninergních léků se symptomy z vysazení mohou vyskytnout u novorozence v případě, že jeho matka před porodem užívala duloxetin. Vylučování duloxetinu do mateřského mléka u žen nebylo studováno. Podávání duloxetinu během kojení se nedoporučuje.
Opatrné dávkování je doporučováno při záchvatové anamnéze. V souvislosti s duloxetinem byla zaznamenána mydriáza. Proto je nutno dbát opatrnosti, má-li být duloxetin předepisován pacientům se zvýšeným nitroočním tlakem nebo při riziku akutního glaukomu s uzavřeným úhlem. U pacientů s hypertenzí nebo jiným kardiálním onemocněním se doporučuje sledovat krevní tlak. U pacientů s těžkým poškozením ledvin na hemodialýze (clearance kreatininu < 30 ml/min.) dochází ke zvýšení plazmatické koncentrace duloxetinu.
Duloxetin by neměli užívat pacienti s onemocněním jater. U pacientů s mírnou až středně těžkou dysfunkcí ledvin (clearance kreatininu je 30 až 80 ml/min) není třeba dávkování upravovat. O použití duloxetinu u starších pacientů s depresivními poruchami jsou k dispozici pouze omezené klinické údaje. Proto je třeba při léčbě starších pacientů dbát zvýšené opatrnosti. Než bude k dispozici více údajů o účinnosti, není podávání duloxetinu u velmi staré populace (> 75 let) doporučeno.
Bezpečnost a účinnost duloxetinu u dětí a adolescentů nebyly zkoumány. Z tohoto důvodu se podávání duloxetinu pacientům těchto věkových kategorií nedoporučuje.
Lékové interakce
Doporučuje se dbát opatrnosti, je-li duloxetin podáván v kombinaci s ostatními centrálně působícími léky a látkami včetně alkoholu a sedativ (např. benzodiazepiny, morfinomimetika, antipsychotika, phenobarbital, sedativní antihistaminika). Vzhledem k riziku vzniku serotoninového syndromu by se duloxetin neměl užívat v kombinaci s neselektivními ireverzibilními inhibitory monoaminoxidázy (IMAO), a to v období pěti dní před podáním IMAO nebo po dobu nejméně 14 dní po ukončení léčby IMAO [15]. S ohledem na biologický poločas duloxetinu lze léčbu IMAO zahájit nejdříve 5 dní po vysazení přípravku. Pro selektivní reverzibilní IMAO (moclobemid) je riziko serotoninového syndromu nižší. Současné podávání duloxetinu se selektivními reverzibilními IMAO se však rovněž nedoporučuje. Je třeba dbát opatrnosti, je-li duloxetin podáván současně se serotoninergními antidepresivy (SSRI), tricyklickými antidepresivy, třezalkou (Hypericum perforatum), venlafaxinem nebo triptany, tramadolem, pethidinem a tryptofanem.
Duloxetin je metabolizován izoenzymy CYP 2D6 a CYP 1A2, se středně velkým potenciálem pro interakce s CYP 2D6 [17]. Proto je třeba dbát opatrnosti, je-li duloxetin podáván současně s léčivy, která jsou převážně metabolizována prostřednictvím CYP 2D6 a pokud mají úzký terapeutický index.
Vzhledem k tomu, že CYP 1A2 je zapojen do metabolismu duloxetinu, současné podávání duloxetinu s účinnými inhibitory CYP 1A2 (například fluvoxamin) může zvyšovat koncentraci duloxetinu. U kuřáků (indukce CYP 1A2) jsou plazmatické koncentrace duloxetinu ve srovnání s nekuřáky téměř o 50 % nižší.
Dávkování
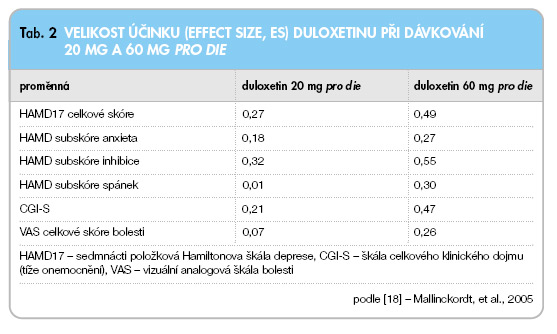
Počáteční a doporučená udržovací dávka je 40–60 mg jednou denně nezávisle na jídle. V klinických studiích byly z hlediska bezpečnosti vyhodnocovány i dávky vyšší než 60 mg (do maximální dávky 120 mg/den) v rovnoměrně rozdělených dávkách [10, 18]. Neexistuje však žádný klinický důkaz, který by naznačoval, že pacientům nereagujícím na počáteční doporučenou dávku prospěje její zvyšování. Při užití denní dávky 20 mg je velikost účinku (effect size) významně nižší [18] (tab. 2). Odpověď na léčbu lze obvykle pozorovat po 2–4 týdnech léčby.
Závěr
Duloxetin je vedle milnacipranu a venlafaxinu třetím antidepresivem skupiny SNRI. Vzhledem ke svému analgetickému účinku je také registrován pro léčbu bolesti u diabetických neuropatií. Klinicky je duloxetin zkoušen rovněž u fibromyalgií. Posilující účinek na svaly sfinkteru uretry umožňuje třetí registrovanou indikaci duloxetinu, kterou je stresová inkontinence moči u žen. Duloxetin je v České republice k dispozici pod obchodními názvy Cymbalta (indikace léčby deprese a diabetické neuropatické bolesti) a Yentreve pro léčbu stresové močové inkontinence. Výše úhrad by měla být uvedena ve Vyhlášce Ministerstva zdravotnictví ČR O úhradách léčiv s platností od 1. 1. 2006.
Seznam použité literatury
- [1] Stahl SM, Grady MM, Moret C, Briley M. SNRIs: their pharmacology, clinical efficacy, and tolerability in comparison with other classes of antidepressants. CBS Spectr 2005; 10 (9): 732–747.
- [2] Wong DT, Bymaster FP. Dual serotonin and noradrenalin uptake inhibitor class of antidepressants-potential for greater efficacy or just hype? Prog Drug Res 2002; 58: 169–222.
- [3] Sharma A, Goldberg MJ, Cerimcle BJ. Pharmacokinetics and safety of duloxetine, a dual-serotonin and norepinephrine reuptake inhibitor. J Clin Pharmacol 2000; 40: 161–167.
- [4] Wernicke JF, Gahimer J, Yalcin I, et al. Safety and adverse event profile of duloxetine. Expert Opin Drug Saf 2005; 4 (6): 987–993.
- [5] Mallinckrodt CH, Goldstein DJ, Detke MJ, et al. Duloxetine: A New Treatment for the Emotional and Physical Symptoms of Depression. Prim Care Companion J Clin Psychiatry 2003; 5 (1): 19–28.
- [6] Mallinckrodt CH, Raskin J, Wohlreich MM, et al. The efficacy of duloxetine: a comprehensive summary of results from MMRM and LOCF_ANCOVA in eight clinical trials. BMC Psychiatry 2004; 4: 1–9.
- [7] Švestka J. Duloxetin – duální specifický inhibitor reuptake serotoninu a noradrenalinu v léčbě akutní depresivní poruchy. Psychiatrie 2005; 9 (1): 23–30.
- [8] Raskin J, Goldstein DS, Mallinckrodt CH, Ferguson MB. Duloxetine in the long-term treatment of major depressive disorder. J Clin Psychiatry 2003; 64: 1237–1244.
- [9] Dunner DL, D_Souza DN, Kajdasz DK, et al. Is treatment-associated hypomania rare with duloxetine: secondary analysis of controlled trials in non-bipolar depression. J Affect Disord. 2005; 87 (1): 115–119.
- [10] Goldstein DJ, Lu Y, Detke MJ, et al. Duloxetine vs. placebo in patients with painful diabetic neuropathy. Pain 2005; 116: 109–118.
- [11] Cobb C, Crichlow R. Duloxetine (Cymbalta) for treatment of major depressive disorder. Am Fam Physician 2005; 72 (Sept 15).
- [12] Arnold LM, Rosen A, Pritchett YL, et al. A randomized, double-blind, placebo-controlled trial of duloxetine in the treatment of women with fibromyalgia with or without major depressive disorder. Pain 2005 Nov 16; [Epub ahead of print].
- [13] Hudson JI, Wohlreich MM, Kajdasz DK, et al. Safety and tolerability of duloxetine in the treatment of major depressive disorder: analysis of pooled data from eight placebo-controlled clinical trials. Human Psychopharmacology 2005; 20 (5): 327–341.
- [14] Thase ME, Tran PV, Wiltse C, et al. Cardiovascular profile of duloxetine, a dual reuptake inhibitor of serotonin and norepinephrine. J Clin Psychopharm 2005; 25: 132–140.
- [15] Eli Lilly and Company. Cymbalta (duloxetine) package insert. Accesed online July 12, 2005, at http: //pi.lilly.com./us/cymbaltapi.pdf.
- [16] Perahia DG, Kajdas DK, Desaiah D, Haddad PM. Symptoms following abrupt discontinuation of duloxetine treatment in patients with major depressive disorder. J Affect Disord 2005 Nov; [Epub ahead of print].
- [17] Caccia S. Metabolism of the newest antidepressants: comparisons with related predecessors. I Drugs 2004; 7: 143–150.
- [18] Mallinckrodt CH, Prakash A, Andorn AC, et al. Duloxetine for the treatment of major depressive disorder: A closer look at efficacy and safety data across the approved dose range. J Psychiatr Res 2005; Nov 3;[Epub ahead of print].