Dupilumab v terapii těžkého astmatu
Souhrn:
Koukalová E, Hutyrová B. Dupilumab v terapii těžkého astmatu. Remedia 2019; 29: 452–455.
Astma představuje v současné době onemocnění poměrně dobře kontrolovatelné konvenční terapií. Existuje skupina nemocných s těžkým refrakterním astmatem, u nichž nadále zůstává dosažení kontroly nad onemocněním výzvou. V posledním desetiletí se zde uplatňuje, tak jako v jiných oborech medicíny, biologická léčba. Nově schválenou indikací pro monoklonální protilátku dupilumab, po těžké atopické dermatitidě, je asthma bronchiale. Cílovou strukturou dupilumabu je společná podjednotka receptoru pro interleukin 4 a interleukin 13. Tyto cytokiny hrají klíčovou roli v patogenezi eozinofilního zánětu. Klinické studie potvrzují účinnost dupilumabu u pacientů s těžkým refrakterním astmatem se zánětem typu 2 charakterizovaným zvýšeným počtem eozinofilů v periferní krvi a/nebo elevací hodnot oxidu dusnatého ve vydechovaném vzduchu (FeNO). Dupilumab zlepšuje plicní funkce, redukuje počet exacerbací a dávku užívaných systémových kortikosteroidů.
Summary:
Koukalova E, Hutyrova B. Dupilumab in the treatment of severe asthma. Remedia 2019; 29: 452–455.
Asthma is currently relatively well controled disease with conventional therapy. There is a group of patients with severe refractory asthma where the sufficient control stays a challenge for the clinicians. Biological treatment is applied in these cases in the last decade. A monoclonal antibody dupilumab was recently approved for asthma bronchiale, in addition to atopic dermatitis. The target structure of dupilumab is a subunit of receptor for interleukin‑4 and interleukin‑13 which are key drivers in the pathogenesis of the eosinophilic inflammation. Clinical trials confirm efficacy of dupilumap in the treatment of patients with severe type 2 asthma which is characterised by elevated blood eosinophilia and/or increase of fractional exhaled nitric oxid (FeNO). Dupilumab improves lung functions, reduces the number of exacerbations and the dose of used oral corticosteroids.
Key words: severe eosinophilic asthma, monoclonal antibodies against interleukin‑4, interleukin‑13 ,dupilumab
Úvod
Asthma bronchiale je heterogenní chronické zánětlivé onemocnění dýchacích cest. Patogenetickým korelátem je chronický zánět průdušek spojený s bronchiální hyperreaktivitou a s variabilní, často reverzibilní obstrukcí dýchacích cest. Kromě bronchokonstrikce se na ní podílí edém a produkce vazkého hlenu, nezastupitelnou úlohu hrají četné buňky zánětu a jejich cytokiny. Klinickým korelátem astmatu jsou opakující se epizody dušnosti, pískotů, tíže na hrudi a kašle, které odrážejí bronchiální hyperreaktivitu [1]. Podle současných znalostí je možno pacienty s astmatem zařadit do určitých fenotypů definovaných klinickými a morfologickými charakteristikami, jako jsou např. doba vzniku onemocnění, atopická osobní či rodinná anamnéza, eozinofilie, sérové koncentrace imunoglobulinu E (IgE), plicní funkce, odpověď na terapii kortikosteroidy při exacerbacích, kouření, obezita atd. Fenotyp vzniká interakcí genotypu a zevního prostředí [2].
Terapie těžkého astmatu
Astma je v současnosti u většiny pacientů kontrolovatelné konvenční terapií, tzn. inhalačními kortikosteroidy (IKS), případně v kombinaci s dlouhodobě působícími β2 agonisty (long acting beta 2 agonists, LABA), v těžších stupních v kombinaci s přídatnou terapií antileukotrieny, teofyliny, dlouhodobě působícími antagonisty muskarinových receptorů.
Ovšem zůstává skupina pacientů s těžkým refrakterním astmatem, kteří nedosahují kontroly onemocnění touto konvenční terapií. V České republice (ČR) tvoří asi 6–8 % pacientů s astmatem, dle studie FOSCA z roku 2016 [3]. Fenotypově se jedná o heterogenní skupinu nemocných se zastoupením fenotypu eozinofilního alergického, eozinofilního nealergického a neeozinofilního nealergického. Eozinofilní astma, ať již alergické, či nealergické, se vyskytuje asi v 50 % případů nemocných s těžkým astmatem a vyznačuje se zánětem typu 2, kde důležitou roli hrají markery − interleukiny (IL) 4, IL 5, IL 13. U pacientů s astmatem neeozinofilním nealergickým bývá zachycen zánět neutrofilní nebo paucigranulocytární [4].
V minulosti bylo jedinou možností terapie těžkého refrakterního astmatu podání systémových kortikosteroidů (SKS) provázené rizikem rozvoje nežádoucích účinků. V posledním desetiletí můžeme i u nás těmto pacientům nabídnout biologickou terapii, která je vázána na centra biologické léčby. Prvním biologikem byl omalizumab (anti IgE protilátka), který byl v roce 2008 schválen v indikaci těžkého astmatu s průkazem alergie na inhalační celoroční alergen u pacientů se dvěma nebo více těžkými exacerbacemi prodělanými v posledním roce, tzn. vyžadujícími léčbu SKS.
Od roku 2015 byly v Evropské unii postupně registrovány humanizované monoklonální protilátky proti IL-5 (anti IL 5). Interleukin 5 lze považovat za ústřední molekulu eozinofilního zánětu, který hraje klíčovou roli v patogenezi eozinofilního astmatu, a jeho inhibice je žádoucím terapeutickým cílem. V České republice je u pacientů s těžkým refrakterním eozinofilním astmatem indikována léčba mepolizumabem (úhrada schválena od 1. 9. 2018), reslizumabem (úhrada od 1. 5. 2019) a benralizumabem (zatím možno žádat prostřednictvím paragrafu 16). V současnosti stanovená úhradová kritéria pro terapii anti IL 5 jsou: 1. periferní eozinofilie ≥ 300/µl pro léčbu mepolizumabem a ≥ 400/µl pro léčbu reslizumabem, 2. dodržování zákazu kouření, 3. nejméně čtyři těžké exacerbace s nutností podávání SKS v posledních 12 měsících navzdory dlouhodobé léčbě IKS a přídatné léčbě nebo dlouhodobé užívání SKS (nejméně 5 mg prednisonu denně alespoň šest měsíců) [5].
Dupilumab – anti IL 4
Charakteristika
Dupilumab je humánní monoklonální
protilátka proti alfa podjednotce receptoru pro interleukin 4
(IL 4Rα). Tato podjednotka je sdílená receptorem pro IL 4
i IL 13. Dupilumab blokuje vazbu IL 4 a IL 13
na tento receptor a tím ovlivňuje roli zmíněných
cytokinů v alergickém zánětu. Synergistický efekt IL 4
a IL 13 je jedním z hlavních aktivátorů Th2
alergického zánětu s následnou produkcí IgE. Mechanismem
signalizace je aktivace signálních proteinů (aktivátorů
transkripce STAT6 a Janusových kináz JAK1), obrázek 1.
Interleukin 4 hraje klíčovou roli v alergickém zánětu,
indukuje izotypový přesmyk a tvorbu IgE, brání apoptóze T
buněk, indukuje expresi adhezních molekul endoteliálních buněk
(VCAM 1), ovlivňuje chemotaxi buněk charakteristických pro
alergický zánět (T lymfocyty, eozinofily, bazofily, monocyty),
podporuje Th2 fenotyp zánětu [6].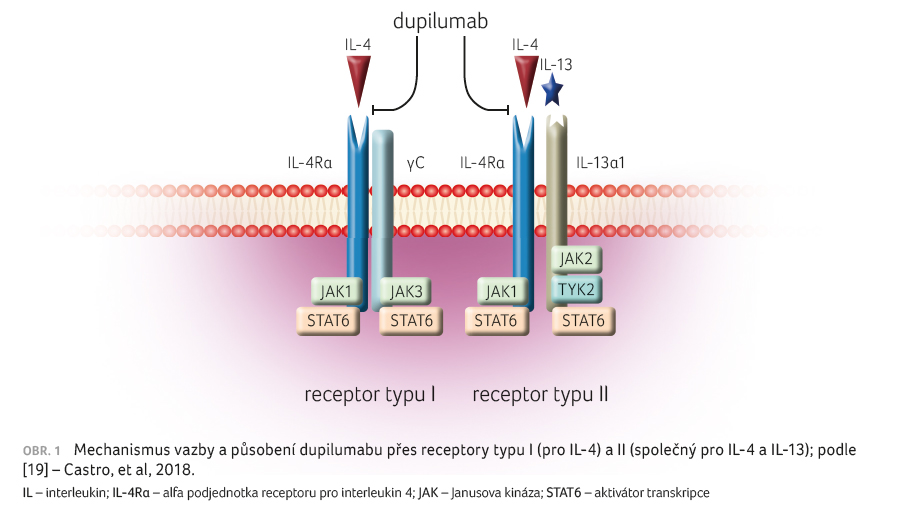
Biologikum pro atopickou dermatitidu
Už v roce 2017 byl dupilumab (Dupixent) schválen americkým Úřadem pro kontrolu potravin a léčiv (Food and Drug Administration, FDA) a Evropskou lékovou agenturou (European Medicines Agency, EMA) k léčbě dospělých pacientů se středně těžkou a těžkou atopickou dermatitidou, kteří jsou kandidáty systémové terapie. To znamená, že léčivo je určeno pacientům, jejichž ekzém není dostatečně kontrolován topickou léčbou nebo se u nich tato léčba nedoporučuje. Dupilumab může být použit s lokálními kortikosteroidy nebo bez nich, mohou být použity také topické inhibitory kalcineurinu. Doporučená iniciální dávka dupilumabu je u dospělých pacientů 600 mg (dvě injekce po 300 mg), následována dávkou 300 mg každý druhý týden formou subkutánní injekce [7].
Nová naděje pro těžké astmatiky
Dupilumab je zkoumán již více než 10 let ve studiích s pacienty, jejichž středně těžké až těžké astma není pod dostatečnou kontrolou. Data ze studií fáze II a III ukazují, že dupilumab je účinný v redukci exacerbací a užívání kortikosteroidů, naopak při jeho podávání dochází k vzestupu plicních funkcí (nárůst FEV1, objem vzduchu usilovně vydechnutý za první sekundu). Jeho schválení FDA v říjnu 2018 a v květnu 2019 i EMA pro terapii dospělých pacientů a adolescentů starších 12 let s eozinofilním a kortikodependentním astmatem se opírá o výsledky tří stěžejních randomizovaných kontrolovaných studií globálního programu LIBERTY ASTHMA. Programu se zúčastnilo 2 888 dospělých a adolescentů ve studiích fáze III QUEST a VENTURE a ve studii fáze IIb [8].
Do studie fáze II bylo zařazeno
776 pacientů se středně těžkým až těžkým nedostatečně
kontrolovaným astmatem diagnostikovaným minimálně 12 měsíců,
kteří byli léčeni IKS podávanými ve středních až
vysokých dávkách v kombinaci s LABA podávanými dvakrát
denně. Pacienti byli rozděleni do pěti skupin dle dávky
dupilumabu (200 mg a 300 mg) a frekvence podávání
biologika (každé dva, nebo čtyři týdny) a do skupiny
placeba. Studie prokázala signifikantní zlepšení hodnot FEV1,
kvality života pacientů, redukci rizika exacerbací a významný
pokles hodnot exhalovaného oxidu dusnatého (FeNO) [9].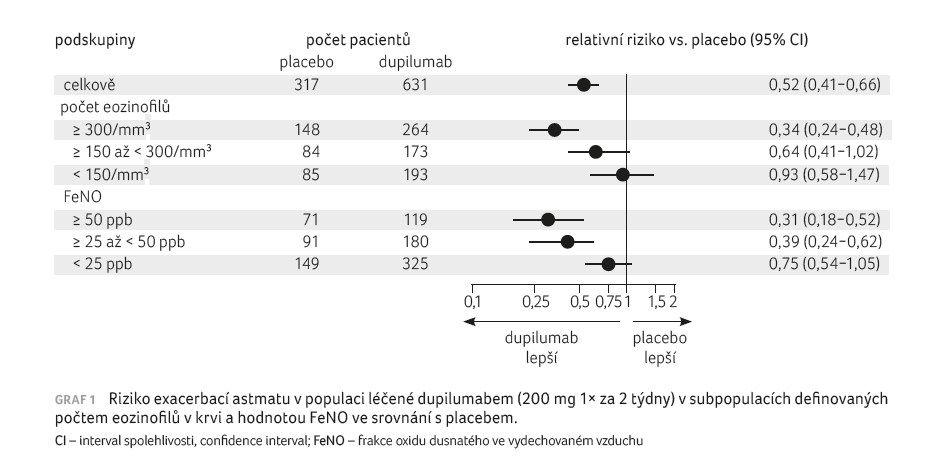
Studie QUEST zahrnovala 1 902
pacientů (1 795 dospělých a 107 adolescentů)
s perzistujícím astmatem pod nedostatečnou kontrolou. Byli
zařazeni nezávisle na hodnotě markerů Th2 zánětu. Během
studie pokračovali v terapii středními nebo vysokými dávkami
IKS a dvěma dalšími přípravky přídatné terapie.
V aktivním rameni byl dupilumab podáván v dávce 200 mg
nebo 300 mg v subkutánní injekci. Dupilumab v dávce
300 mg redukoval těžké exacerbace o 46 % v celé
populaci, o 60 % u pacientů s počtem
eozinofilů ≥ 150/µl, o 67 % u pacientů
s počtem eozinofilů ≥ 300/µl (p < 0,001),
graf 1. Výsledky byly
srovnatelné při aplikaci dupilumabu v dávce 200 mg versus
300 mg. Po 12 týdnech terapie dupilumabem bylo zjištěno
zlepšení hodnoty prebronchodilatačního FEV1 o 130 ml
(9 %) v celé studované populaci, o 210 ml (11 %)
u pacientů s počtem eozinofilů ≥ 150/µl,
o 240 ml (18 %) s počtem eozinofilů ≥ 300/µl
(p < 0,001)
ve srovnání s placebem (graf 2). Byla pozorována nižší odpověď i u pacientů
s počtem eozinofilů nižším než 150/µl. Zajímavé je
zjištění, že tato biologická terapie prokazuje efekt
i v podskupině pacientů bez signifikantního zvýšení
počtu krevních eozinofilů (< 300/μl), ale s elevací
hodnot FeNO. Lze se domnívat, že u těchto pacientů bez
eozinofilie je patologický proces řízen IL 13 [10].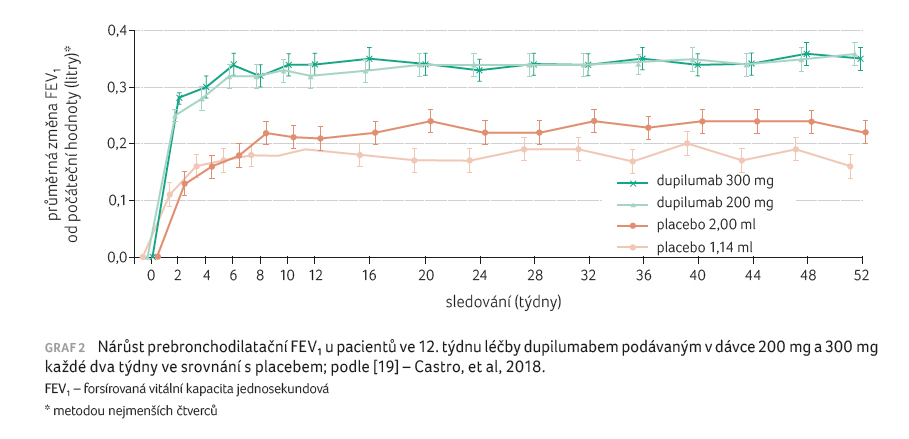
Studie, jejímiž autory jsou Venture a kol., zahrnovala 210 pacientů (103 ve větvi s dupilumabem, 107 ve větvi s placebem) s těžkým astmatem pravidelně léčených SKS v posledních šesti měsících. Bylo prokázáno, že dupilumab redukuje užití SKS o 70 % (oproti 40 % u placeba), subanalýza prokázala, že ve skupině pacientů s počtem eozinofilů ≥ 300/µl až o 80 %. Ve 24. týdnu více než polovina pacientů mohla zcela přestat užívat SKS. Rovněž byly hodnoceny plicní funkce a bylo zjištěno zvýšení FEV1 účinkem dupilumabu po 24 týdnech o 220 ml (15 %) v celé populaci, o 320 ml (25 %) ve skupině s počtem eozinofilů ≥ 300/µl [10].
V současné době pokračují další studie k ověření účinnosti a bezpečnosti dupilumabu. Studie TRAVERSE, kde je zařazeno 2 206 dospělých a adolescentů z předešlých studií v terapii dupilumabem podávaným každé dva týdny po dobu 60–108 týdnů, má za cíl vyhodnotit nežádoucí účinky. Ukončení studie je plánováno na říjen 2019 [11]. Studie VOYAGE je zaměřena na věkovou skupinu 6–12 let a jejím cílem je vyhodnotit efekt terapie dupilumabem podávaným každé dva týdny na exacerbace astmatu [12].
Vzhledem k podílu Th2 zánětu a k roli IL 4 a IL 13 v patogenezi dalších alergických i jiných onemocnění nepřekvapí skutečnost, že dupilumab je zahrnut v klinických studiích zkoumajících jeho efekt u chronické rinosinusitidy s nosními polypy (dokončeno hodnocení fáze III), eozinofilní ezofagitidy (fáze III), alergie na potraviny a na životní prostředí (fáze II), samozřejmě atopické dermatitidy v dětské populaci, a dokonce u chronické obstrukční plicní choroby (fáze III) [8].
Bezpečnost a nežádoucí účinky
Ve všech studiích zaměřených na terapii atopické dermatitidy je incidence nežádoucích účinků ve skupině s dupilumabem a ve skupině s placebem podobná. Velmi zřídka se vyskytly závažné nežádoucí reakce, výjimečně vedly k přerušení terapie dupilumabem. V dlouhodobých studiích byla četnost výskytu konjunktivitid, reakcí v místě injekce a lokálního herpes simplex vyšší ve skupině s dupilumabem než v placebové skupině [13]. Přítomnost zánětu spojivky a hyperemie byly referovány u 25–50 % pacientů s atopickou dermatitidou léčených dupilumabem [14]. Vyskytla se obava, že častý výskyt zánětu spojivek by mohl limitovat užití dupilumabu, obzvláště u dětí. Nicméně ve studiích s astmatem a nazální polypózou se zvýšený výskyt konjunktivitid ve srovnání s placebem neprokázal. To podporuje domněnku o specifickém patogenetickém mechanismu rozvoje konjunktivitidy u atopické dermatitidy léčené dupilumabem, v němž by mohl hrát roli IL 13 a jeho regulační efekt na pohárkové buňky spojivky [15].
V analýze studie QUEST sledující dlouhodobé podávání dupilumabu je četnost nežádoucích reakcí ve skupině s dupilumabem a ve skupině s placebem shodná, přičemž jsou zahrnuty infekce, konjunktivitidy, herpes simplex, smrt, přerušení terapie. Lokální reakce v místě vpichu je častější ve skupině s dupilumabem (17 %) než ve skupině s placebem (8 %). Rovněž je referována hypereozinofilie, která je způsobena delším přežíváním eozinofilů, jejich aktivací a redistribucí do tkání, a je tedy přechodná a většinou ustoupí ještě během léčby dupilumabem [16].
U dupilumabu není nutná úprava dávky u osob starších 65 let, není potřeba zohledňovat hmotnost či lehčí až střední renální insuficienci. Účinnost a bezpečnost podávání nebyla stanovena u pacientů s hepatální insuficiencí, u pacientů s atopickou dermatitidou mladších 18 let, u pacientů s astmatem mladších 12 let. Celkově klinická data naznačují velmi dobrou toleranci a bezpečnost dupilumabu. Je třeba, aby tyto skutečnosti byly potvrzeny v extenzivních studiích a v dětské populaci [17,18].
Závěr
Dupilumab (Dupixent) je indikován jako přídatná udržovací léčba u dospělých a dospívajících ve věku od 12 let s těžkým astmatem se zánětem typu 2 charakterizovaným zvýšeným počtem eozinofilů v krvi a/nebo zvýšenými hodnotami FeNO, není li onemocnění těchto pacientů dostatečně kontrolováno IKS ve vysokých dávkách a dalším léčivým přípravkem k udržovací léčbě. Terapie má být zahájena lékařem se zkušenostmi v diagnostice a léčbě stavů, pro které je dupilumab indikován.
Doporučená dávka dupilumabu u dospělých a dospívajících (od 12 let a starších) je:
- U pacientů s těžkým astmatem užívajících perorální kortikosteroidy nebo u pacientů s těžkým astmatem a komorbidní středně těžkou až těžkou atopickou dermatitidou je úvodní dávka 600 mg (dvě injekce po 300 mg) následována dávkou 300 mg podávanou každý druhý týden formou subkutánní injekce.
- U všech ostatních pacientů je úvodní dávka 400 mg (dvě injekce po 200 mg) následována dávkou 200 mg podávanou každý druhý týden formou subkutánní injekce. Pacienti užívající současně perorální kortikosteroidy mohou snížit dávku kortikosteroidů, pokud již léčbou dupilumabem došlo ke klinickému zlepšení. Snižování dávky kortikosteroidů musí probíhat postupně [18].
Přípravek Dupixent ve formě předplněné injekce je pacientovi aplikován subkutánně ve zdravotnickém zařízení nebo si jej může aplikovat sám v domácím prostředí po předchozím zacvičení zdravotnickým pracovníkem.
Od roku 2017 podle konsenzu GINA (Global Initiative for Asthma) je biologická terapie předřazena pravidelné systémové terapii kortikosteroidy. Od května 2019, kdy bylo oznámeno schválení EMA pro Evropskou unii, je možné žádat o schválení terapie dupilumabem prostřednictvím paragrafu 16, na schválení úhrady v ČR čekáme.
Seznam použité literatury
- [1] Kašák V. Asthma bronchiale, průvodce ošetřujícího lékaře (Farmakoterapie pro praxi), 2. vydání. Praha: Maxdorf, 2013.
- [2] Novosad J, Krčmová I. Biomarkery v léčbě bronchiálního astmatu. Postgrad med 2019; 21: 344–353.
- [3] Teřl M, Pohunek P, Kuhn M, Bystroň J. Four seasons of Czech asthma study: asthma charakteristics and magement reality in the Czech Republic. J Asthma 2019; doi: 10.1080/02770903.2019.1619082.
- [4] Teřl M, Čáp P, Dvořáková R, et al. Doporučený postup diagnostiky a léčby bronchiálního astmatu, společný DP ČPFS a ČSAKI, aktualizace 2016. Dostupný na: http://pneumologie.cz/guidelines/.
- [5] Koukalová E, Hutyrová B, Bystroň J. Biologická terapie v alergologii. Postgrad med 2019; 21: 330–338.
- [6] Deleanu D, Nedelea I. Biological therapies for atopic dermatitis: An update (review). Exp Ther Med 2019; 17: 1061–1067.
- [7] Krčmová I, Novosad J. Biologická léčba v imunoalergologii. Farmakoter Revue 2018; 3: 609–618.
- [8] Sastre J, Dávila I. Dupilumab: A New Paradigm for the Treatment of Allergic Diseases. Reviews. J Investig Allergol Clin Immunol 2018; 28: 139–150.
- [9] Wenzel S, Castro M, Corren J, et al. Dupilumab efficacy and safety in adults with uncontrolled persistent asthma despite use of medium‑to‑high‑dose inhaled corticosteroids plus a long‑acting beta2 agonist: a randomised double‑blind placebo‑controlled pivotal phase 2b dose‑ranging trial. Lancet 2016; 388: 31–44.
- [10] Krings J, McGregor M, Bacharier L, Castro M. Biologics for Severe Asthma: Treatment‑Specific Effect Are Important in Choosing a Specific Agent. J Allergy Clin Immunol Pract 2019; 7: 1379–1391.
- [11] Sanofi. Long‑Term Safety Evaluation of Dupilumab in Patients With Asthma (LIBERTY ASTHMA TRAVERSE). ClinicalTrials.gov: [January 12, 2018]
- [12] Sanofi Evaluation of Dupilumab children With Uncontrolled Asthma (VOYAGE). ClinicalTrials.gov: [January 12, 2018]
- [13] Blauvelt A, de Bruin‑Weller M, Gooderham, et al. Long‑term management of moderate‑to‑severe atopic dermatitis with dupilumab and concomitant topical corticosteroids (LIBERTY AND CHRONOS): a 1‑year, randomised, double‑blinded, placebo‑controlled, phase 3 trial. Lancet 2017; 389: 2287–2303.
- [14] Wollenberg A, Ariens L, Thurau S, et al. Conjunctivitis Occurring in Atopic Dermatitis Patiens Treated with Dupilumab – clinical Characteristics and Treatment. J Allergy Clin Immunol In Practice 2018; 6: 1778−1780.
- [15] Contreras‑Ruiz L, Ghosh‑Mitra A, Shatos MA, et al. Modulation of conjunctival goblet cell function by inflammatory cytokines. Mediators Inflamm 2013: 2013: 636812.
- [16] Rabe KF, Nair P, Brusselle G, et al. Efficacy and safety of dupilumab in glucocorticoid‑dependent severe asthma. N Engl J Med 2018; 378: 2475–2485.
- [17] Busse WW. Biological treatments for severe asthma: A major advance in asthma care. Allergol Int 2019; 26: 158–166.
- [18] Souhrn údajů o přípravku Dupixent. Dostupné na: http://www.sukl.cz/modules/medication/detail.php?code=0222560&tab=texts
- [19] Castro M, Corren J, Pavord ID, et al. Dupilumab efficacy and safety in moderate‑to‑severe uncontrolled asthma. N Engl J Med 2018; 378: 2486–2496.