Emicizumab v léčbě hemofilie A − co zaznělo na ISTH 2019
Souhrn:
Hrdličková R. Emicizumab v léčbě hemofilie A − co zaznělo na ISTH 2019. Remedia 2019; 29: 544–548.
Hemofilie je vrozené onemocnění způsobující častá, opakovaná a bolestivá krvácení, zejména do kloubů a svalů, která vedou k trvalému poškození pohybového aparátu. Aktualizovaná sdružená data ze studií HAVEN 1−4 prezentovaná na kongresu International Society on Thrombosis and Haemostasis (ISTH) 2019 ukázala, že v průběhu léčby emicizumabem nedošlo u vysokého podílu (70,8 %) pacientů s hemofilií A s inhibitorem FVIII i bez něj k žádnému léčenému krvácení a u 84,1 % pacientů nebylo zaznamenáno žádné léčené kloubní krvácení. S prodlužující se dobou léčby se podíl takovýchto pacientů dále zvyšoval. Výsledky z první prozatímní analýzy studie STASEY potvrdily bezpečnost a snášenlivost emicizumabu při dlouhodobém podávání. Nebyly detekovány žádné nové bezpečnostní signály a žádné tromboembolické příhody.
Summary:
Hrdlickova R. Emicizumab in the treatment of haemophilia A – what was presented at ISTH 2019. Remedia 2019; 29: 544–548.
Haemophilia is a congenital disorder causing frequently repeated and painful bleeding, especially in the joints and muscles, leading to permanent damage to the musculoskeletal system. Updated data from the pooled HAVEN 1‑4 studies presented at ISTH 2019 Congress showed that during treatment period with emicizumab, a high proportion of 70.8% patients with haemophilia A with and without FVIII inhibitors experienced zero treated bleeds and 84.1% patients experienced zero treated joint bleeds and the proportion further increased with treatment duration. The results of the first interim analysis of STASEY study confirmed the safety and tolerance of emicizumab for long‑term administration. No new safety signals and no thromboembolic events were detected.
Key words: haemophilia A, emicizumab, bleeding, thromboembolic events.
Vrozené krvácivé onemocnění hemofilie A je způsobeno nedostatkem koagulačního faktoru VIII (FVIII) či poruchou jeho funkce. Pacienti s těžkou a středně těžkou formou hemofilie trpí bolestivým a opakovaným krvácením do kloubů a svalů často s trvalými následky a čelí i riziku život ohrožujícího vnitřního krvácení. Trendem posledních desetiletí je předcházet těmto krvácením profylaktickou léčbou. Do nedávné doby byla profylaxe možná pouze prostřednictvím intravenózního (i.v.) podání FVIII obvykle 2−3× týdně, což na jedné straně zabrání rychlé invalidizaci pacienta, na straně druhé mnohdy tento režim naráží na neochotu nemocného k časté i.v. aplikaci či na problematické zajištění periferního žilního přístupu. Velkou komplikací této léčby je vznik inhibitoru FVIII (aloprotilátky proti FVIII) u 20−30 % pacientů s těžkou formou onemocnění, který vede k neúčinnosti konvenčních přípravků s FVIII a k následným významným vzestupům morbidity i mortality pacientů i přes intenzivní léčbu tzv. bypassovými přípravky [1].
Zcela nový přístup k léčbě hemofilie A nejen ve způsobu a frekvenci aplikace, ale i v samotné filozofii léčby přinesl emicizumab, humanizovaná bispecifická monoklonální protilátka (IgG4) nahrazující funkci chybějícího aktivovaného FVIII a obnovující tak hemostázu u pacientů s hemofilií A včetně pacientů s inhibitorem. Emicizumab je určen k profylaktické léčbě krvácení, aplikace je pro pacienty výrazně jednodušší (subkutánní podání) a po úvodní nasycovací fázi (dávkování 1× týdně první 4 týdny) může být v podávání pokračováno v intervalu 1× týdně, 1× za 14 dní nebo 1× za měsíc.
Aktualizovaná data ze studií HAVEN 1−4
Sledování dlouhodobé účinnosti a bezpečnosti emicizumabu a vliv na kvalitu života u pacientů s hemofilií A s inhibitorem FVIII i bez inhibitoru bylo cílem klinických studií HAVEN 1−4, jejichž sdružená analýza z dlouhodobého hlediska byla prezentována na kongresu International Society on Thrombosis and Haemostasis (ISTH) 6.−10. července 2019. Studie HAVEN 1 byla věnována pacientům ve věku 12 let a starším s hemofilií A s inhibitorem; HAVEN 2 dětem ve věku do 12 let s hemofilií A s inhibitorem, které byly léčeny emicizumabem 1× týdně, 1× za 2 týdny, 1× za měsíc; studie HAVEN 3 zahrnula dospělé a adolescenty starší 12 let s těžkou hemofilií bez inhibitoru léčené emicizumabem 1× za týden nebo 1× za 14 dní; HAVEN 4 se zaměřila na dospělé a adolescenty ve věku od 12 let s hemofilií A s inhibitorem/bez inhibitoru s emicizumabem aplikovaným v režimu 1× za měsíc [2−5].
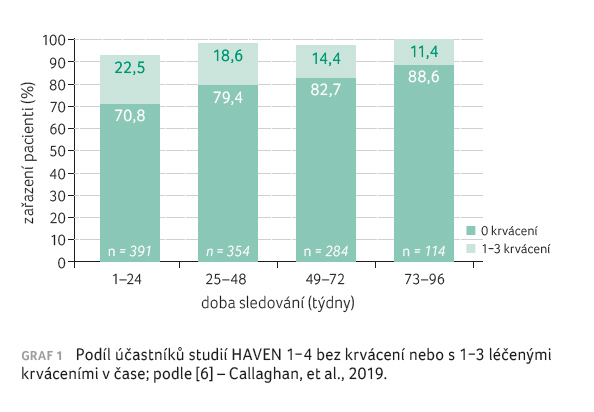 V klinických studiích HAVEN 1−4
bylo hodnoceno celkem 400 účastníků ve věkovém
mediánu 28,5 roku (rozmezí 1−77 let) léčených
emicizumabem po dobu 83,1 (68,1−100,9) týdne. Aktualizovaná
data ukázala, že velká část pacientů, kterým byl emicizumab
podáván profylakticky, neměla žádné krvácení vyžadující
léčbu (70,8 % v prvních 24 týdnech) a jejich podíl
se dále zvyšoval s dobou trvání léčby (88,6 %
v posledním hodnoceném intervalu, tj. v 73.−96. týdnu),
viz graf 1, přičemž
snášenlivost a bezpečnost léčby zůstaly stejné. Podobný
stoupající trend ve stejných časových periodách lze
vysledovat u pacientů bez všech spontánních
(neprovokovaných) krvácení (84,1 % a 96,5 %), viz graf 2 [6]. U více než 87 % všech účastníků
klinického programu HAVEN nebylo zaznamenáno krvácení do kloubů
(spontánní či provokované úrazem) vyžadující léčbu.
Vyhodnocení farmakokinetických údajů, jednoho ze sekundárních
cílových ukazatelů studií, potvrdilo stejné dávkování
emicizumabu pro všechny věkové kategorie bez ohledu na přítomnost
či nepřítomnost inhibitoru.
V klinických studiích HAVEN 1−4
bylo hodnoceno celkem 400 účastníků ve věkovém
mediánu 28,5 roku (rozmezí 1−77 let) léčených
emicizumabem po dobu 83,1 (68,1−100,9) týdne. Aktualizovaná
data ukázala, že velká část pacientů, kterým byl emicizumab
podáván profylakticky, neměla žádné krvácení vyžadující
léčbu (70,8 % v prvních 24 týdnech) a jejich podíl
se dále zvyšoval s dobou trvání léčby (88,6 %
v posledním hodnoceném intervalu, tj. v 73.−96. týdnu),
viz graf 1, přičemž
snášenlivost a bezpečnost léčby zůstaly stejné. Podobný
stoupající trend ve stejných časových periodách lze
vysledovat u pacientů bez všech spontánních
(neprovokovaných) krvácení (84,1 % a 96,5 %), viz graf 2 [6]. U více než 87 % všech účastníků
klinického programu HAVEN nebylo zaznamenáno krvácení do kloubů
(spontánní či provokované úrazem) vyžadující léčbu.
Vyhodnocení farmakokinetických údajů, jednoho ze sekundárních
cílových ukazatelů studií, potvrdilo stejné dávkování
emicizumabu pro všechny věkové kategorie bez ohledu na přítomnost
či nepřítomnost inhibitoru.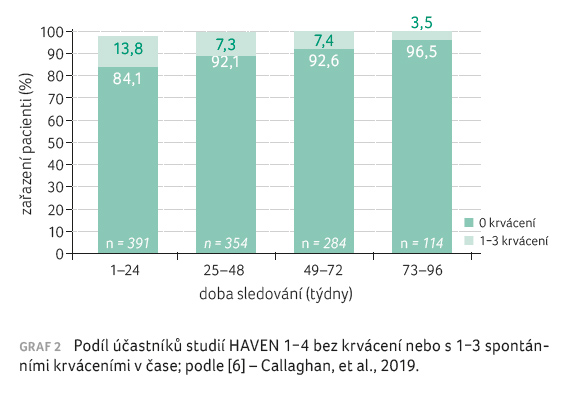
Retrospektivní analýza souhrnných dat získaných ze studií HAVEN 1−4 dále demonstrovala, že pokud je osoba s hemofilií s inhibitorem/bez inhibitoru léčená profylakticky emicizumabem indikována k malému chirurgickému výkonu, může se v některých případech obejít bez přidané substituční léčby bypassovými přípravky nebo FVIII. Během léčby ve studiích bylo provedeno celkem 215 malých chirurgických výkonů, většinu z nich − 141 (65,6 %) – představovaly zákroky bez substituce bypassovými přípravky nebo FVIII, z nichž 128 (90,8 %) nevyžadovalo v pooperačním období dodatečnou léčbu pooperačního krvácení [7].
Studie STASEY
Primárním cílem multicentrické otevřené studie fáze IIIb STASEY bylo hodnocení bezpečnosti a snášenlivosti dlouhodobé profylaktické léčby emicizumabem u osob ve věku od 12 let s hemofilií A s inhibitorem FVIII v režimu aplikace 1,5 mg/kg/týden (po zvyklé úvodní nasycovací fázi) s předpokládanou dobou léčby ve studii dva roky. Sledovány byly výskyt a závažnost nežádoucích účinků léčby, zejména pak tromboembolických příhod, trombotických mikroangiopatií, systémové hypersenzitivity, anafylaxe či anafylaktoidních komplikací. Sekundární cílové ukazatele byly zaměřeny na hodnocení účinnosti profylaktické léčby emicizumabem − počet krvácení v čase, dopad na kvalitu života ve vztahu ke zdraví a preference léčby pacientem v porovnání s předchozí léčbou. Na ISTH 2019 byla prezentována plánovaná průběžná analýza dat (s uzávěrkou sběru dat k 15. 10. 2018).
Hodnoceno bylo 88 účastníků: 85
hemofiliků v době uzávěrky dat dokončilo nejméně 24 týdnů
ve studii, tři účastníci předčasně odstoupili − jeden
z rozhodnutí lékaře, druhý na vlastní žádost,
příčinou nedokončení studie u třetího pacienta bylo
úmrtí bez vztahu k emicizumabu (polytrauma s úrazem
hlavy). Během sledování ve studii STASEY nebyla hlášena
žádná trombotická mikroangiopatie ani jiná tromboembolická
komplikace. Nežádoucí účinky související s léčbou
emicizumabem udávalo 18 pacientů (20,5 %), ale pouze jeden
nežádoucí účinek byl označen za závažný − absces
v místě katétru. Nejčastěji se jednalo o reakce
v místě aplikace (14,8 %), bolesti kloubů (13,6 %),
bolesti hlavy (11,4 %), nazofaryngitidu (11,4 %). Spontánní
nebo traumatem vyvolané krvácení s nutností léčby se
vyskytlo u 17 (19,3 %) pacientů, 16 z nich bylo léčeno
rFVIIa (rekombinantní aktivovaný FVII), jednomu byl aplikován
standardní FVIII. Celkem 71 (80,7 %) pacientů v průběhu
studie nemělo žádné léčené krvácení a 81 (92 %)
pacientů neprodělalo krvácení do kloubů vyžadující léčbu
(graf 3). Klinicky
významné zlepšení kvality života ve vztahu ke zdraví
bylo pozorováno u domén tělesné zdraví a celkové
skóre. Většina účastníků (95,0 %) dávala přednost
emicizumabu před předchozí léčbou [8].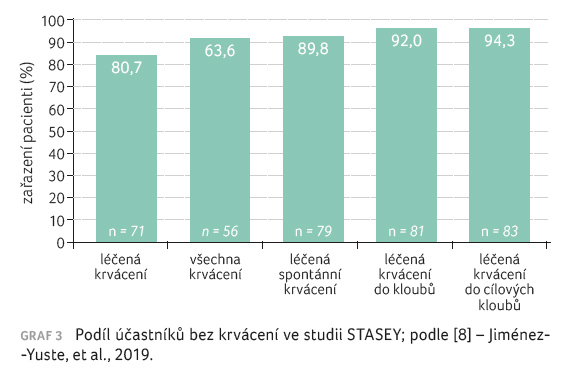
Závěr
Zpětná analýza souhrnných dat ze studií HAVEN 1−4 a průběžné výsledky studie STASEY potvrdily předchozí zprávy o účinnosti, bezpečnosti a snášenlivosti emicizumabu. Nebyly identifikovány žádné nové bezpečnostní signály. Míra krvácení u pacientů s hemofilií A s inhibitorem FVIII léčených profylakticky emicizumabem ve studii STASEY byla v souladu s předchozími pozorováními u pacientů s inhibitorem FVIII ve studiích HAVEN 1 a HAVEN 2 [2,3].
Seznam použité literatury
- [1] Franchini M, Mannucci PM. Inhibitors of propagation of coagulation (factors VIII, IX and XI): a review of current therapeutic practice. Br J Clin Pharmacol 2011; 72: 553–562.
- [2] Oldenburg J, Mahlangu JN, Kim B, et al. Emicizumab prophylaxis in hemophilia A with inhibitors. N Engl J Med 2017; 377: 809–818.
- [3] Young G, Liesner R, Yung‑Chin Chang T, et al. A multicenter, open‑label, phase 3 study of emicizumab prophylaxis in children with hemophilia A with inhibitors. Blood 2019; doi: https://doi.org/10.1182/blood.2019001869
- [4] Mahlangu J, Oldenburg J, Paz‑Priel I, et al. Emicizumab Prophylaxis in Patient Who Have Hemophilia A without Inhibitors. N Engl J Med 2018; 379: 811–822.
- [5] Pipe SW, Shima M, Lehle M, et al. Efficacy, safety, and pharmacokinetics of emicizumab prophylaxis given every 4 weeks in people with haemophilia A (HAVEN 4): a multicentre, open‑label, non‑randomised phase 3 study. Lancet Haematol 2019; 6: e295−e305.
- [6] Callaghan M, Negrier C, Paz‑Priel I, et al. Emicizumab Treatment is Efficacious and Well Tolerated Long Term in Persons with Haemophilia A (PwHA) with or without FVIII Inhibitors: Pooled Data from Four HAVEN Studies. ISTH 2019 oral presentation OC 60.2.
- [7] Santagostino E, Oldenburg J, Chang T, et al. Surgical Experience from Four Phase III Studies (HAVEN 1‑4) of Emicizumab in Persons with Haemophilia A (PwHA) With or Without FVIII Inhibitors. ISTH 2019, oral presentation OC 60.1.
- [8] Jiménez‑Yuste V, Klamroth R, Castaman G, et al. A Single‑arm, Multicentre, Open‑Label, Phase III Clinical Trial to Evaluate the Safety and Tolerability of Prophylactic Emicizumab in Persons with Haemophilia A (PwHA) with FVIII Inhibitors (STASEY): Interim Analysis Results. ISTH 2019, oral presentation OC 60.3.