Enerzair Breezhaler – první léčivý přípravek ve fixní inhalační trojkombinaci k léčbě astmatu
Souhrn:
Krčmová I, Novosad J. Enerzair Breezhaler – první léčivý přípravek ve fixní inhalační trojkombinaci k léčbě astmatu. Remedia 2020; 30: 479–484.
Recentně, v červenci 2020, byl Evropskou lékovou agenturou schválen k léčbě astmatu vůbec první léčivý přípravek obsahující fixní trojkombinaci v inhalačním systému. Přípravek registrovaný pod názvem Enerzair Breezhaler obsahuje fixní kombinaci dávek tří léčivých látek (indakaterol/glykopyrronium/mometason furoát) v lékové formě tobolek, které se podávají pomocí inhalátoru. Enerzair Breezhaler je indikován k udržovací léčbě astmatu u dospělých pacientů, kteří nejsou adekvátně kontrolováni udržovací léčebnou kombinací dlouhodobě působícího β2 agonisty a vysokou dávkou inhalačního kortikosteroidu a prodělali jednu nebo více exacerbací astmatu v předchozím roce. Přípravek je určen pro léčbu těžších astmatiků. Inhalace jednou denně může mít pozitivní vliv na adherenci pacientů k léčbě. Kombinace molekul léčivých látek v přípravku se dle současných studií jeví jako slibný přístup v léčebném portfoliu astmatika.
Summary:
Krcmova I, Novosad J. Enerzair Breezhaler – first medicinal product with fixed‑dose inhalation three‑drug combination for asthma treatment. Remedia 2020; 30: 479–484.
Recently, in July 2020, European Medicines Agency approved the first medicinal product containing fixed‑dose three‑drug combination in the inhalation system for asthma treatment. The product registered under the name of Enerzair Breezhaler contains fixed‑dose combination of three medicinal substances (indacaterol/glycopyrronium/mometasone furoate) in the drug form of hard capsules administered with an inhaler. Enerzair Breezhaler is indicated for maintenance therapy of asthma in adult patients not adequately controlled with maintenance medicinal combination of long‑acting β2 agonist and high dose of inhalation corticosteroid and with one or more asthma exacerbations in the previous year. The product is intended for severe asthma. Once‑daily inhalation can have positive impact on patient adherence to treatment. Combination of medicinal substances in the product offers a promising approach in the treatment portfolio of asthma according to current studies.
Key words: bronchial asthma, inhalation treatment, fixed‑dose three‑drug combination , Enerzair Breezhaler
Bronchiální astma představuje
heterogenní onemocnění dýchacích cest. Jeho patogenetickou
podstatou je chronický zánět průdušek spojený s jejich
remodelací a bronchiální hyperreaktivitou a variabilní,
často reverzibilní obstrukcí. Astma je považováno
za nevyléčitelné, ale díky potenciálu léčebných možností
dobře léčitelné onemocnění. Cílem terapeutického úsilí je
nejen odstranění symptomů a exacerbací, ale i omezení
rozvoje zánětu, bronchiální hyperreaktivity, a zejména
nevratných remodelačních změn. Současně je potřeba trvale
usilovat i o minimalizaci nutné farmakoterapie (riziko
systémových nežádoucích účinků vysokých dávek
kortikosteroidů) [1]. V České republice se počet astmatiků
odhaduje až na 800 000, z toho 5 % pacientů trpí
těžkou formou perzistujícího astmatu.
Základní terapeutickou snahou je dosažení kontroly nad astmatem. Lékař posuzuje tíži astmatu, která je odvozena od minimálního stupně farmakoterapie potřebné k dosažení plné kontroly. Tíže astmatu se v průběhu života astmatika může měnit a s ohledem na narůstající možnosti specifické léčby je zásadní určovat základní fenotyp astmatu, který vychází z alergologického vyšetření a přítomnosti eozinofilie. Pokud propojíme tyto jednoduché parametry s klinickým hodnocením (doba vzniku astmatu, přítomnost alergického terénu), můžeme eozinofilní astma rozdělit na dva základní fenotypy − eozinofilní alergické astma a eozinofilní astma nealergické (type 2 high asthma). Třetí fenotyp – non eozinofilní nealergické astma (type 2 low asthma) – bývá spojen s nadváhou, s dalšími komorbiditami a s ženským pohlavím. Tito astmatici netrpí eozinofilií ani významnými alergiemi, je přítomna bronchiální hyperreaktivita a typické příznaky astmatu se začátkem převážně v dospělosti [2,3].
Cílem léčebné strategie je dosažení a udržení plné kontroly nad astmatem a omezení budoucích rizik s ireverzibilním poklesem funkce plic. Součástí léčebného přístupu je zabránění nežádoucím účinkům farmakoterapie. Preferována je inhalační farmakoterapie směřující k potlačení zánětu a bronchiální hyperreaktivity. Základem farmakoterapie jsou kontrolující/preventivní antiastmatika, mezi nimiž hrají dominantní roli inhalační kortikosteroidy (IKS). Včasné zahájení léčby IKS snižuje riziko ireverzibilních změn. Přidání inhalačních β2 adrenoreceptorových agonistů s dlouhodobým, ev. ultradlouhodobým účinkem (LABA, U LABA) k nízkým a středně vysokým dávkám IKS ve většině případů zlepšuje kontrolu účinněji než navyšování dávek IKS (synergický účinek).
Jako přídatnou bronchodilatační léčbu lze u dospělých pacientů nedostatečně kontrolovaných kombinací středně vysokých a vysokých dávek IKS/(U) LABA použít i ultradlouhodobě působící antagonisty muskarinových receptorů (U LAMA − tiotropium, glykopyrronium). Inhalační β2 agonisté s dlouhodobým účinkem nejsou určeni k samostatnému užívání − ani jako úlevové, ani jako tzv. symptom kontrolující léky; LABA se podávají výhradně v rámci kombinované léčby s IKS, nejlépe ve formě fixních kombinací. Přídatný protizánětlivý efekt vykazují vedle LABA v menší míře rovněž nízké dávky teofylinů a v dnešní době stále diskutované antileukotrieny. Překryv astmatu a chronické obstrukční plicní nemoci (CHOPN), tzv. ACO, asthma COPD overlap, je logicky řešen prolnutím farmakoterapie astmatu a CHOPN, tj. vedle kombinace IKS s LABA i kombinace s LAMA, U LAMA.
Každý pacient by měl být vybaven úlevovým/záchranným lékem a zároveň dobře seznámen s omezenou rolí a riziky této léčby; jako úlevový lék se nejčastěji užívají inhalační β2 agonisté s rychlým nástupem účinku (RABA), pokud je pacient léčen LABA či U LABA. Zvláštní postavení zaujímá fixní kombinace IKS s LABA s rychlým nástupem účinku (formoterol), která je doporučena v léčbě jak úlevové již od prvního stupně astmatu, tak dlouhodobě udržovací (tzv. režimu /S/MART – Single Inhaler/Maintenance and Reliever Therapy) [1,4,5].
První fixní inhalační trojkombinace
k léčbě astmatu
Astma je díky kombinaci léčebných molekul dobře léčitelným onemocněním. Za předpokladu stanovení správné diagnózy (zahrnující určení fenotypu a tíže/kontroly) lze při adekvátní a řádně užívané léčbě dosáhnout jeho kontroly u zhruba 95 % případů [6]. Evropská léková agentura (EMA) v červenci 2020 schválila a registrovala pod názvem Enerzair Breezhaler první přípravek k léčbě astmatu obsahující fixní trojkombinaci účinných látek v inhalačním systému.
Enerzair Breezhaler se skládá z fixní kombinace dávek tří léčivých látek (indakaterol/glykopyrronium/mometason furoát) v tobolkách, které se podávají pomocí inhalátoru. Použité lékové skupiny představují kombinaci U LABA/U LAMA/IKS [7].
Dle doporučení je Enerzair Breezhaler indikován jako udržovací léčba astmatu u dospělých pacientů, kteří nejsou adekvátně kontrolováni udržovací léčebnou kombinací LABA a vysokou dávkou IKS a prodělali jednu nebo více exacerbací astmatu v předchozím roce. Přípravek je zařazen do farmakoterapeutické skupiny Léčiva k terapii onemocnění spojených s obstrukcí dýchacích cest, adrenergika v kombinaci s anticholinergiky, včetně trojité kombinace s kortikosteroidy (ATC kód: R03AL12). V České republice má přípravek v současné době preskripční omezení vázané na specializaci pneumolog a alergolog/imunolog.
Prášek k inhalaci je uložen v tvrdé tobolce. Jedna tobolka obsahuje indakaterol 150 µg (jako indacateroli acetas), glycopyrronii bromidum 63 µg, odpovídající glykopyrroniu 50 µg, a mometasoni furoas 160 µg. Jedna terapeutická inhalační dávka je pochopitelně nižší − obsahuje indacaterolum 114 µg, glycopyrronii bromidum 58 µg (odpovídající glykopyrroniu v dávce 46 µg) a mometasoni furoas 136 µg. Jako pomocná látka v tobolce je užita laktóza v dávce 25 mg.
Doporučenou dávkou je inhalace jedné tobolky jednou denně, jedná se o maximální denní dávku. Léčbu je vhodné podávat každý den ve stejnou dobu, volba denní doby je ponechána na pacientovi. Pokud dojde k vynechání dávky, další dávka by měla být použita co nejdříve. Tento léčivý přípravek se nemá používat k léčbě akutních příznaků astmatu, pro které je potřeba inhalovat krátkodobě působící bronchodilatační RABA (SABA).
U starších pacientů (65 let nebo starší) není třeba upravovat dávku, stejně tak u pacientů trpících lehkou až středně těžkou poruchou funkce ledvin či postižením jater. Bezpečnost a účinnost přípravku Enerzair Breezhaler u pediatrických pacientů ve věku do 18 let nebyla dosud stanovena, v této fázi nejsou zatím dostupné údaje.
Stejně tak chybějí dostatečné informace o aplikaci kombinovaného přípravku Enerzair Breezhaler nebo jeho individuálních složek (indakaterolu, glykopyrronia a mometason furoátu) u těhotných žen. Podobně jako ostatní léčivé přípravky obsahující β2 adrenergní agonisty může indakaterol inhibovat porod v důsledku relaxačního účinku na hladké svalstvo dělohy. Tento léčivý přípravek může být použit během těhotenství pouze tehdy, pokud očekávaný přínos pro pacientku ospravedlňuje potenciální riziko pro plod.
Co se týče kojení, není k dispozici žádná informace o možné přítomnosti indakaterolu, glykopyrronia nebo mometason furoátu v lidském mateřském mléce z hlediska účinku na kojené dítě či účinku na tvorbu mléka. Obecně IKS přestupují do mateřského mléka. Indakaterol, glykopyrronium a mometason furoát byly detekovány v mléce kojících potkanů. Na základě posouzení prospěšnosti kojení pro dítě a prospěšnosti léčby pro matku je nutno rozhodnout, zda přerušit kojení, nebo ukončit/přerušit léčbu.
Reprodukční studie u zvířat nenaznačují ovlivnění fertility u mužského ani ženského pohlaví.
Jedinou zásadní kontraindikací podání kombinovaného inhalačního přípravku je hypersenzitivita na léčivé látky nebo na kteroukoliv pomocnou látku [7].
Technika inhalace
Balení přípravku Enerzair Breezhaler s inhalátorem obsahuje:
- jeden inhalátor Enerzair Breezhaler,
- jednu nebo více karet blistru, každá obsahuje 10 tobolek přípravku Enerzair Breezhaler k použití v inhalátoru.
K bázi inhalačního systému
může být připojen volitelný elektronický digitální senzor,
který shromažďuje údaje o inhalacích pacienta a odesílá
je do aplikace na chytrém telefonu nebo jiném vhodném
zařízení. Senzor a aplikace nejsou nezbytné pro inhalaci,
předepisující lékař může prodiskutovat s pacientem, zda
použití senzoru je pro něj motivačním přínosem z hlediska
adherence k léčbě.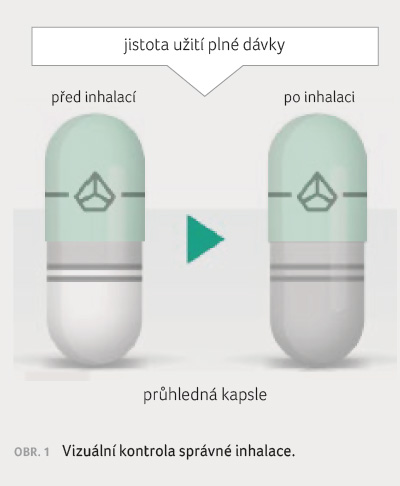
Tobolky musejí být podány pouze s použitím inhalátoru, který je součástí každého nového předepsaného balení léku. Tak jako u jiných inhalačních léků je astmatika nezbytné poučit, jak léčivý přípravek správně používat. Tobolka musí být vyjmuta z blistru bezprostředně před použitím, vložena do inhalátoru a propíchnuta jedním pevným stiskem obou postranních tlačítek. Inhalace musí být rychlá a hluboká, během inhalace je slyšitelný chrčivý zvuk. Po inhalaci je vhodné se ujistit, zda je tobolka prázdná, vypláchnout ústa vodou a nepolykat ji. Je výhodou, že tobolka je transparentní (obr. 1), dá se říci, že pacient cítí, slyší i vidí, že inhaloval plnou dávku.
Tobolky jsou určeny pouze k inhalačnímu podání, nikoliv k perorálnímu užití. Z hlediska compliance pacienta (ač se nám lékařům to může zdát méně uvěřitelné) je třeba se astmatika, který nepozoruje efekt léčby, zeptat, zda léčivý přípravek namísto inhalace nepolyká [7].
Farmakodynamické
vlastnosti – mechanismus účinku
Enerzair Breezhaler je kombinací indakaterolu (U LABA), glykopyrronia (U LAMA) a mometason furoátu (IKS).
Indakaterol
Farmakologické účinky β2 adrenoreceptorových agonistů, včetně indakaterolu, jsou přičitatelné zvýšeným hodnotám cyklického 3’,5’ adenosinmonofosfátu (cyklický AMP), který způsobuje relaxaci bronchiální hladké svaloviny. Při inhalaci působí indakaterol lokálně v plicích jako bronchodilatátor, je schopen účinkovat v nanomolárním množství a má rychlý nástup a dlouhé trvání účinku.
β2 adrenergní receptory jsou predominantní v bronchiální hladké svalovině a β1 adrenergní receptory v lidském srdci. β2 adrenergní receptory se rovněž vyskytují v lidském srdci a představují 10−50 % celkového množství adrenergních receptorů. Podobně jako jiné léčivé přípravky obsahující β2 adrenergní agonisty může tento léčivý přípravek vyvolat u některých pacientů kardiovaskulární účinky, měřitelné jako zrychlený pulz, zvýšený krevní tlak a/nebo jiné příznaky. Obecně je udáváno, že je nutná opatrnost u pacientů s kardiovaskulárními poruchami.
Ze studií s kombinovaným přípravkem Enerzair Breezhaler byli vyřazeni astmatici s nestabilní ischemickou chorobou srdeční, anamnézou infarktu myokardu v posledních 12 měsících, levostranným srdečním selháním stupně III/IV podle klasifikace New York Heart Association (NYHA), arytmií, nekontrolovanou hypertenzí, cerebrovaskulárním onemocněním nebo trpící syndromem prodlouženého intervalu QT v anamnéze a pacienti léčení přípravky, o nichž je známo, že prodlužují interval QT.
Obecně je u β2 adrenergních agonistů dokumentováno, že způsobují elektrokardiografické změny, jako jsou oploštění vlny T, prodloužení intervalu QT a deprese úseku ST. Je však důležité uvést, že klinický význam těchto pozorování není přesně znám. Dlouhodobě působící β2 adrenergní agonisté nebo kombinované přípravky obsahující LABA, jako např. Enerzair Breezhaler, by proto měly být používány s opatrností u pacientů se známým nebo suspektním prodloužením intervalu QT nebo u těch, kteří jsou současně léčeni léčivými přípravky ovlivňujícími interval QT.
Glykopyrronium
Glykopyrronium je selektivní antagonista muskarinových receptorů s vysokou afinitou, blokuje bronchokonstrikční působení acetylcholinu na hladké svalové buňky v dýchacích cestách, čímž dýchací cesty dilatuje. Muskarinové acetylcholinové receptory vytvářejí komplexy receptorů spřažených s G proteinem v buněčných membránách některých neuronů a dalších buněk. Tyto receptory působí jako hlavní konečný receptor stimulovaný acetylcholinem uvolněným z postgangliových vláken v parasympatiku.
U lidí byly v plicích identifikovány tři subtypy muskarinových receptorů (M1, M2 a M3) s odlišnými fyziologickými funkcemi. Muskarinové receptory M1, které jsou lokalizovány v parasympatických gangliích, usnadňují neurotransmisi acetylcholinu. Muskarinové receptory M2, které byly nalezeny v myokardu a v hladkých svalech, působí negativní zpětnou vazbou na uvolňování acetylcholinu. Jejich aktivace tlumí uvolňování acetylcholinu, jejich blokáda způsobuje zvýšení produkce acetylcholinu v dýchacích cestách, což má za následek pěti až osminásobné zvýšení bronchokonstrikce navozené vagem. Muskarinový receptor M3 se zejména podílí na kontrakci hladkého svalstva, bronchokonstrikci a zvýšené tvorbě hlenu v plicích. Blokádou tohoto výkonného receptoru dojde ke snížení vagového tonu v dýchacích cestách. V lidských průduškách byl ještě identifikován muskarinový receptor M4, jeho funkce není přesně známa.
Ideální anticholinergikum by mělo selektivně antagonizovat činnost receptoru M1 a M3 a současně mít minimální afinitu k receptoru M2. Ve studiích vazebné kompetice prokázala molekula glykopyrronia čtyř až pětinásobnou selektivitu pro muskarinové receptory M3 a M1 oproti receptoru M2.
Glykopyrronium má rychlý nástup účinku, což bylo dokladováno kinetickými parametry receptorové asociace/disociace a nástupem účinku po inhalaci v klinických studiích. Dlouhé trvání účinku může být zčásti přisuzováno trvalým lékovým koncentracím v plicích, což bylo prokázáno prodlouženým terminálním poločasem vylučování glykopyrronia po inhalaci inhalátorem na rozdíl od eliminačního poločasu po intravenózním podání.
Glykopyrronium (podobně jako jiná anticholinergika) by mělo být používáno s opatrností u pacientů trpících glaukomem s uzavřeným úhlem nebo urinární retencí (s hyperplazií prostaty a s obstrukcí hrdla močového měchýře). Pacienti by měli být poučeni o známkách a příznacích akutního glaukomu s uzavřeným úhlem a o včasném přerušení léčby a nezbytnosti kontaktovat lékaře.
Mometason furoát
Mometason furoát je syntetický kortikosteroid s vysokou afinitou pro glukokortikoidní receptory a s lokálními protizánětlivými vlastnostmi. Mometason furoát in vitro inhibuje uvolnění leukotrienů z leukocytů u alergických pacientů; v buněčné kultuře prokázal vysokou účinnost v inhibici syntézy a uvolnění interleukinů (IL) 1, 5 a 6 a tumor nekrotizujícího faktoru alfa (TNFα). Je to také silný inhibitor produkce leukotrienů a produkce Th2 cytokinů IL 4 a IL 5 z lidských CD4+ T buněk. Farmakodynamické účinky byly prokázány in vitro. Bylo zjištěno, že mometason furoát má přibližně 12krát vyšší vazebnou afinitu k lidským glukokortikoidním receptorům než dexametazon, 7krát vyšší než triamcinolon acetonid, 5krát vyšší než budesonid a 1,5krát vyšší než flutikason.
Při užití IKS je vždy důležitá titrace na co nejnižší dávku, při jejímž podávání je zachována účinná kontrola astmatu. Systémové účinky se mohou objevit u jakéhokoliv IKS dle senzitivity pacienta, zejména při podávání vysokých dávek předepisovaných dlouhodobě. Možné systémové účinky zahrnují Cushingův syndrom, cushingoidní rysy, adrenální supresi, snížení minerální kostní denzity, růstovou retardaci u dětí a dospívajících, kataraktu a glaukom a vzácněji různé psychologické nebo behaviorální účinky, včetně psychomotorické hyperaktivity, poruch spánku, úzkosti, deprese.
V souvislosti s molekulou mometason furoátu nepřinesly klinické studie žádné důkazy o supresi osy hypotalamus hypofýza nadledviny po dlouhodobé inhalační léčbě dávkami ≤ 800 µg denně, hodnoceno dle plazmatických koncentrací kortizolu nebo abnormálních odpovědí na kosyntropin. V léčivém přípravku Enerzair Breezhaler je při aplikaci uvolněno pouze 136 µg mometason furoátu. Vzhledem k tomu, že je po inhalačním podání dosaženo nízkých plazmatických koncentrací, jsou klinicky významné lékové interakce nepravděpodobné. Nicméně při současném podávání se silně účinnými inhibitory CYP3A4 (např. ketokonazol, itrakonazol, nelfinavir, ritonavir, kobicistat) může potenciálně dojít ke zvýšení systémové expozice mometason furoátu.
Při inhalačním použití kortikosteroidů může být hlášena porucha zraku. I když se mometason furoát při podávání v doporučených dávkách vyznačuje nízkou systémovou biologickou dostupností, mělo by být u pacientů s nově vzniklými očními příznaky, jako např. rozmazané vidění nebo jiné poruchy zraku, zváženo doporučení k očnímu lékaři.
Stejně jako jiné IKS, i tento léčivý přípravek je třeba podávat s opatrností u pacientů s plicní tuberkulózou nebo u pacientů s chronickými nebo neléčenými infekcemi [7−9].
Klinická účinnost a bezpečnost –
registrační studie
Klinická účinnost a bezpečnost přípravku byla dokladována ve studii IRIDIUM. Jednalo se o 52týdenní sledování hodnotící Enerzair Breezhaler u dospělých pacientů s perzistujícím astmatem v randomizované, dvojitě zaslepené studii fáze III. Pacienti byli rozděleni do skupin podle inhalované dávky, která obsahovala trojkombinaci indakaterol, glykopyrronium bromid a mometason furoát (obsah léků v uvedeném pořadí) 114 µg/46 µg/68 µg jednou denně (n = 620) a 114 µg/46 µg/136 µg jednou denně (n = 619). Srovnání probíhalo se skupinami léčenými dvojkombinací indakaterol/mometason furoát 125 µg/127,5 µg jednou denně (n = 617) a 125 µg/260 µg jednou denně (n = 618). Třetí aktivní kontrolní rameno zahrnovalo pacienty léčené dvojkombinací salmeterol/flutikason propionát 50 µg/500 µg dvakrát denně (n = 618).
U všech pacientů bylo
požadováno, aby měli příznaky astmatu (ACQ 7 skóre ≥ 1,5)
a dostávali udržovací terapii astmatu s užíváním
kombinované terapie středními nebo vysokými dávkami IKS a LABA
po dobu alespoň tří měsíců před vstupem
do studie. Průměrný věk astmatiků v souboru byl
52,2 roku. Zařazeni byli pacienti s exacerbací astmatu
v anamnéze v minulém roce. Při vstupu do studie
byla převaha pacientů léčena středními dávkami IKS v kombinaci
s LABA (62,6 %); vysokými dávkami IKS v kombinaci
s LABA bylo léčeno téměř 37 % astmatiků.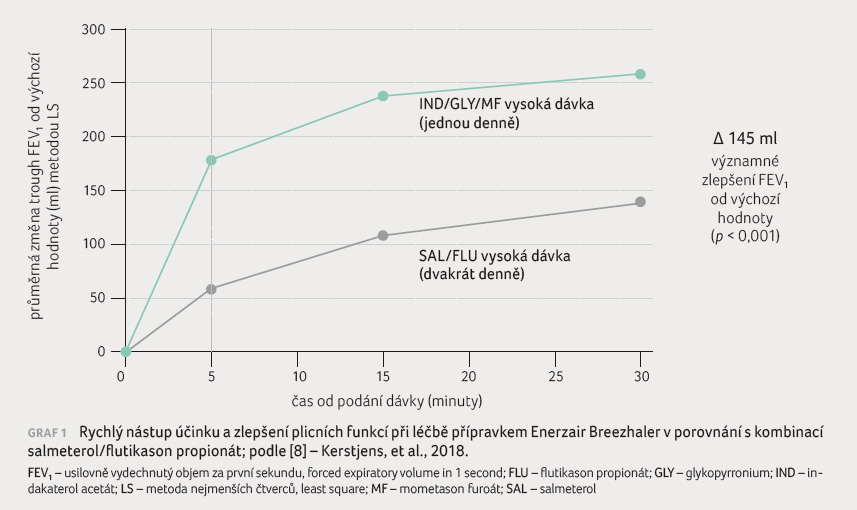
Primárním cílem studie bylo prokázat
superioritu přípravku Enerzair Breezhaler 114 µg/46 µg/68 µg
jednou denně nad přípravkem indakaterol/mometason furoát
125 µg/127,5 µg jednou denně a superioritu
přípravku Enerzair Breezhaler 114 µg/46 µg/136 µg
jednou denně nad přípravkem indakaterol/mometason furoát
125 µg/260 µg jednou denně. Hodnoticím ukazatelem byl
průběžný (trough) FEV1 (usilovně vydechnutý objem
za první sekundu, forced expiratory volume in 1 second)
v 26. týdnu.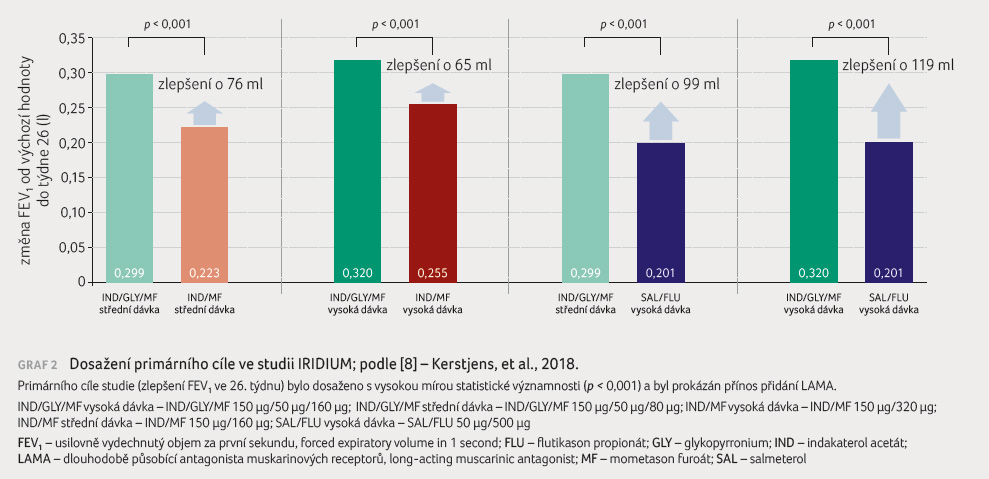
Enerzair Breezhaler 114 µg/46 µg/136 µg jednou denně prokázal statisticky významná zlepšení v trough FEV1 ve 26. týdnu v porovnání s kombinací indakaterol/mometason furoát v odpovídající dávce.
Klinicky významné zlepšení plicních funkcí (změna trough FEV1) z výchozí hodnoty v týdnu 26, ranní a večerní vrcholové výdechové rychlosti bylo také pozorováno ve větvi třetí při porovnání s kombinací salmeterol/flutikason propionát 50 µg/500 µg dvakrát denně (graf 1, 2). Je příznivé, že nálezy v 52. týdnu byly konzistentní s nálezy z 26. týdne.
Všechny léčebné skupiny vykazovaly klinicky relevantní zlepšení od výchozích hodnot v ACQ 7 v 26. týdnu a v tomto parametru nebyly pozorovány statisticky významné rozdíly mezi skupinami.
Sekundárním cílovým ukazatelem byly exacerbace. Enerzair Breezhaler 114 µg/46 µg/136 µg podávaný jednou denně prokázal snížení (o 36−42 %) ročního počtu exacerbací v porovnání s dvojkombinací salmeterol/flutikason propionát 50 µg/500 µg dvakrát denně. Vůči kombinaci indakaterol/mometason furoát 125 µg/260 µg jednou denně vykazoval Enerzair Breezhaler snížení exacerbací o 15−22 %.
Farmakodynamická odpověď u tohoto léčivého přípravku se vyznačuje rychlostí nástupu účinku (do 5 minut po podání dávky) a jeho setrvalostí po dobu 24hodinového dávkovacího intervalu. Profil farmakodynamické odpovědi byl charakterizován zvýšením průměrného vrcholu FEV1 o 172 ml po inhalaci přípravku obsahujícího fixní trojkombinaci indakaterol/glykopyrronium/mometason furoát 114 µg/46 µg/136 µg podávanou jednou denně v porovnání s dvojkombinací salmeterol/flutikason propionát 50 µg/500 µg podávanou dvakrát denně [8−10].
Souběžné podání inhalovaného indakaterolu, glykopyrronia a mometason furoátu vzájemně neovlivnilo farmakokinetiku žádné z léčivých látek při kombinovaném užití v jedné tobolce určené k inhalaci. Tachyfylaxe nebyla v průběhu studie ani při roční aplikaci pozorována. Populační farmakokinetická analýza u pacientů s astmatem neprokázala po inhalaci přípravku Enerzair Breezhaler klinicky relevantní vliv věku, pohlaví, tělesné hmotnosti ani kouření.
Nejčastějšími nežádoucími účinky v průběhu studie IRIDIUM (napříč všemi větvemi studie) byly během 52 týdnů sledování exacerbace astmatu (41,8 %), nazofaryngitida (10,9 %), infekce horních cest dýchacích (5,6 %) a bolest hlavy (4,2 %). Celkově byla léčba fixní trojkombinací dobře snášena a bezpečnostní profil byl srovnatelný napříč všemi rameny studie [7].
Závěr
Enerzair Breezhaler je vůbec prvním
léčivým přípravkem ve fixní trojkombinaci k inhalační
aplikaci v léčbě bronchiálního astmatu. Přípravek se
skládá z fixní kombinace dávek tří léčivých látek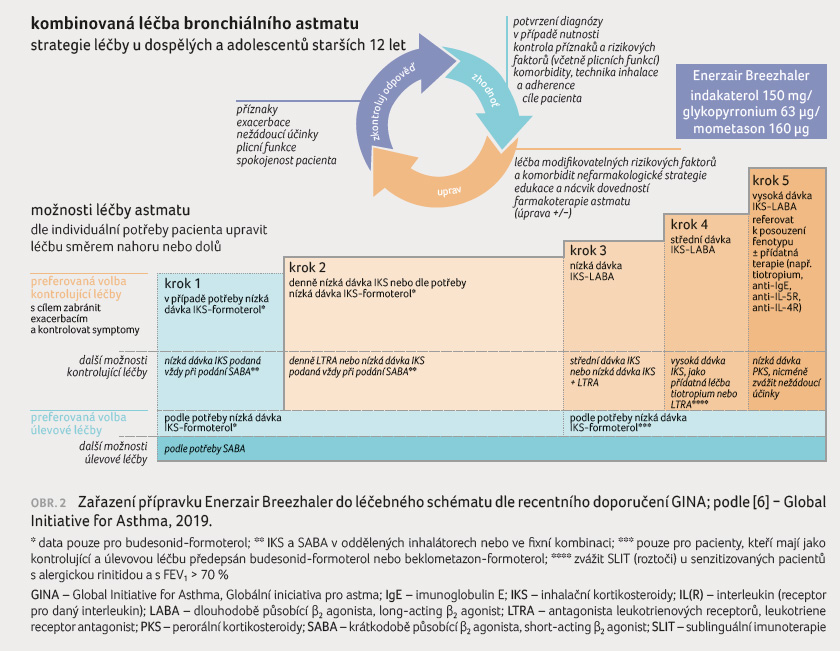 (indakaterol/glykopyrronium/mometason furoát) v tobolkách,
které se podávají pomocí inhalátoru. Jedná se dle dělení
lékových skupin o kombinaci U LABA/U LAMA/IKS.
Enerzair Breezhaler je indikován jako udržovací léčba astmatu
u dospělých pacientů, kteří nejsou adekvátně kontrolováni
udržovací léčebnou kombinací LABA a vysokou dávkou IKS
a prodělali jednu nebo více exacerbací astmatu v předchozím
roce. Přípravek je tedy určen pro těžší astmatiky, dle
indikace primárně ve čtvrtém až pátém kroku léčby
bronchiálního astmatu (obr. 2) [4]. Inhalace jednou denně
může zvýšit adherenci astmatiků k léčbě. Pacient by měl
být informován, že pravidelné užívání jednou denně je
nezbytné k udržení kontroly příznaků astmatu a léčba
by měla pokračovat i v případě, že pacient nemá
žádné obtíže. Pokud se příznaky objeví v období mezi
dávkami, není možné vzhledem k charakteru molekul lék
inhalovat dvakrát denně (či častěji). K okamžité úlevě
je třeba použít inhalačního agonistu β2 receptorů
s krátkodobým účinkem. V České republice má
přípravek preskripční omezení vázané na specializaci
pneumolog a alergolog/imunolog.
(indakaterol/glykopyrronium/mometason furoát) v tobolkách,
které se podávají pomocí inhalátoru. Jedná se dle dělení
lékových skupin o kombinaci U LABA/U LAMA/IKS.
Enerzair Breezhaler je indikován jako udržovací léčba astmatu
u dospělých pacientů, kteří nejsou adekvátně kontrolováni
udržovací léčebnou kombinací LABA a vysokou dávkou IKS
a prodělali jednu nebo více exacerbací astmatu v předchozím
roce. Přípravek je tedy určen pro těžší astmatiky, dle
indikace primárně ve čtvrtém až pátém kroku léčby
bronchiálního astmatu (obr. 2) [4]. Inhalace jednou denně
může zvýšit adherenci astmatiků k léčbě. Pacient by měl
být informován, že pravidelné užívání jednou denně je
nezbytné k udržení kontroly příznaků astmatu a léčba
by měla pokračovat i v případě, že pacient nemá
žádné obtíže. Pokud se příznaky objeví v období mezi
dávkami, není možné vzhledem k charakteru molekul lék
inhalovat dvakrát denně (či častěji). K okamžité úlevě
je třeba použít inhalačního agonistu β2 receptorů
s krátkodobým účinkem. V České republice má
přípravek preskripční omezení vázané na specializaci
pneumolog a alergolog/imunolog.
Seznam použité literatury
- [1] Chung KF, Wenzel SE, Brozek JL, et al. International ERS/ATS guidelines on definition, evaluation and treatment of severe asthma. Eur Respir J 2014; 43: 343−373.
- [2] Carr TF, Zeki AA, Kraft M. Eosinophilic and noneosinophilic asthma. Am J Respir Crit Care Med 2018; 197: 22–37.
- [3] Terl M, Sedlak V, Cap P, et al. Asthma management: A new phenotype‑based approach using presence of eosinophilia and allergy. Allergy 2017; 72: 1279−1287.
- [4] Global Initiative for Asthma (GINA). Pocket guide for asthma management and prevention. Dostupné na: https://ginasthma.org/wp‑content/uploads/2019/04/GINA‑2019‑main‑Pocket‑Guide‑wms.pdf Last accessed July 2020.
- [5] Katsaounou P, Odemyr M, Spranger O, et al. Still Fighting for Breath: a patient survey of the challenges and impact of severe asthma. ERJ Open Res 2018; 4: 00076‑2018.
- [6] Price D, Fletcher M, van der Molen T. Asthma control and management in 8,000 European patients: the REcognise Asthma and LInk to Symptoms and Experience (REALISE) survey. NPJ Prim Care Respir Med 2014; 24: 14009.
- [7] Souhrn údajů o přípravku Enerzair® Breezhaler®. Dostupné na: www.sukl.cz.
- [8] Chapman KR, van Zyl‑Smit RN, Kerstjens HAM, et al. Indacaterol/Glycopyrronium/Mometason Fuorate improves lung function and decreases exacerbations compared with Salmeterol/Fluticason in patients with uncontrolled asthma: Pooled Analyses of PALLADIUM and IRIDIUM Studies. Thematic poster session, A3004, Asthma Clinical Trials, ATS International Conference, May 15–20, 2020.
- [9] European Commission. Union Register of medicinal products for human use – Atectura Breezhaler. Available at: https://ec.europa.eu/health/documents/community‑register/html/h1439.htm. Last accessed July 2020.
- [10] Kerstjens HAM, Maspero JF, Chapman KR, et al. Indacaterol/Glycopyrronium/Mometason Fuorate improves lung function and reduces exacerbations versus Long‑acting β2‑agonist/Inhaled Corticosteroid Standard‑of‑care in patients with uncontrolled asthma: The Phase III IRIDIUM Study. Thematic poster session, A3007, Asthma Clinical Trials, ATS International Conference, May 15–20, 2020.