Erlotinib – jedna z možností léčby nemalobuněčného karcinomu plic ovlivněním receptoru pro epidermální růstový faktor
Biologická léčba při ovlivňování přirozených regulačních mechanismů řídících metabolismus, proliferaci a migraci nádorových buněk využívá nízkomolekulární preparáty, makromolekuly i buněčné efektory imunitního typu. V současnosti existuje nejvíce informací o ovlivnění receptoru pro epidermální růstový faktor (epidermal growth factor receptor = EGFR). Velmi intenzivně je zkoumána možnost inhibice intracelulární domény EGF receptoru s tyrozinkinázovou aktivitou, protože konečným důsledkem aktivace EGF receptoru je zvýšení proliferace nádorových buněk, inhibice apoptózy, zvýšení invazivity nádoru, aktivace angiogeneze, metastazování a vznik rezistence k chemoterapii i radioterapii. Jedná se o terapeutický přístup na subcelulární úrovni. Tato onkologická léčba je cílená (tzv. targeted) na nitrobuněčné mechanismy přenosu signálu, který vyvolává změny proliferační aktivity nádorových buněk. Nejvíce pozornosti věnují autoři erlotinibu, u kterého se předpokládá registrace v České republice v poměrně krátké době.
Úvod
V celosvětovém měřítku zaujímá bronchogenní karcinom druhé místo mezi všemi zhoubnými nádory. V České republice je na prvním místě mezi zhoubnými nádory u mužů a na prvním místě v příčinách úmrtí na zhoubné nádory. Během roku onemocní touto chorobou přibližně jeden muž z tisíce. Incidence byla v ČR v roce 2002 u mužů 91,4/100 000 obyvatel (v roce 1995 byla 94,2) a u žen 26,8 (v roce 1995 byla 21,1). U mužů je pozorován statisticky významný, ale velmi mírný pokles. U žen pozorujeme naopak trvale vzestupný trend v počtu nově zjištěných onemocnění. Od roku 1980 do současnosti se počet nově zjištěných případů rakoviny plic u žen více než zdvojnásobil (1980: 10,6/100 000 obyvatel, 2000: 26,8/100 000 obyv.). Nemalobuněčný bronchogenní karcinom (NSCLC = non small cell lung cancer) představuje 70–75 % všech bronchogenních karcinomů [8, 15, 20, 22].
Nejlepší prognózu mají ti nemocní, u nichž byl NSCLC diagnostikován v operabilním stadiu a provedena úspěšná resekce plicního tumoru. Podíl radikálně operovaných nemocných ze skupiny všech pacientů s nemalobuněčným bronchogenním karcinomem je poměrně nízký a v jednotlivých regionech České republiky může být odlišný. V celé České republice se podle publikovaných údajů pohybuje od 16 % do 27 % [13].
U menšiny radikálně operovaných pacientů je prognóza závislá na TNM klasifikaci. Nejlepší prognózy dosahují nemocní, jejichž nádor byl klasifikován jako T1 N0, u nichž bývá zaznamenáno pětileté přežití větší než 60 %. I v případě, že je provedena radikální resekce nádoru a postižených uzlin, dochází u většiny nemocných k recidivě (lokální nebo vzdálené) do 2 let. Prognóza u pacientů s neoperabilním lokoregionálně pokročilým onemocněním či generalizovaným onemocněním je i přes pokroky, kterých bylo v posledních 20 letech dosaženo v oblasti konvenční chemoterapie a radioterapie, špatná. Medián přežití těchto nemocných, kterých je v době stanovení diagnózy více než 50 %, obvykle nepřesahuje 9–10 měsíců. Základem chemoterapeutických režimů pro klinická stadia IIIB a IV jsou platinové deriváty (cisplatina nebo carboplatina) v kombinaci s některým z cytostatik III. generace (paclitaxel, docetaxel, gemcitabin, vinorelbin) [3, 4, 8, 13, 14, 20, 22].
Léčebné výsledky posledních let ukazují, že možnosti konvenční chemoterapie jsou vyčerpány a nepředpokládá se, že by další kombinace konvenčních cytostatik mohly nemocným s NSCLC zásadně prodloužit život. A právě z tohoto důvodu je v posledním desetiletí intenzivně studována léčba biologická, která je nazývána také léčbou cílenou (targeted therapy). Na rozdíl od konvenční cytostatické léčby se jedná o přístup na subcelulární úrovni. Proto bývá tato léčba označována jako intracelulární nebo molekulární chemoterapie. Biologická léčba při ovlivňování přirozených regulačních mechanismů řídících metabolismus, proliferaci a migraci nádorových buněk využívá nízkomolekulární látky, makromolekuly i buněčné efektory imunitního typu. Studovaných pochodů a struktur uvnitř buňky je celá řada [6, 9, 11, 16].
Cílená biologická léčba se zaměřením na ovlivnění EGFR se jeví jako slibný a perspektivní směr pro nemocné s nemalobuněčným bronchogenním karcinomem. Její velkou výhodou je velmi dobrá snášenlivost preparátů. Tyto látky se vyznačují nízkou toxicitou, specifickou vazbou na cílené molekulární struktury – proteiny s určitou enzymatickou aktivitou. Ve většině případů se jedná o léčbu perorální. Toto je velmi výhodné u nemocných často po několika liniích konvenční chemoterapie s poškozeným a špatným stavem periferního žilního přístupu. Dále to představuje jednoznačnou možnost ambulantní léčby u nemocných málo pohyblivých nebo u nemocných se souběžnými onemocněními, která kontraindikují podání konvenční chemoterapie. Na rozdíl od konvenční chemoterapie je léčba biologická regulační a přímo podmiňuje rozvoj prediktivní onkologie. Cílová struktura je totiž identifikována – tzv. tailoring (léčba šitá na míru).
Podstata ovlivnění receptoru pro epidermální růstový faktor (epidermal growth factor receptor = EGFR)
Ovlivnění receptoru pro epidermální růstový faktor je právě výše uvedeným terapeutickým přístupem na subcelulární úrovni. Tato onkologická léčba je cílená (tzv. targeted) na nitrobuněčné mechanismy přenosu signálu, který vyvolává změny proliferační aktivity nádorových buněk. EGFR je jednou z velmi výhodných cílových struktur k léčebnému ovlivnění, neboť právě jeho nekontrolovatelná aktivace je jedním z mechanismů umožňujících nádorové buňce proliferovat a metastazovat. EGFR je stimulován regulačními peptidy označovanými jako růstové faktory [1, 10, 12]. V patogenezi nádorového bujení dochází ke zvýšené tvorbě a vylučování těchto peptidů, které po vazbě na příslušný receptor zvyšují proliferační vlastnosti nádorové buňky [6]. U nemalobuněčného bronchogenního karcinomu je aktivována „rodina" epidermálního růstového faktoru (epidermal growth factor – EGF), který má proliferační účinky na buňky epidermis a receptory pro něj jsou exprimovány u epitelových nádorů plic. Dalším regulačním peptidem této EGF rodiny je transformující růstový faktor a (transforming growth factor a – TGF-a).
Konečným důsledkem aktivace EGF receptoru je zvýšení proliferace nádorových buněk, inhibice apoptózy, zvýšení invazivity nádoru, aktivace angiogeneze, metastazování a vznik rezistence k chemoterapii i radioterapii [1, 11, 12, 14].
V normálních buňkách je EGFR-tyrozinkinázová (EGFR-TK) signalizace přísně regulována. U nádorových buněk je porucha regulace signální dráhy EGFR-TK jedním z klíčových faktorů nekontrolovatelného růstu. U nemalobuněčného karcinomu plic dochází ke zvýšené expresi EGFR ve 40–80 % u různých histologických typů nádoru. U plicního adenokarcinomu bylo zjištěno zvýšení exprese EGFR v 50 % případů. Je třeba si však uvědomit, že zvýšená exprese EGFR ovšem nemusí vždy znamenat, že jde o aktivovaný receptor a že jeho blokáda bude mít jednoznačný terapeutický význam.
Přehled možností inhibice EGFR je uveden v přehledném článku na jiném místě tohoto periodika, proto zde bude zmíněno jen stručné rozdělení.
– ‑První skupinou inhibující EGFR jsou monoklonální protilátky cílené proti extracelulární doméně EGFR. Do této skupiny patří např. trastuzumab a cetuximab.
– ‑Druhou skupinou látek jsou konjugáty ligandů (EGF, TGF-a) s toxiny (pseudomonádový exotoxin A). Jsou zatím pouze předmětem počátečního klinického hodnocení.
– ‑Třetí skupinou látek jsou inhibitory tyrozinkinázové fosforylace v intracelulární části EGF receptoru.
Doposud nejznámějším inhibitorem tyrozinkinázové (TKk) fosforylace v intracelulární části EGFR je nízkomolekulární synteticky připravený anilinochinazolinový derivát gefitinib známý pod označením ZD1839, který je účinný po perorálním podání, optimální dávkování je u NSCLC 250 mg denně. Selektivně blokuje intracelulární receptorovou tyrozinkinázu EGFR. Přípravek má výrazné antiproliferační účinky.
Dalším selektivním inhibitorem EGFR tyrozinkinázy je erlotinib označený dříve jako OSI-774, jehož protinádorový účinek je srovnatelný s gefitinibem.
Erlotinib – klinické zkušenosti
Erlotinib ([6,7-bis(2-methoxy-ethoxy)-quinazolin-4-yl]-[3-ethylphenyl]amin (obr. 1) je rovněž nízkomolekulární synteticky připravený anilinochinazolinový derivát působící také jako inhibitor tyrozinkinázy receptoru pro lidský epidermální růstový faktor typu 1/receptoru epidermálního růstového faktoru (HER1/EGFR).
Silně inhibuje intracelulární fosforylaci HER1/EGFR receptoru, který je exprimován na povrchu normálních i nádorových buněk. V neklinických modelech navozuje inhibice fosfotyrozinu HER1/EGFR zastavení vývoje buněk. Přípravek má rovněž výrazné antiproliferační účinky, je účinný po perorálním podání a optimální dávkování u NSCLC je 150 mg denně [18].
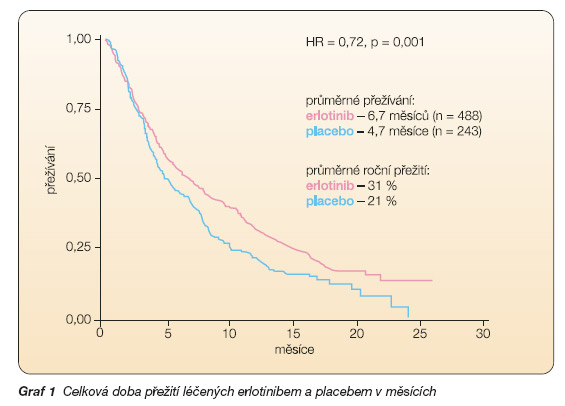
Účinnost a bezpečnost erlotinibu u NSCLC byla stanovena v randomizované dvojitě zaslepené, placebem kontrolované klinické studii (BR.21) u 731 pacientů s lokálně pokročilým nebo metstazujícím nemalobuněčným karcinomem plic po selhání alespoň jednoho režimu chemoterapie. V této studii byli pacienti randomizováni v poměru 2 : 1 do skupiny, v níž byl perorálně podáván přípravek erlotinib v dávce 150 mg jednou denně, a do skupiny, v níž bylo podáváno placebo. Výstupy studie zahrnovaly celkovou dobu přežití, čas do zhoršení příznaků spojených s nádorem plic (kašel, dušnost a bolest), celkovou léčebnou odpověď, délku trvání odpovědi, dobu přežití bez známek progrese choroby a bezpečnost. Primárním konečným výstupem studie byla doba přežití (graf 1) signifikantně delší ve skupině nemocných, jimž byl podáván erlotinib [19].
Demografické charakteristiky mezi oběma léčebnými skupinami byly dobře vyvážené. Přibližně dvě třetiny pacientů tvořili muži, přibližně jedna třetina pacientů měla výchozí performance status (PS) stupně 2 dle ECOG a 9 % mělo výchozí PS stupně 3. Ve skupinách léčených erlotinibem a placebem bylo 93 %, resp. 92 % všech pacientů v předchozí době léčeno platinou a 36 %, resp. 37 % všech pacientů prodělalo předchozí terapii taxanem. Medián celkové doby přežití ve skupině léčené erlotinibem byl 6,7 měsíce (95% CI, 5,5 až 7,8 měsíce) a bylo dosaženo zlepšení o 42,5 % při srovnání se 4,7 měsíce (95% CI, 4,1 až 6,3 měsíce) ve skupině, v níž bylo podáváno placebo. Dosažený poměr rizik (HR) úmrtí ve skupině léčené erlotinibem ve vztahu ke skupině, jíž bylo podáváno placebo, byl 0,73 (95% CI, 0,60 až 0,87) (p = 0,001). Procentuální zastoupení pacientů s dobou přežití 12 měsíců bylo ve skupině léčené erlotinibem 31,2 % a ve skupině, která dostávala placebo, 21,5 %. U většiny pacientů byl pozorován prospěšný vliv léčby erlotinibem na dobu přežití. Na základě hodnot stratifikačních faktorů HER1/EGFR byly sestaveny podskupiny pacientů podle předchozí aplikace taxanů, kouření v minulosti, pohlaví, věku, histologických nálezů, předchozího úbytku hmotnosti, časového období mezi počáteční diagnózou a randomizací a podle geografické lokalizace. Téměř všechny hodnoty poměru rizik (HR) ve skupinách léčených erlotinibem byly v porovnání s placebem menší než 1,0, což svědčí o příznivém účinku léčby na dobu přežití (graf 1). Prospěšnost léčby byla srovnatelná u pacientů s výchozím stavem onemocnění ve stupni 2–3 (HR = 0,77) nebo ve stupni 0–1 (HR = 0,73) dle ECOG a u pacientů, kteří podstoupili jednu (HR = 0,76) nebo dvě či více chemoterapií (HR = 0,76). Ze 45 % pacientů se známou expresí EGFR byly hodnoty poměru rizik 0,68 u pacientů s nádory s EGFR-pozitivitou a 0,93 u pacientů s nádory s EGFR-negativitou. U zbývajících 55 % pacientů, u kterých nebyla exprese EGFR známa, byla hodnota poměru rizik 0,77. V explorační mnohorozměrné analýze se neprokázala souvislost exprese EGFR a doby přežití. Prospěšný vliv léčby erlotinibem na dobu přežití byl rovněž pozorován u pacientů, u nichž nebylo dosaženo objektivní odpovědi na nádor (dle kritérií RECIST). Tuto skutečnost dokládá poměr rizik úmrtí 0,82 dosažený u pacientů, kde nejlepší odpovědí byla stabilizace onemocnění nebo progrese. Ve skupině léčené erlotinibem byl medián přežití bez známek progrese onemocnění 9,7 týdne (95% CI, 8,4 až 12,4 týdne) v porovnání s 8,0 týdny ve skupině, v níž bylo podáváno placebo (95% CI, 7,9 až 8,1 týdne).
Objektivní odpověď na léčbu podle kritérií RECIST byla ve skupině léčené erlotinibem 8,9 % (95% CI, 6,4–12,0 %). Prvních 330 pacientů bylo hodnoceno centrálně (léčebná odpověď 6,2 %); 401 pacientů bylo hodnoceno zkoušejícími (léčebná odpověď 11,2 %). Medián doby trvání odpovědi byl 34,3 týdne, v rozmezí hodnot od 9,7 až 57,6 a vyšších. Podíl pacientů, u nichž bylo dosaženo kompletní léčebné odpovědi, částečné léčebné odpovědi nebo stabilizace onemocnění, byl ve skupině léčené erlotinibem 44 % oproti 27,5 % ve skupině, v níž bylo podáváno placebo (p = 0,004) [19].
Mutace v genu tyrozinkinázové domény lidského receptoru pro epidermální růstový faktor (HER1/EGFR) jsou podle poznatků z vyšetření materiálu nemocných, jimž byl podáván jak gefitinib, tak erlotinib, časté zejména u nekuřáků s adenokarcinomem. Přítomnost mutací ovlivňuje odpověď na léčbu nemalobuněčného bronchogenního karcinomu a předpokládá se, že hraje významnou roli u nekuřáků [21].
Podle současných vědomostí se předpokládá, že nekuřáci a nemocní s mutací genu EGFR (EGFR+) mají větší výhody z léčby erlotinibem, anamnéza (ne)kouření je dokonce významnějším predikátorem přežití než exprese EGFR [5, 17].
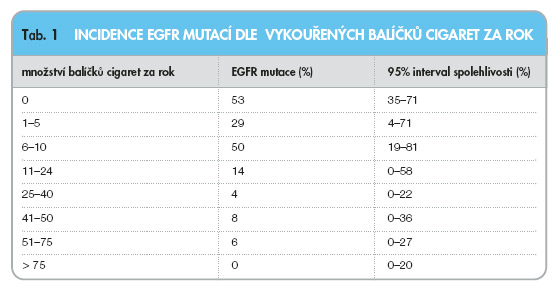
Mutace EGFR korelují i s délkou kouření. Četnost těchto mutací se snižuje se zvyšujícím se počtem vykouřených cigaret. Optimální kuřácká anamnéza pro vyšší pravděpodobnost výskytu mutací EGFR je méně než 10 balíčků za rok a interval zanechání kouření více než 25 let. Tyto poznatky mohou pomoci v odhadu pravděpodobnosti výskytu mutací v EGFR a tedy i při výběru vhodného kandidáta léčby erlotinibem nebo gefitinibem u pacientů s adenokarcinomem plic. Anamnéza kouření pak může podat užitečnou informaci, pokud není možné přímé stanovení mutace (tab. 1) [17].
Výhodná se jeví léčba erlotinibem pro nemocné, kterým byl v rámci předchozí konvenční chemoterapie podáván platinový derivát [7].
Farmakokinetické vlastnosti
Po perorálním podání jsou maximální hladiny erlotinibu v plazmě dosahovány přibližně po 4 hodinách od užití. Ve studii prováděné u zdravých dobrovolníků byl získán odhad absolutní biologické dostupnosti 59 %. Po perorálním podání dávky může být expozice zvýšena požitím jídla.
Erlotinib má zdánlivý průměrný distribuční objem 232 litrů a je distribuován do lidských nádorových tkání. Ve studii u 4 pacientů (3 pacienti s diagnózou nemalobuněčného karcinomu plic a jeden pacient s nádorem hrtanu), kterým bylo perorálně podáváno 150 mg erlotinibu jednou denně, byla ve vzorcích nádorové tkáně chirurgicky vyjmuté v 9. den léčby nalezena koncentrace erlotinibu v průměru 1,185 ng/g tkáně. Tento údaj odpovídá celkovému průměru 63 % (rozmezí 5–161 %) maximální koncentrace v plazmě pozorované ve stabilním stavu. Primární aktivní metabolity se v nádoru vyskytovaly v průměrných koncentracích 160 ng/g tkáně, což odpovídá celkovému průměru 113 % (rozmezí 88–130 %) maximální koncentrace v plazmě pozorované ve stabilním stavu. Vazba na plazmatické proteiny je přibližně 95 %. Erlotinib se váže na sérový albumin a kyselý glykoprotein a1 (AAG). U lidí je metabolizován v játrech pomocí jaterních cytochromů, zejména CYP3A4 a v menší míře také CYP1A2. Mimojaterní metabolismus CYP3A4 ve střevě, CYP1A1 v plicích a 1B1 v nádorové tkáni se potenciálně podílí na metabolické clearance erlotinibu. Byly identifikovány tři hlavní metabolické dráhy: 1. O-demetylace postranního řetězce nebo obou řetězců následovaná oxidací na karboxylové kyseliny; 2. oxidace acetylenové části molekuly následovaná hydrolýzou na aryl karboxylové kyseliny a 3. aromatická hydroxylace na fenylu a acetylenové části molekuly. V preklinických studiích in vitro a na modelech nádorů in vivo bylo prokázáno, že primární metabolity erlotinibu OSI-420 a OSI-413 vznikající O-demetylací na postranních řetězcích mají potenci srovnatelnou s erlotinibem. Jsou přítomny v plazmě v koncentraci odpovídající < 10 % erlotinibu a mají podobnou farmakokinetiku jako erlotinib [17, 18].
Erlotinib je vylučován ve formě metabolitů ve stolici (> 90 %), přičemž v ledvinách se z perorálně podané dávky eliminuje pouze malé množství (přibližně 9 %). Méně než 2 % perorálně podané dávky jsou vyloučena ve formě původní látky. Farmakokinetické populační analýzy, které byly prováděny u 591 pacientů léčených erlotinibem, ukázaly průměrnou zdánlivou clearance 4,47 l/hod a medián poločasu eliminace 36,2 hodiny. Proto je možno očekávat dosažení stabilní plazmatické koncentrace přibližně po 7 až 8 dnech. Na základě populačních farmakokinetických analýz nebyl zaznamenán žádný klinický statisticky významný vztah mezi předpokládanou zdánlivou clearance a věkem, hmotností, pohlavím a etnickou příslušností pacienta. Faktory, které korelovaly s farmakokinetikou erlotinibu, byly: celková koncentrace bilirubinu v séru pacienta, AAG a kouření v současné době. Zvýšené koncentrace bilirubinu v séru a koncentrace AAG byly spojeny s nižší rychlostí clearance erlotinibu. Klinický význam těchto rozdílů je nejasný. U kuřáků však byla vyšší clearance erlotinibu. Na základě populačních farmakokinetických studií je třeba doporučit kuřákům přestat s kouřením v době léčby erlotinibem, jinak může dojít ke snížení jeho plazmatických hladin. Na základě populačních farmakokinetických analýz se zdá, že v přítomnosti opioidů se zvyšuje expozice erlotinibu přibližně o 11 %. U pediatrických nebo starších pacientů nebyly dosud provedeny žádné specifické studie [17, 18].
Erlotinib je primárně zpracováván v játrech. V současnosti nejsou k dispozici údaje týkající se vlivu jaterní dysfunkce a/nebo metastáz do jater na farmakokinetiku erlotinibu. Farmakokinetické populační analýzy prokázaly spojitost mezi sníženou koncentrací celkového bilirubinu v séru a nižší rychlostí clearance erlotinibu [7, 18].
Erlotinib a jeho metabolity nejsou signifikantně vylučovány ledvinami, do moči se vyloučí méně než 9 % jednotlivé dávky. Ve farmakokinetických populačních analýzách nebyl pozorován žádný statisticky významný vztah mezi clearance erlotinibu a clearance kreatininu [21].
Nežádoucí účinky
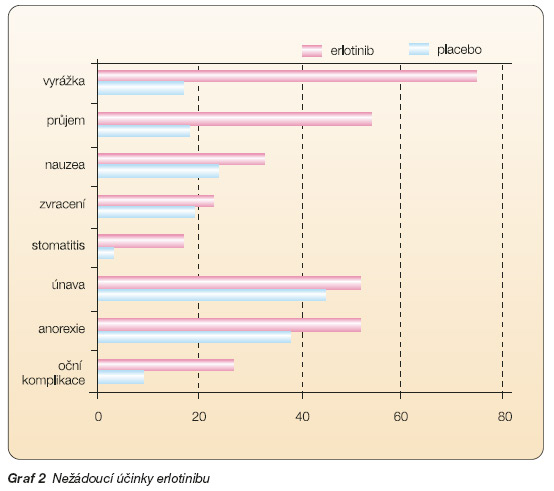
Nejčastěji hlášenými nežádoucími účinky (graf 2) u pacientů léčených erlotinibem byly vyrážka (75 %) a průjem (54 %). Stupeň závažnosti byl u většiny těchto nežádoucích účinků 1/2 bez nutnosti lékařské intervence. Vyrážka a průjem stupně 3/4 se vyskytly u 9 %, resp. 6 % pacientů léčených erlotinibem a každý z těchto nežádoucích účinků byl příčinou přerušení léčby u 1 % nemocných. Snížení dávky kvůli vyrážce a průjmu bylo třeba provést u 6 %, resp. 1 % pacientů. Ve studii BR.21 byl zjištěn medián časového období do výskytu vyrážky 8 dní a medián časového období do výskytu průjmu 12 dní.
Případy intersticiálního plicního procesu včetně fatálních případů byly ojediněle popsány u pacientů užívajících erlotinib v léčbě nemalobuněčného plicního karcinomu a i dalších solidních nádorů. V prvotní studii BR.21 u NSCLC byla incidence intersticiálního plicního postižení (0,8 %) u skupiny léčené erlotinibem stejná jako u skupiny, jíž bylo podáváno placebo. Celkově byla incidence ve všech studiích (včetně nekontrolovaných studií a studií se současně probíhající chemoterapií) rovna přibližně 0,6 % v porovnání s 0,2 % u pacientů, kterým bylo podáváno i placebo. U pacientů s intersticiálním plicním postižením byly hlášeny následující diagnózy zahrnující pneumonitidu, intersticiální pneumonii, intersticiální plicní proces, obliterující bronchiolitidu, plicní fibrózu, syndrom akutní respirační tísně dospělých (ARDS) a infiltraci plic. Velmi často byly hlášeny i další faktory přispívající ke zhoršení stavu onemocnění. Patří mezi ně současná nebo v předchozí době probíhající chemoterapie, předchozí radioterapie, parenchymální onemocnění plic existující v dřívější době, metastazující onemocnění plic nebo plicní infekce [7, 18].
Pokud by došlo k akutnímu výskytu nových a/nebo těžkých nevysvětlených plicních příznaků, jako jsou např. dušnost, kašel a horečka, měla by být léčba erlotinibem přerušena až do vyhodnocení diagnózy. Je-li diagnostikováno intersticiální plicní postižení jednoznačně v souvislosti s podáním erlotinibu, je třeba jeho podávání přerušit a zahájit potřebnou léčbu [7, 18].
Přibližně u 50 % pacientů se vyskytl průjem, který by ve středně těžké až těžké formě měl být léčen např. loperamidem. V některých případech může být nutné snížit dávkování. V klinických studiích se dávky snižovaly postupně v krocích po 50 mg. Snižování dávek v krocích po 25 mg nebylo zkoumáno. V případě těžkého nebo přetrvávajícího průjmu, nevolnosti, anorexie nebo zvracení spojeného s dehydratací by měla být terapie přerušena. Tablety obsahují laktózu a neměly by být podávány pacientům s dědičnými problémy s nesnášenlivostí galaktózy, Lapp-laktázovou deficiencí nebo glukózo-galaktózovou malabsorpcí. Erlotinib má zvýšenou rozpustnost při pH < 5. Účinek antacid, inhibitorů protonové pumpy a antagonistů H2 receptorů na absorpci erlotinibu však není znám. Při kombinaci těchto léků s erlotinibem je třeba postupovat se zvýšenou opatrností [7, 18].
Závěr
Terapie erlotinibem prodlužuje přežití, prodlužuje dobu do progrese a oddaluje symptomy spojené s onemocněním nemalobuněčným bronchogenním karcinomem. Erlotinib je relativně dobře tolerován. Nejčastější nežádoucí účinky, mezi které patří zejména vyrážka a průjem, jsou většinou mírného nebo středně těžkého stupně. Jako u prvního inhibitoru EGFR bylo u erlotinibu v placebem kontrolované studii prokázáno prodloužení celkové doby přežití [19].
Seznam použité literatury
- [1] Baselga J. Why the Epidermal Growth Factor Receptor? The Rationale for Cancer Therapy. The Oncologist 2002; 7 (suppl 4): www.TheOncologist.com.
- [2] Baselga J, Kris M, Yano S, et al. Phase II trials (IDEAL a and IDEAL 2) of ZD1839 („IRESSA“) in locally advanced or metastatic non-small-cell lung cancer patients. ESMO, Nice, France, October 18–22, 2002.
- [3] British Thoracic Society and Society of Cardiothoracic Surgeons of Great Britain and Ireland Working Party: Guidelines on the selection of patients with lung cancer for surgery. Thorax 2001; 56: 89–108.
- [4] Bunn PA, Kelly K. New Combination in the Treatment of Lung Cancer. A Time for Optimism. Chest 2000; 117: 138S–143S.
- [5] Clark GM, Zborowski D, Santabárbara P, et al. Smoking history is more predictive of survival benefit from erlotinib for patients with non-small cell lung cancer (NSCLC) than EGFR expression. ASCO 2005, abstract 7022.
- [6] Dy GK, Adjei AA. Novel Targets for Lung Cancer Therapy: Part II. J Clin Oncol 2002; 20: 3016–3028.
- [7] Felip E, Rojo F, Keller A, et al. A phase II study of erlotinib as first-line treatment of advanced non-small cell lung cancer, ASCO 2005, abstract 7100.
- [8] Ginsberg RJ. Lung Cancer. London, BC Decker Hamilton, 2002.
- [9] Hege KM, Carbone DP. Lung cancer vaccines and gene therapy. Lung Cancer 2003; 41: S103–S113.
- [10] Herbst RS, Kies MS. ZD1839 (Iressa) in Non-Small Cell Lung Cancer. The Oncologist 2002; 7 (suppl 4): www.TheOncologist.com.
- [11] Jotte R. Biology therapy in lung cancer. In: Hansen HH, Bunn PA jr. Lung cancer therapy annual. London, Martin Dunitz, 2002: 129–143.
- [12] Levitzki A. EGF receptor as a therapeutic target. Lung Cancer 2003; 41: S9–S14.
- [13] Marel M, Skácel Z, Špásová I, et al. Diagnostika a léčba nemocných s plicním karcinomem na oddělení TRN ve FN Motol v letech 1998–2003. Stud Pneumol Phtiseol 2004; 64: 289–294.
- [14] Mendelsohn J. Targeting the Epidermal Growth Factor Receptor for Cancer Therapy. J Clin Oncol 2002; 20 (suppl 15): 1–13.
- [15] Niklinski J, Hirsch FR. Molecular approaches to lung cancer evaluation. Lung Cancer 2002; 38: S9–S17.
- [16] Pešek M., et al. Bronchogenní karcinom. Praha, Galén, 2002.
- [17] Pham D, Kris MG, McDonough T, et al Estimation of the likelihood of epidermal growth factor receptor (EGFR) mutations based on cigarette smoking history in patients with adenocarcinoma of the lung. ASC0 2005, abstract 7069.
- [18] Shepherd F, Pereira J, Ciuleanu E, et al. For the National Cancer Institute of Canada Clinical Trials Group: A Randomized Placebo Controlled Study of Erlotinib (OSI-774, Tarceva´) versus Placebo in Patients with Incurable Non-Small Cell Lung Cancer Who Have Failed Standard Therapy for Advanced or Metastatic Disease, ASCO 2004.
- [19] Shepherd F, Pereira J, Ciuleanu E, et al. Molecular analysis of the epidermal growth factor receptor (EGFR) gene and protein expression in patients treated with erlotinib in National Cancer Institute of Canada Clinical Trials Group (NCIC CTG) trial BR.21. Proc Am Soc Clin Oncol 2004 (post-meeting edition); 23: 14S (Abstract 7022).
- [20] Skřičková J, et al. Bronchogenní karcinom. In: Z. Adam, J. Vorlíček, J. Vaníček a kol. Diagnostické a léčebné postupy u maligních chorob. Praha, Grada Publishing, 2002: 33–53.
- [21] Sonobe M, Katakura H, Adachi T, et al. Mutations of the epidermal growth factor receptor (EGFR) gene in non-small cell lung cancer (NSCLC). ASCO 2005, abstract 7070.
- [22] Zatloukal P, Petruželka L. Karcinom plic. Praha, Grada, 2001.
- [23] Herbst RS, Prager D, Hermann R, et al. TRIBUTE – a phase III trial of erlotinib hydrochloride (OSI-774) combined with carboplatin and paclitaxel chemotherapy in advanced non-small-cell lung cancer. J Clin Oncol 2005; 23(25): 5856–5858.