Estradiolvalerát/dienogest – první přípravek kombinované hormonální antikoncepce s estradiolem
Estradiolvalerát (E2V) je valerát ester 17b-estradiolu. Na rozdíl od ethinylestradiolu, který se běžně používá v přípravcích kombinované hormonální antikoncepce, se vyznačuje nižší indukcí jaterní proteosyntézy. Dienogest (DNG) vykazuje nejen vlastnosti derivátu 19-nortestosteronu, tj. krátký plazmatický poločas, silný gestagenní efekt na endometrium, vysokou biologickou dostupnost po perorálním podání, ale také typické vlastnosti derivátů progesteronu, např. antiandrogenní působení a mírnou inhibici sekrece gonadotropinů. E2V/DNG využívá 28denního dynamického režimu dávkování; ten sestává z 26 hormonálně aktivních tablet obsahujících tři dávky samotného E2V nebo kombinovaného se dvěma dávkami DNG a ze dvou tablet obsahujících placebo. Kontracepční spolehlivost stanovená na základě dat tří multicentrických studií pomocí nekorigovaného Pearlova indexu činila 0,79. Z výsledků dosud provedených klinických studií vyplývá pouze minimální vliv E2V/DNG na řadu metabolických a hemokoagulačních parametrů.
Úvod
Zatímco gestagenní složka přípravků kombinované hormonální antikoncepce (COC) byla mnoho let spojena s pestrou nabídkou jednotlivých gestagenů, které se tak staly nositeli specifických vlastností hormonálních kontraceptiv, ve složce estrogenní měl dlouhou dobu monopolní postavení ethinylestradiol (EE). Vývoj v oblasti estrogenní složky tak zůstal omezen na postupné snižování dávky. V redukci dávky ethinylestradiolu mělo zásadní význam z hlediska morbidity a mortality v souvislosti s užíváním COC snížení z 50 µg na 30–35 µg. V současnosti nejnižší hladina – 15 µg ethinylestradiolu – je velmi pravděpodobně hranicí, pod niž se již dále klesat nebude.
Pokusy o zavedení alternativy k syntetickému ethinylestradiolu v podobě přirozeného 17β-estradiolu (E2) do přípravků COC se objevovaly již v minulosti, limitujícím faktorem byla vždy velmi neuspokojivá kontrola cyklu. Toto slabé místo se podařilo překonat využitím kombinace s některými novými gestageny. 17α-ethinylová skupina v poloze C17 (nevyskytuje se u přirozeného E2) je zodpovědná za pomalý metabolismus ethinyl-estradiolu, zvýšení biologické dostupnosti a protrahovanější účinek ve srovnání s přirozeným 17β-estradiolem. Důsledkem je i výraznější vliv na jaterní proteosyntézu (syntéza vazebných proteinů, koagulačních faktorů atd.). Hlavními motivacemi zavedení 17β-estradiolu do přípravků COC je tak očekávaná nižší indukce jaterní proteosyntézy a další zlepšení snášenlivosti.
První globálně dostupný přípravek kombinované hormonální antikoncepce obsahující estradiol, resp. estradiolvalerát (E2V), je v České republice k dispozici pod názvem Qlaira. Jako přípravek kombinované kontracepce využívá příznivých farmakologických vlastností gestagenu dienogestu (DNG).
Farmakologie
Estradiolvalerát
Estradiolvalerát (E2V) je valerát ester 17β-estradiolu. Po perorálním podání E2V dochází k jeho rychlému vstřebávání. Během absorpce střevní sliznicí a při prvním průchodu játry probíhá štěpení E2V na přirozený 17β-estradiol a kyselinu valerovou [1, 2]. Vzhledem k tomu, že 1 mg E2V odpovídá 0,76 mg 17β-estradiolu, je estrogenní působení E2V i 17β-estradiolu kvalitativně i kvantitativně podobné [1].
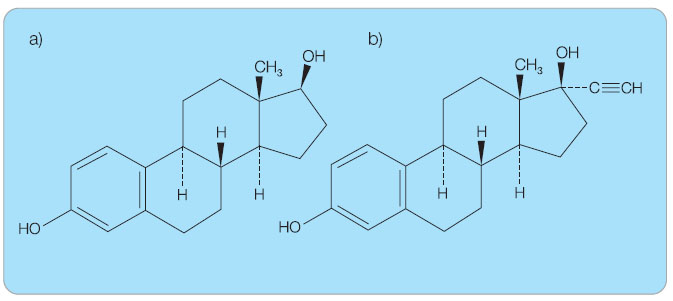 Důsledkem intenzivního metabolismu 17β-estradiolu (obr. 1a) ve střevní sliznici nebo během prvního průchodu játry jsou pouze 3 % estradiolvalerátu dostupná ve formě metabolicky nezměněného 17β-estradiolu [1]. Přeměna estradiolvalerátu probíhá rychleji než u ethinylestradiolu obsahujícího 17α-ethinylovou skupinu, která brání rychlé metabolizaci (obr. 1b).
Důsledkem intenzivního metabolismu 17β-estradiolu (obr. 1a) ve střevní sliznici nebo během prvního průchodu játry jsou pouze 3 % estradiolvalerátu dostupná ve formě metabolicky nezměněného 17β-estradiolu [1]. Přeměna estradiolvalerátu probíhá rychleji než u ethinylestradiolu obsahujícího 17α-ethinylovou skupinu, která brání rychlé metabolizaci (obr. 1b).
 Přípravky obsahující estradiol v množství srovnatelném s dávkou E2V v přípravku Qlaira vykazují podobný biologický efekt jako ethinylestradiol (EE) v dávce 4–20 µg, v závislosti na cílovém orgánu. Vliv E2 na inhibici ovulace [3], proliferaci endometria a maturaci vaginálních epiteliálních buněk [4] je srovnatelný s 20 µg EE, zatímco vliv 2 µg E2V na indukci syntézy proteinů v játrech – sex hormone-binding globulin (SHBG), angiotenzinogen a koagulační faktory – je vyjádřený méně než u 20 µg EE [5–8] (tab. 1).
Přípravky obsahující estradiol v množství srovnatelném s dávkou E2V v přípravku Qlaira vykazují podobný biologický efekt jako ethinylestradiol (EE) v dávce 4–20 µg, v závislosti na cílovém orgánu. Vliv E2 na inhibici ovulace [3], proliferaci endometria a maturaci vaginálních epiteliálních buněk [4] je srovnatelný s 20 µg EE, zatímco vliv 2 µg E2V na indukci syntézy proteinů v játrech – sex hormone-binding globulin (SHBG), angiotenzinogen a koagulační faktory – je vyjádřený méně než u 20 µg EE [5–8] (tab. 1).
Z farmakokinetických vlastností byly zaznamenány po celou dobu cyklu stabilní hladiny E2 (graf 1); průměrná koncentrace E2 se během podávání E2V pohy-bovala od 28,7 do 64,7 pg/ml [9, 10]. Schopnost udržet stabilní hodnoty E2, které jsou výsledkem kombinace podávání exogenního E2 a jeho endogenní produkce, je připisována podávání E2V v dynamickém dávkovacím režimu po dobu 26 dnů užívání hormonálně aktivních tablet. Podle analýzy metabolitů E2V je poměr estronu (E1) ku E2 přibližně 5 : 1, což svědčí pro supresi endogenní ovariální syntézy E2 vlivem inhibice folikulárního růstu [11].
Dienogest
S dienogestem (DNG) jsou již bohaté klinické zkušenosti, které byly získány používáním přípravků COC (2 mg DNG v kombinaci s 30 µg EE) i HRT (2 mg DNG v kombinaci s 1 mg nebo 2 mg E2V). Vedle vlastností derivátu 19-nortesto-steronu (krátký plazmatický poločas, silný gestagenní efekt na endometrium, vysoká biologická 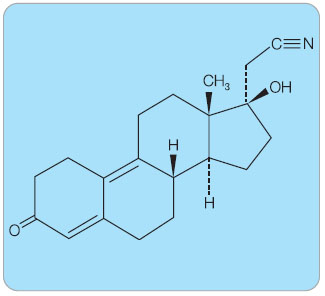 dostupnost po perorálním podání) [12–15] vykazuje DNG rovněž typické vlastnosti derivátů progesteronu, jako jsou antiandrogenní působení a mírná inhibice sekrece gonadotropinů [16]. Na rozdíl od ostatních derivátů 19-nortestosteronu má dienogest v poloze C17 nahrazenu 17α-ethinylovou skupinu skupinou 17α-kyanomethylovou (obr. 2). Tato změna je pravděpodobně zodpovědná za nulovou reziduální androgenní aktivitu, na-opak DNG vykazuje účinky antiandrogenní. Rovněž to může vysvětlovat, proč DNG neinhibuje enzymy cytochromu P-450 (CYP) [17].
dostupnost po perorálním podání) [12–15] vykazuje DNG rovněž typické vlastnosti derivátů progesteronu, jako jsou antiandrogenní působení a mírná inhibice sekrece gonadotropinů [16]. Na rozdíl od ostatních derivátů 19-nortestosteronu má dienogest v poloze C17 nahrazenu 17α-ethinylovou skupinu skupinou 17α-kyanomethylovou (obr. 2). Tato změna je pravděpodobně zodpovědná za nulovou reziduální androgenní aktivitu, na-opak DNG vykazuje účinky antiandrogenní. Rovněž to může vysvětlovat, proč DNG neinhibuje enzymy cytochromu P-450 (CYP) [17].
Plazmatický poločas DNG je 11 hodin, proto při každodenním užívání nedochází k významnější akumulaci v plazmě [9]. Zároveň má DNG relativně malý distribuční objem [12]. Vysoký podíl DNG (přibližně 10 %) zůstává nenavázaný na plazmatické proteiny; 90 % se váže nespecificky na albumin [12]. Biologická dostupnost DNG po perorálním podání je vysoká (více než 90 %) [18]. Jelikož má DNG velmi nízkou afinitu k SHBG a k vazebnému protei-nu pro kortizol (CBG), neovlivňuje hladiny testosteronu jeho vytlačením z těchto vazebných proteinů [12, 14]. Podobně jako deriváty progesteronu má DNG klinicky významnou antiandrogenní aktivitu. DNG nevykazuje v lidském organismu estrogenní, antiestrogenní, an-drogenní, glukokortikoidní ani antimineralokortikoidní aktivitu [5, 12].
DNG je specifický agonista progesteronového receptoru [15]. DNG vykazuje pouze mírnou antigonadotropní aktivitu [14, 16]; nicméně, v dávce 1–2 mg denně DNG účinně inhibuje ovulaci [13]. Nedávné studie na opicích zjistily, že DNG navozuje apoptózu buněk zona granulosa dominantního folikulu při nezměněné hladině folikuly stimulujícího hormonu [7], což podporuje již dřívější hypotézu periferního (ovariálního) účinku DNG [8]. DNG má silný gestagenní vliv na endometrium a jen mírný antigonadotropní účinek, což způsobje silnou tendenci DNG k uterinnímu (perifernímu) působení; uterotropní aktivita DNG je vyšší než u jiných gestagenů užívaných v COC [12]. Zmiňované farmakologické vlastnosti znamenají větší podobnost DNG přirozenému progesteronu než u ostatních gestagenů [13].
Hlavní charakteristikou dienogestu, která umožnila jeho kombinaci s estradiolem v COC, a tak uspokojivou kontrolu cyklu, je zmiňovaný silný gestagenní účinek. Ten byl znovu potvrzen i v nových experimentech na animálních modelech i v pokusech in vitro. V porovnání s dydrogesteronem, norethisteronem a medroxyprogesteron-acetátem vykazoval dienogest největší vliv na transformaci endometria u králíků (McPhail test) a opakovaně byl prokázán silný antiproliferační vliv na humánní endometriální buňky [6, 15]. Gestagenní účinek je pravděpodobným důvodem účinnosti monoterapie dienogestem na symptomy spojené s endometriózou, která je srovnatelná s analogy GnRH (gonadotropin releasing hormone) [19].
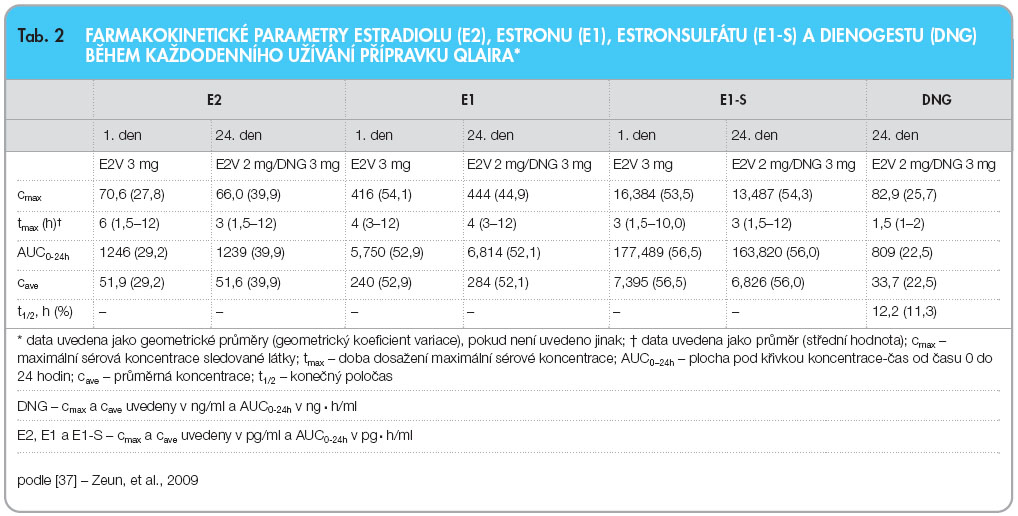 U Qlairy se průměrná koncentrace DNG pohybovala od 6,8 do 15,1 ng/ml (zpracovávaná data). Stabilní koncentrace DNG bylo dosaženo po 2–3 dnech každé fáze režimu, kdy byl DNG podáván [10]. Farmakokinetické vlastnosti DNG se shodují s údaji pro kombinovanou antikoncepci obsahující 30 µg EE a 2 mg DNG v monofázické konstrukci s režimem užívání 21/7 dní. Dřívější údaje svědčí pro většinou li-neární farmakokinetiku a minimální akumulaci [18]. Hlavní farmakokinetické parametry E2, E1, estronsulfátu a DNG při denním užívání Qlairy jsou uvedeny v tab. 2.
U Qlairy se průměrná koncentrace DNG pohybovala od 6,8 do 15,1 ng/ml (zpracovávaná data). Stabilní koncentrace DNG bylo dosaženo po 2–3 dnech každé fáze režimu, kdy byl DNG podáván [10]. Farmakokinetické vlastnosti DNG se shodují s údaji pro kombinovanou antikoncepci obsahující 30 µg EE a 2 mg DNG v monofázické konstrukci s režimem užívání 21/7 dní. Dřívější údaje svědčí pro většinou li-neární farmakokinetiku a minimální akumulaci [18]. Hlavní farmakokinetické parametry E2, E1, estronsulfátu a DNG při denním užívání Qlairy jsou uvedeny v tab. 2.
Dynamický režim dávkování
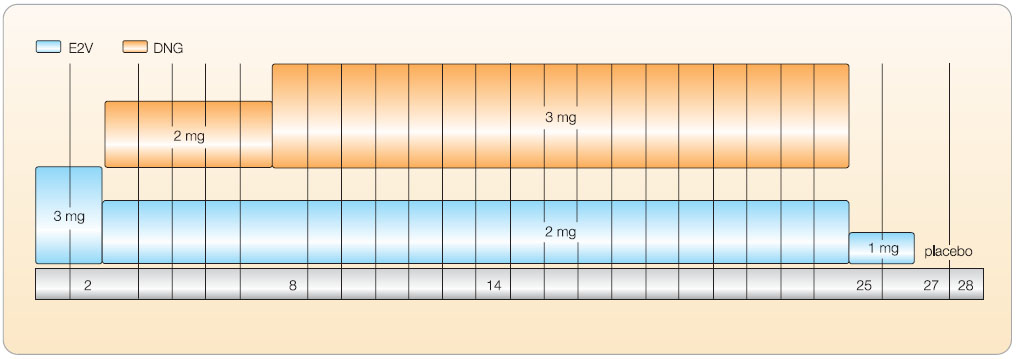 Qlaira využívá 28denního dynamického režimu dávkování; ten sestáva z 26 hormonálně aktivních tablet obsahujících tři dávky samotného E2V nebo kombinovaného se dvěma dávkami DNG a ze dvou tablet obsahujících placebo. Vývoj tohoto režimu byl poměrně komplikovaný – nejprve byly zkoušeny bifázické a trifázické konstrukce, které sice vedly ke spolehlivé supresi ovulace, ale stále byly zatíženy vysokou prevalencí nepravidelného krvácení. 28denní cyklus dynamického režimu dávkování je u Qlairy složen z užívání 3 mg E2V 1.–2. den, 2 mg E2V/2 mg DNG 3.–7. den, 2 mg E2V/3 mg DNG 8.–24. den, 1 mg E2V 25.–26. den a placeba podávaného 27.–28. den (obr. 3). Ve srovnání s konvenčními 21/7denními režimy COC je Qlaira spojena s prodlouženým intervalem užívání hormonálně aktivních tablet (26 dní) a zkráceným, tzv. hormone-free, intervalem (2 dny). Užívání postupně se snižujících dávek estrogenu a postupně se zvyšujících dávek gestagenu je zaměřeno zejména na nedostatečnou kontrolu cyklu pozorovanou u starších kontraceptiv obsahujících estradiol.
Qlaira využívá 28denního dynamického režimu dávkování; ten sestáva z 26 hormonálně aktivních tablet obsahujících tři dávky samotného E2V nebo kombinovaného se dvěma dávkami DNG a ze dvou tablet obsahujících placebo. Vývoj tohoto režimu byl poměrně komplikovaný – nejprve byly zkoušeny bifázické a trifázické konstrukce, které sice vedly ke spolehlivé supresi ovulace, ale stále byly zatíženy vysokou prevalencí nepravidelného krvácení. 28denní cyklus dynamického režimu dávkování je u Qlairy složen z užívání 3 mg E2V 1.–2. den, 2 mg E2V/2 mg DNG 3.–7. den, 2 mg E2V/3 mg DNG 8.–24. den, 1 mg E2V 25.–26. den a placeba podávaného 27.–28. den (obr. 3). Ve srovnání s konvenčními 21/7denními režimy COC je Qlaira spojena s prodlouženým intervalem užívání hormonálně aktivních tablet (26 dní) a zkráceným, tzv. hormone-free, intervalem (2 dny). Užívání postupně se snižujících dávek estrogenu a postupně se zvyšujících dávek gestagenu je zaměřeno zejména na nedostatečnou kontrolu cyklu pozorovanou u starších kontraceptiv obsahujících estradiol.
Kontracepční spolehlivost
Kontracepční spolehlivost přípravku Qlai-ra byla stanovena na základě tří multicentrických studií (Evropa, USA, Kanada), kterých se účastnilo celkem 2266 žen. Dvě z těchto studií byly otevřené a nekomparativní; jedna probíhala v Evropě po dobu 20 cyklů a zahrnovala 1377 žen [20], druhá probíhala v USA a Kanadě po dobu 13 cyklů (prodloužena maximálně na 28 cyklů) a zahrnovala 490 žen [21]. Třetí studie byla dvojitě zaslepená, randomizovaná, probíhala v Evropě a srovnávala přípravek Qlaira (n = 399) s monofázickou konstrukcí EE 20 µg/levonorgestrel (LNG) 100 µg (n = 399) během 7 cyklů [22]. Tato studie primárně srovnávala kontrolu cyklu přípravkem Qlaira a EE 20 µg/LNG 100 µg. Současně byl sledován i počet těhotenství. Dvou evropských studií se zúčastnily ženy ve věku 18–50 let, studie prováděná v Severní Americe sledovala ženy ve věku 18–35 let. Hlavní vylučovací kritéria pro tyto tři studie se shodovala s obecnými kontraindikacemi a rizikovými faktory pro užívání COC.
Kombinovaná analýza dat získaných ze všech tří studií zjistila za období 880 950 dní užívání přípravku uživatelkami ve věku 18 až 50 let celkem 19 těhotenství. Tento počet odpovídá nekorigovanému Pearlovu indexu 0,79 (s horní mezí 1,23 při oboustranném 95% CI). Deset gravidit za 871 091 dní užívání bylo připsáno vlastnímu selhání metody – odpovídá korigovanému Pearlovu indexu 0,42 (s horní mezí 0,77 při oboustranném 95% CI). V podsouboru žen mezi 18 a 35 lety došlo k 18 těhotenstvím v průběhu 653 267 dní užívání – odpovídá nekorigovanému Pearlovu indexu 1,01 (s horní mezí 1,59 při oboustranném 95% CI). Devět gravidit v průběhu 644 328 dní bylo připsáno selhání metody odpovídající korigovanému Pearlovu indexu 0,51 (s horní mezí 0,97 při oboustranném 95% CI). Ačkoliv příčiny pozorovaných rozdílů v počtu těhotenství u žen do 35 let a u žen do 50 let nejsou zcela jasné, nejvýznamnějším faktorem bude pravděpodobně pokles přirozené fertility u starších žen.
Kontrola cyklu
Dle evropské dvojitě zaslepené studie, která srovnávala přípravek Qlaira s 20 µg ethinylestradiolu a 100 µg levonorgestrelu (EE 20 µg/LNG 100 µg) u žen ve věku 18–50 let po dobu 7 cyklů, je průměrná délka pseudomenstruačního krvácení u Qlairy signifikantně kratší než při užívání EE 20 µg/LNG 100 µg (p < 0,05 na každý cyklus); délka pseudomenstruačního krvácení se u Qlairy pohybovala od 4,1 do 4,7 dní a u EE 20 µg/LNG 100 µg od 5,0 do 5,2 dní. U přípravku Qlaira byla ve srovnání s EE 20 µg/LNG 100 µg nižší maximální intenzita pseudomenstruačního krvácení se signifikantně (p < 0,0001) vyšším podílem uživatelek Qlairy, které udávaly špinění či lehké krvácení, oproti ženám, které dostávaly EE 20 µg/LNG 100 µg [22]. Podíl žen s výskytem nepravidelného intermenstruačního krvácení byl podobný v obou skupinách (10,5–18,6 % žen na cyklus ve skupině s Qlairou a 9,9–17,1 % žen na cyklus s EE 20 µg/LNG 100 µg) [22]. Celkově je tedy možné považovat kontrolu cyklu u uživatelek Qlairy za velmi dobrou, odpovídající jiným přípravkům COC.
Vliv na metabolické a hemostatické parametry
Užívání přípravků obsahujících kom-binaci estrogenů a gestagenů (COC) je i u zdravých žen spojeno s lehce zvýšeným rizikem kardiovaskulárních příhod, převážně tromboembolických komplikací [23, 24]. Přestože příčina zvýšeného rizika kardiovaskulárních komplikací při užívání COC stále není jasná, velmi pravděpodobně souvisí s metabolickými a hemostatickými vlivy kombinovaných kontraceptiv. Mezi ně patří aktivace renin–angiotenzin–aldosteronového systému [25, 26], změny metabolismu lipidů a sacharidů [27] a vliv na hladiny koagulačních faktorů [27, 28].
Vliv Qlairy na metabolické a koagulační parametry sledovaly dvě klinické studie. V první byly uživatelky ve věku 18–50 let randomizovány do dvou skupin [29]. První skupina užívala Qlairu (n = 30), druhá trifázickou COC složenou z EE 30 µg/LNG 50 µg 1.–6. den, EE 40 µg/LNG 75 µg 7.–11. den, EE 30 µg/LNG 125 µg 12.–21. den a placeba 22.–28. den (n = 28). Studie trvala sedm cyklů a hodnotila, kromě jiných parametrů, změny v lipidovém spektru (HDL, LDL cholesterol), v koagulačních parametrech (markery aktivace koagulace – fragmenty protrombinu 1+2 a D-dimery) a v hladinách vazebných proteinů pro steroidní hormony. Užívání Qlairy bylo spojeno od počátku do sedmého cyklu se zvýšením HDL cholesterolu o 7,9 % Ī 22 % a s poklesem hladiny LDL cholesterolu o 6,5 % Ī 15,9 %. Příslušné změny u EE 30/40 µg/LNG 50/75/125 µg byly -2,3 % Ī 14 % pro HDL cholesterol a -3,0 % Ī 17,4 % pro LDL cholesterol. U ostatních lipidů byly v obou skupinách pozorovány méně významné změny. Ve skupině s Qlai-rou se hladiny protrombinových fragmentů 1+2 a hladiny D-dimerů zásadně nemě-nily (+0,6 % Ī 30 % a 2,1 % Ī 43,5 %), byly však významně změněné ve skupině EE 30/40 µg/LNG 50/75/125 µg (+117 % Ī 358 % a +62,9 % Ī 99,5 %). Nicméně v obou skupinách se koncentrace obou markerů pohybovaly v mezích normy. Změny ostatních koagulačních parametrů byly minimální v obou skupinách [29, 30].
Druhá ze studií probíhala po dobu tří týdnů a bylo do ní zařazeno 29 žen ve věku 18–50 let [31]. Jedná se o otevřenou studii, která srovnávala působení přípravku Qlai-ra s monofázickou konstrukcí EE 30 µg/LNG 150 µg. V obou skupinách se změny hladin protrombinu 1+2 významně nelišily (0,00 Ī 0,04 a +0,03 Ī 0,16 nmol/l). Užívání Qlairy však bylo spojeno se signifikantně menší změnou hladiny D-dimerů než užívání EE 30 µg/LNG 150 µg (+39 Ī 130 vs. +158 Ī 198 ng/ml; p = 0,01). Hladiny všech ostatních faktorů opět zůstávaly v mezích normy. Oba zkoumané režimy měly celkově jen malý vliv na antikoagulační parametry. Nicméně užívání Qlairy vedlo k méně vyjádřené změně rezistence na aktivovaný protein C (APC) než užívání EE 30 µg/LNG 150 µg (-0,04 Ī 0,28 vs. -0,08 Ī 0,40), které bylo provázeno APC senzitivitou překračující hranici normy [32].
Výsledky uvedených studií demonstrují pouze minimální vliv přípravku Qlaira na řadu metabolických a hemokoagulačních parametrů. Přestože užívání Qlairy i srovnávací COC (EE/LNG) vedlo k malým změnám většinou v rámci normálního rozmezí, zdá se, že vliv Qlairy na metabolické a koagulační ukazatele je ve srovnání s kombinovanou hormonální antikoncepcí obsahující EE/LNG slabší. K závěrům, zda bude Qlairu možné považovat za bezpečnější ve vztahu ke vzácným venózním i arteriálním tromboembolickým nežádoucím účinkům, bude třeba rozsáhlých několikaletých klinických a epidemiologických studií.
Vliv na vazebné proteiny pro steroidní hormony
Ve 28denní otevřené nekomparativní studii, která se zabývala farmakokinetickými vlastnostmi přípravku Qlaira, se hladiny sérového SHBG zvýšily zhruba o 40 %, zatímco koncentrace CBG zůstaly prakticky nezměněny [10]. V otevřené randomizované studii probíhající po dobu sedmi cyklů, která srovnávala přípravek Qlaira s trifázickým přípravkem s obsahem EE a LNG, stoupla hladina SHBG o 62,7 % ve skupině s Qlairou a o 111,6 % u EE + LNG [29]. Současně se zvýšila i koncentrace CBG, o 27,8 % u Qlairy a o 146,3 % u EE + LNG [30]. Z těchto údajů vyplývá, že Qlaira má jen minimální vliv na hladiny SHBG a CBG. Ve srovnání s předchozími studiemi s hormonálními kontraceptivy včetně monofázické konstrukce EE 30 µg/DNG 2 mg se zvýšení koncentrace SHBG a CBG pozorované u Qlairy zdá menší než u jiných kombinovaných kontraceptiv (170–320 %) [33–35]. Na druhou stranu zvýšení hladin sérového SHBG, a tím pokles hladin volných androgenů navozený přípravky COC, terapeuticky využíváme v managementu hyperandrogenního syndromu (PCOS).
Snášenlivost a výskyt nežádoucích účinků
Dle údajů z klinických studií byla většina žen, které užívaly Qlairu (79,4 %), spokojena nebo velmi spokojena [36]. Užívání Qlairy bylo spojeno s pozitivním vlivem na pocit duševního i fyzického zdraví. Většina žen (89,7–86,4 %) považovala svou psychickou (emoční) či fyzickou pohodu za stejnou, lepší, či dokonce za výrazně lepší ve srovnání se stavem před užíváním přípravku [20, 37].
Na základě kombinované analýzy údajů ze všech tří studií byly definovány čtyři nejčastěji se vyskytující nežádoucí účinky: napětí a citlivost prsů (4,9 %), nepravidelné krvácení (4,9 %), cefalea (3,1 %), akné (2,8 %) [37]. Naprostá většina nežádoucích účinků byla mírné či středně velké intenzity; závažné nežádouci účinky byly udávány pouze 2,5 % žen. Závažné nežádoucí účinky, u kterých byla alespoň nějaká možnost vztahu k medikaci, se objevily u 0,3 % žen a zahrnovaly fokální nodulární hyperplazii (n = 1), infarkt myokardu (n = 1), suspektní okulární histoplazmózu (n = 1), rupturu ovariální cysty (n = 2) a leiomyom dělohy (n = 1). Fatální nežádoucí účinky se vyskytly u méně než 0,1 % žen. Všechny fatální nežádoucí účinky nebyly považovány za vztahující se ke studijní medikaci [4]. Celkem kvůli nežádoucím účinkům předčasně přerušilo užívání přípravku Qlai-ra ve třech výše zmíněných studiích 10,1 % žen. Podíl žen, které přestaly s užíváním Qlairy z důvodu nepravidelného krvácení ve dvou evropských studiích, byl celkově velmi nízký a činil 0,0–2,5 %. V žádné ze tří studií (2266 žen) nebyla zaznamenána venózní tromboembolická příhoda [4].
Závěr
Qlaira jako první přípravek kombino-vané hormonální antikoncepce obsahující estradiol vykazuje vysokou spolehlivost, obdobnou jiným přípravkům COC, dobrou kontrolu cyklu a je velmi dobře tolerována. Dosud dostupná data ukazují, že její užívání je spojeno s nízkým výskytem méně závažných i závažných nežádoucích účinků. Zavedení Qlairy znamená další rožšíření spektra metod a možnost individualizace volby přípravku – mezi cílovou skupinu budou patřit ženy vyžadující maximálně přirozené přípravky, ženy v perimenopauzálním věku, ženy se sníženou tolerancí ethinylestradiolu. Zajímavé budou výsledky epidemiologických studií zaměřených na výskyt hlavně venózních tromboembolických nežádoucích účinků.
Seznam použité literatury
- [1] Dusterberg B, Nishino Y. Pharmacokinetic and pharmacological features of oestradiol valerate. Maturitas 1982; 4: 315–324.
- [2] Kuhnz W, Blode H, Zimmerman H. Pharmacokinetics of exogenous natural and synthetic estrogens and antiestrogens. In: Oettel M, Schillinger E, editors. Handbook of Experimental Pharmacology. Berlin, Springer 1999: 261–322.
- [3] Endrikat J, Parke S, Trummer D, et al. Ovulation inhibition with four variations of a four-phasic estradiol valerate/dienogest combined oral contraceptive: results of two prospective, randomized, open-label studies. Contraception 2008; 78: 218–225.
- [4] Data on File. Poskytnuta na vyžádání společností Bayer Schering Pharma.
- [5] Krattenmacher R. Drospirenone: pharmacology and pharmacokinetics of a unique progestogen. Contraception 2000; 62: 29–38.
- [6] Okada H, Nakajima T, Yoshimura T, et al. The inhibitory effect of dienogest, a synthetic steroid, on the growth of human endometrial stromal cells in vitro. Mol Hum Reprod 2001; 7: 341–347.
- [7] Sasagawa S, Shimizu Y, Nagaoka T, et al. Dienogest, a selective progestin, reduces plasma estradiol level through induction of apoptosis of granulosa cells in the ovarian dominant follicle without follicle-stimulating hormone suppression in monkeys. J Endocrinol Invest 2008; 31: 636–641.
- [8] Schleussner E, Michels W, Bethge S, Klinger G. Die Wirkung von Dienogest auf die hypothalamisch-hypophysäre Achse: Ergebnisse einer Pilotstudie. In: Teichmann A, editor. Dienogest-Prä-klinik und Klinik eines neuen Gestagens. New York, Walter de Gruyter 1995: 171–179.
- [9] Souhrn údajů o přípravku Qlaira. 14. 1. 2009.
- [10] Lu M, Uddin A, Foegh M, Zeun S. Pharmacokinetics and pharmacodynamics of a new four-phasic estradiol valerate and dienogest oral contraceptive. Obstet Gynecol 2007; 109 (Suppl.): 61S.
- [11] Sheridan MH, Scott LJ. Estradiol valerate/Dienogest in oral contraception. Drugs 2009; 69: 1635–1646.
- [12] Oettel M, Breitbarth H, Elger W, et al. The pharmacological profile of dienogest. Eur J Contracept Reprod Health Care 1999; 4 (Suppl. 1): 2–13.
- [13] Oettel M, Carol W, Elger W, et al. A 19-norprogestin without 17a-ethinyl group II: dienogest from a pharmacodynamic point of view. Drugs Today 1995; 31: 517–536.
- [14] Oettel M, Gräser T, Hoffmann H, et al. The pre-clinical and clinical profile of dienogest. A short overview. Drugs Today 1999; 35 (Suppl. C): 3–12.
- [15] Sasagawa S, Shimizu Y, Kami H, et al. Dienogest is a selective progesterone receptor agonist in transactivation analysis with potent oral endometrial activity due to its efficient pharmacokinetic profile. Steroids 2008; 73: 222–231.
- [16] Foster RH, Wilde MI. Dienogest. Drugs 1998; 56: 825–833; discussion 34–35.
- [17] Böcker R, Kleingeist B. Einfluss von Dienogest auf das humane Cytochrom P-450 – Enzymsystem in vitro. In: Teichmann A, editor. Dienogest-Präklinik und Klinik eines neuen Gestagens. New York, Walter de Gruyter 1995: 141–147.
- [18] Oettel M, Bervoas-Martin S, Elger W, et al. A 19-norprogestin without 17a-ethinyl group I: dienogest from a pharmacokinetic point of view. Drugs Today 1995; 31: 499–516.
- [19] Harada T, Momoeda M, Taketani Y, et al. Dienogest is as effective as intranasal buserelin acetate for the relief of pain symptoms associated with endometriosis – a randomized, double-blind, multicenter, controlled trial. Fertil Steril 2008.
- [20] Nahum GG, Parke S, Wildt L, et al. Efficacy and tolerability of a new oral contraceptive containing estradiol and dienogest. Obstet Gynecol 2008; 111 (Suppl.): 15S.
- [21] Nelson A, Sampson-Landers C, Parke S, Jensen J. Efficacy of estradiol valerate/dienogest OC: results of 3 large studies in North America and Europe. Obstet Gynecol: In press.
- [22] Parke S, Makalova D, Ahrendt HJ, Mansour D. Bleeding patterns and cycle control with a novel four-phasic combined oral contraceptive contain-ing estradiol valerate and dienogest. Eur J Contracept Reprod Health Care 2008; 13: 94–95.
- [23] Oral contraceptives and thromboembolism. IPPF Med Bull 1967; 1: 4.
- [24] Vessey MP, Doll R. Investigation of relation be-tween use of oral contraceptives and thromboembolic disease. Br Med J 1968; 2: 199–205.
- [25] Kang AK, Duncan JA, Cattran DC, et al. Effect of oral contraceptives on the renin angiotensin system and renal function. Am J Physiol Regul Integr Comp Physiol 2001; 280: R807–813.
- [26] Oelkers W, Helmerhorst FM, Wuttke W, Heithecker R. Effect of an oral contraceptive contain-ing drospirenone on the renin-angiotensin-aldosterone system in healthy female volunteers. Gynecol Endocrinol 2000; 14: 204–213.
- [27] Klipping C, Marr J. Effects of two combined oral contraceptives containing ethinyl estradiol 20 mg combined with either drospirenone or desogestrel on lipids, hemostatic parameters and carbohydrate metabolism. Contraception 2005; 71: 409–416.
- [28] Wiegratz I, Lee JH, Kutschera E, et al. Effect of four oral contraceptives on hemostatic parameters. Contraception 2004; 70: 97–106.
- [29] Parke S, Nahum GG, Mellinger U, Junge W. Metabolic effects of a new four-phasic oral contraceptive containing estradiol valerate and dienogest. Obstet Gynecol 2008; 111 (Suppl.): 12S–13S.
- [30] Parke S, Mellinger U, Junge W. Metabolic effect of an oral contraceptive based on natural estradiol (estradiol valerate/dienosgest), abstract No. 578072, 11th World Congress on Controversiers in Obstretrics, Gynecology and Infertility 2008.
- [31] Parke S, Junge W, Mellinger U, et al. Comparative effects of a four-phasic regimen of estradiol valerate/dienogest versus ethinylestradiol/levonorgestrel on haemostatic parameters. Hum Reprod 2008; 23 (Suppl. 1): i78–i79.
- [32] Klipping Ch, Junge W, Mellinger U, et al. Hemo-static effects of a novel four-phasic combined oral contraceptive containing estradiol valerate and dienogest (abstract No. P090). 10th Congress of the European Society of Contraception and Reproductive Health 2008.
- [33] Coenen CM, Thomas CM, Borm GF, et al. Changes in androgens during treatment with four low-dose contraceptives. Contraception 1996; 53: 171–176.
- [34] Wiegratz I, Jung-Hoffmann C, Kuhl H. Effect of two oral contraceptives containing ethinylestradiol and gestodene or norgestimate upon an-drogen parameters and serum binding proteins. Contraception 1995; 51: 341–346.
- [35] Wiegratz I, Kutschera E, Lee JH, et al. Effect of four different oral contraceptives on various sex hormones and serum-binding globulins. Contraception 2003; 67: 25–32.
- [36] Ahrendt HJ, Makalová D, Parke S, et al. Bleeding pattern and cycle control with an estradiol-based oral contraceptive: a seven-cycle, randomized comparative trial of estradiol valerate/dienogest and ethinyl estradiol/levonorgestrel. Contraception 2009; 80: 436–444.
- [37] Zeun S, Lu M, Uddin A, et al. Pharmacokinetics of an oral contraceptive containing oestradiol valerate and dienogest. Eur J Contracept Reprod Health Care 2009; 14: 221–232.