Exenatid QW v předplněném peru
Souhrn:
Exenatid QW je depotní forma molekuly exenatidu s podáváním 1× týdně, která je inkorporována do mikrosfér. Z mikrosfér se aktivní substance uvolňuje po subkutánní aplikaci velmi pomalu. Série studií DURATION potvrdila dobrou účinnost a snášenlivost exenatidu QW. Pro některé diabetiky je bariérou injekční podání přípravku. Navíc původní aplikační forma je pro pacienty složitá a někteří z nich potřebovali při přípravě injekce pomoc druhé osoby. Do klinické praxe je nyní uváděna nová, jednodušší aplikační forma v předplněném peru.
Key words: diabetes mellitus – exenatide QW – prefilled pen.
Summary:
Exenatide QW is a depot form for once weekly administration, in which the molecule of exenatide is incorporated into microspheres. Active substance is released very slowly from the microspheres after subcutaneous application. The results of series of studies called DURATION confirmed good effectiveness and tolerance of exenatide QW. Some of the patients have problems with the injection form of administration. Moreover, the original application form is complicated for patients – some of them needed help of another person during the preparation of injections. Nowadays, a new, simpler application form is being marketed.
V léčbě diabetu 2. typu se hledají nové možnosti rozšíření terapie, které by dopomohly k dosažení normoglykemie při co nejmenším množství nežádoucích účinků. V posledních několika letech se do popředí zájmu dostaly nové léky na bázi inkretinů [1], které mají velký léčebný potenciál s minimálním rizikem vzniku hypoglykemie.
Za fyziologických podmínek jsou po jídle uvolňovány přirozené peptidy (inkretiny) – glukagonu podobný peptid 1 (glucagon‑like peptide‑1, GLP‑1) a glukózo‑dependentní inzulinotropní polypeptid (GIP), které stimulují inzulinovou sekreci. Inkretin GLP‑1 je uvolňován L‑buňkami střevní sliznice po příjmu potravy a v závislosti na výši glykemie zvyšuje sekreci inzulinu a potlačuje sekreci glukagonu. Glukózo‑dependentní účinek zajišťuje nízké riziko hypoglykemií. Dále má GLP‑1 řadu extrapankreatických účinků, kterými může příznivě ovlivnit glykemii. Ovlivňuje chuť k jídlu, zpomaluje vyprazdňování žaludku, tím působí i na tělesnou hmotnost. Jako peptid je ale GLP‑1 ve střevě rychle rozkládán enzymem dipeptidylpeptidázou 4 (DPP‑4) a má krátký biologický poločas (minuty). Na periferii je jeho účinek zprostředkován aktivací receptorů pro GLP‑1.
Skupina léků, které jsou dnes již běžně používány, působí jako agonisté receptorů pro GLP‑1. Váží se na inkretinové receptory, ale nejsou odbourávány. Tyto přípravky musejí být jako všechny peptidy aplikovány výhradně podkožně. Podkožní aplikace agonistů receptorů pro GLP‑1 může být překážkou v compliance pacientů. Proto jsou stávající molekuly upravovány tak, aby se jejich účinek prodlužoval a nutnost injekční aplikace byla co nejmenší.
Exenatid QW
Exenatid QW je zatím na trhu jediným dostupným agonistou receptoru pro GLP‑1 s prodlouženým účinkem [2]. Ostatní přípravky ze stejné skupiny si pacient musí aplikovat 1× nebo 2× denně. Předpokládá se, že exenatid QW, který se aplikuje 1× týdně, by měl zvýšit pohodlí pacienta a zlepšit jeho adherenci k léčbě. Exenatid je zde zabudován do polylaktid‑co‑glykolových (PLG) mikrosfér [3]; PLG je běžný biologicky degradovatelný polymer (rozloží se na CO2 a vodu), který umožňuje postupné uvolňování léčiva kontrolovanou rychlostí. Technologií mikrosfér se v porovnání s podáním exenatidu 2× denně dosahuje nepřetržité expozice léku s minimálními výkyvy plazmatických koncentrací. Účinek nastupuje po dvou týdnech a ustáleného stavu je dosaženo po 6–8 týdnech. Pokud by se stalo, že si pacient zapomene přípravek aplikovat, udrží se účinná koncentrace ještě dlouhou dobu. Další výhodou pozvolného nástupu účinku je, že na rozdíl od krátkodobě působících přípravků není třeba titrovat dávku, aby se předešlo nežádoucím účinkům hlavně v oblasti gastrointestinálního traktu. Účinek přetrvávající po dobu 6–8 týdnů je ale třeba zohlednit v takových situacích, jako je např. plánovaný operační výkon nebo otěhotnění pacientky v průběhu léčby.
Bezpečnost léčby
Zvláštní pozornost si zaslouží reakce v místě vpichu. U pacientů léčených exenatidem QW se objevovalo svědění v místě vpichu častěji než u pacientů léčených exenatidem aplikovaným 2× denně (6,4 % vs. 1,1 %) [4]. Je však třeba zdůraznit, že bezpříznakové subkutánní nodulární formace v místě vpichu jsou očekávaným jevem spojeným s použitou aplikační technologií. Při léčbě exenatidem QW jsou v podkoží obvykle patrné malé uzlíky, které se běžně zhojí bez lékařské intervence a nijak neinterferují s průběhem léčby. Podle některých studií se uzlíky objevují až u 77 % pacientů a průměrné trvání tohoto jevu je 27 dní. Uzlíky bývají průměrné velikosti 0,5–0,75 cm.
Nežádoucí účinky provázely léčbu exenatidem QW méně často, než tomu bylo u exenatidu podávaného 2× denně. Nejčastějšími nežádoucími účinky byly u obou přípravků shodně nauzea (18,8 % exenatid QW vs. 34,7 % exenatid 2× denně), průjem (12,4 % vs. 9,0 %), zvracení (7,0 % vs. 14,2 %). Dalšími častějšími příznaky byly bolest hlavy a nazofaryngitida. Celkově však léčbu pro nežádoucí účinky ukončilo pouze 5,5 % pacientů. Nejčastěji byla léčba ukončena pro nauzeu a zvracení, proto není doporučováno podávání exenatidu při závažnějších gastrointestinálních onemocněních.
Bezpečnost podávání exenatidu QW je dle dostupných studií podobná jako u exenatidu aplikovaného 2× denně [5]. Největší výhodou těchto přípravků je nízké riziko hypoglykemií. Bylo srovnatelné s ostatními neinzulinovými komparátory, pioglitazonem a sitagliptinem. Léčba exenatidem QW nebyla spojena s vyšším rizikem hypoglykemie, pokud nebyla kombinována s léčbou deriváty sulfonylurey či s léčbou inzulinem [6]. Všechny tyto výsledky byly shrnuty v souboru studií DURATION-1–6 (Diabetes Therapy Utilization Researching Changes in A1C, Weight and Other Factors Through Intervention with Exenatide ONce Weekly), tab. 1 [7–11]. Doporučená dávka exenatidu QW je 2 mg týdně.
Zvýšená pozornost je stejně jako u všech ostatních agonistů receptorů pro GLP‑1 a inhibitorů DPP‑4 věnována výskytu pankreatitid [12]. Zmínky o jejich možném zvýšeném výskytu se objevily již při léčbě exenatidem podávaným 2× denně. Z rozsáhlých epidemiologických studií vyplývá, že definitivní kauzální vztah mezi pankreatitidou a léčbou exenatidem nebyl potvrzen. Doporučuje se však po potvrzení diagnózy pankreatitidy exenatid QW stejně jako ostatní přípravky 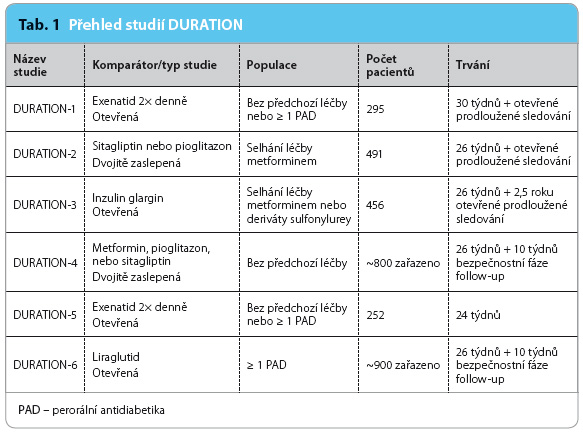 založené na inkretinovém účinku nepodávat.
založené na inkretinovém účinku nepodávat.
Exenatid s dávkováním 2× denně (Byetta®) je podáván aplikátorem podobným inzulinovým perům. Exenatid QW (Bydureon®) byl dosud podáván formou jednorázové subkutánní injekce. K tomu účelu je k dispozici předpřipravený kit, který obsahuje ampulku se suchým práškem exenatidu QW, adaptér a injekci s ředicím roztokem. Příprava injekce vyžaduje určitou zručnost, zejména při manipulaci s adaptérem. Proto byla vyvinuta nová aplikační forma v podobě jednorázového dvoukomorového pera Bydureon Dual‑Chamber Pen® [13]. Manipulace je zde významně jednodušší a diskrétnější.
Pero je o něco větší než běžné aplikátory inzulinu. Důvodem je jeho dvoukomorové provedení, kdy jedna komora obsahuje prášek, druhá diluční roztok. Jinak je pero podobné aplikátorům, které známe z distribuce ostatních přípravků (inzulin, agonisté receptoru pro GLP‑1, růstový hormon). Má vizuální, zvukové a hmatové ukazatele, které pomáhají při aplikaci i zrakově postiženým pacientům. Pero se skládá ze tří částí, které tvoří předplněná dvoukomorová zásobní vložka, samotné pero a jehla (obr. 1). Dvoukomorová vložka má suchou a mokrou část a smísení obsahu obou komor 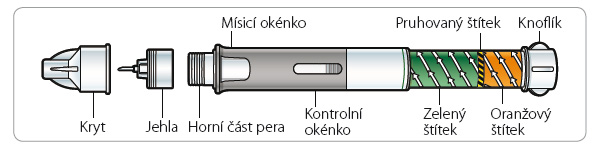 iniciuje až pacient. Pero má velikost 225 mm × 28 mm, je dobře uchopitelné i pro méně zručné pacienty. Speciálně navržená jehla o velikosti 7 mm, 23 G je navržena tak, aby bylo minimalizováno riziko jejího ucpání suspenzí.
iniciuje až pacient. Pero má velikost 225 mm × 28 mm, je dobře uchopitelné i pro méně zručné pacienty. Speciálně navržená jehla o velikosti 7 mm, 23 G je navržena tak, aby bylo minimalizováno riziko jejího ucpání suspenzí.
Správný postup pro použití je následující: před použitím pero vyjmeme z chladničky a mělo by být ohřáto na teplotu v místnosti (doporučuje se nejméně 15 minut ponechat pero při pokojové teplotě). Poté nejprve našroubujeme jehlu obvyklým způsobem. Pero držíme jehlou vzhůru a otáčením knoflíku na jeho druhém konci začínáme s mísením dilučního roztoku a suspenze mikrosfér. Píst má dvě barevně odlišené části. S pokračujícím otáčením postupně zmizí zelená část a cvaknutí potvrdí, že tato část přípravy pera k aplikaci je úspěšně ukončena. Poté by měl pacient třepat perem proti dlani (doporučuje se cca 80×), aby bylo dosaženo homogenní směsi. Pacient si kontroluje kvalitu směsi ještě vizuálně v průhledu na obou stranách pera. Jakmile je směs dostatečně rozmíchána, drží pacient pero opět jehlou vzhůru a otáčí knoflíkem na pístu tak dlouho, až zmizí jeho oranžová část. Tato fáze slouží k vypuzení přebytečného vzduchu. Jakmile zmizí oranžová část pístu, objeví se aplikační knoflík. Pero je nyní připraveno k použití. Poté již pacient aplikuje lék jako standardní exenatid QW do podkoží zmáčknutím aplikačního knoflíku. Ukončení aplikace je signalizováno hmatovým a zvukovým vjemem (slyšitelné cvaknutí). Pacient by měl jehlu v podkoží podržet přibližně 10 sekund, aby roztok nevytekl.
Shrnutí
Exenatid QW je přípravek, který významně snižuje lačnou i postprandiální glykemii s minimálním rizikem vzniku hypoglykemií. Snižuje chuť k jídlu, zvyšuje pocit plnosti žaludku a tím významně ovlivňuje tělesnou hmotnost. Díky pozvolnému nástupu účinku je léčba provázena menším rizikem nežádoucích účinků, než je tomu při podávání krátce působících přípravků, a není třeba titrace dávky v úvodu léčby. Poslední studie prokazují dlouhodobou (až šestiletou) bezpečnost a účinnost tohoto přípravku. Nové praktické dvoukomorové pero Bydureon Dual‑Chamber Pen® by mělo pacientům usnadnit aplikaci léčiva a umožnit jeho podávání bez nutnosti pomoci druhé osoby, jak se to někdy stávalo u předchozí aplikační formy.
Podpořeno MZ ČR – RVO („Institut klinické a experimentální medicíny – IKEM, IČ 00023001“).
Seznam použité literatury
- [1] Butler PC, Elashoff M, Elashoff R, Gale EA. A critical analysis of the clinical use of incretin based therapies: Are the GLP 1 therapies safe? Diabetes Care 2013; 36: 2118–2125.
- [2] Scott LJ. Exenatide extended release. A review of its use in type 2 diabetes mellitus. Drugs 2012; 72: 1679–1707.
- [3] De Young MB, MacConell L, Sarin V, et al. Encapsulation of exenatide in poly (DL Lactide Co glycolide) microspheres produced an investigational long acting on-ce weekly formulation for type 2 diabetes. Diabetes Technol Ther 2011; 13: 1–10.
- [4] Bergenstal RM, Wysham C, Macconell L, et al. Efficacy and safety of exenatide once weekly versus sitagliptin or pioglitazone as an adjunct to metformin for treatment of type 2 diabetes (DURATION 2): a randomised trial. Lancet 2010; 376: 431–439.
- [5] Drucker DJ, Buse JB, Taylor K, et al. For DURATION 1 Study Group. Exenatide once weekly versus twice daily for the treatment of type 2 diabetes: a randomised, open label, non inferiority study. Lancet 2008; 372: 1240–1250.
- [6] Davis M, Heller S, Sreenan S, et al. Once weekly exenatide versus once or twice daily insulin detemir. Randomized, open label, clinical trial efficacy and safety in patients with type 2 diabetes treated with metformin alone or in combination with sulfonylureas. Diabetes Care 2013; 36: 1368–1376.
- [7] Russell Jones D, Cuddihy RM, Hanefeld M, et al. Efficacy and safety of exenatide once weekly versus metformin, pioglitazone and sitagliptin used as monotherapy in drug naive patients with type 2 diabetes (DURATION 4): A 26 week double blind study. Diabetes Care 2012; 35: 252–258.
- [8] Blevins T, Pullman J, Malloy J, et al. DURATION 5: exenatide once weekly resulted in greater improvements in glycemic control compared with exenatide twice daily in patients with type 2 diabetes. J Clin Endocrinol Metab 2011; 96: 1301–1310.
- [9] Buse JB, Nauck M, Forst T, et al. Exenatide once weekly versus liraglutide once daily in patients with type 2 diabetes (DURATION 6): a randomised, open label study. Lancet 2013; 381: 117–124.
- [10] Klein E, Henry RR, Malloy J, et al. DURATION 1 extension: Efficacy and tolerability of exenatide once weekly over 6 years in patient with T2DM. 74th Scientific Sessions of the American Diabetes Association, San Fransisco, California, June 13–17, 2014, OP 13.
- [11] Diamant M, Van Gaal L, Stranks S, et al. Once weekly exenatide compared with insulin glargine titrated to target in patients with type 2 diabetes (DURATION 3): an open label randomised trial. Lancet 2010; 375: 2234–2243.
- [12] Garg R, Chen W, Pendegrass M. Acute pancreatitis in type 2 diabetes treated with exenatide or sitagliptin: a retrospective observational pharmacy claims analysis. Diabe-tes Care 2010; 33: 2340–2354.
- [13] LaRue S, Malloy J. Evaluation of the Dual Chamber Pen design for the injection of exenatide once weekly for the treatment of type 2 diabetes. J Diabetes Sci Technol 2015; 9: 815–821.