Fidaxomicin
Toxigenní Clostridium difficile je nejčastějším původcem střevních infekcí u hospitalizovaných. Četnost a závažnost těchto onemocnění včetně vysoké mortality v posledním desetiletí významně vzrostly, a to hlavně v návaznosti na výskyt hypervirulentních kmenů C. difficile. Terapeutické ovlivnění infekce má svá úskalí, především v ne vždy spolehlivém efektu standardní léčby a vysokém podílu rekurencí. Fidaxomicin je nové antibiotikum se selektivním působením na C. difficile. K jeho přednostem, kromě vysoké klinické účinnosti, patří snížený výskyt rekurencí.
Úvod
Clostridium difficile, sporulující anaerobní bakterie, je u vnímavých jedinců původcem různě závažných střevních infekcí. Onemocnění je v mezinárodní terminologii označováno zkratkou CDI (Clostridium difficile Infection). CDI postihující nemocniční pacienty představuje závažný zdravotnický problém, který získal na aktuálnosti počátkem tohoto tisíciletí. Nebývalý počet těchto infekcí charakterizovaných často těžkým průběhem a vysokou mortalitou byl zprvu zaznamenán v Kanadě, následně se podobné problémy vyskytly v dalších lokalitách včetně většiny evropských zemí [1]. Klasifikace izolátů C. difficile na molekulární úrovni vychází nejčastěji z pulzní elektroforézy nebo PCR ribotypizace. K velmi obávaným a historicky v souvislosti s těžkými formami CDI prvně popsaným patří PCR ribotyp 027. Jeho virulence je podmíněna produkcí značných kvant toxinů A a B, které mají klíčový význam v patogenezi onemocnění. V současné době je celosvětově identifikováno mnoho dalších hypervirulentních epidemicky se vyskytujících ribotypů. V ČR byl například v některých oblastech identifikován ribotyp 176, někdy označovaný jako
„027 like“ právě kvůli svým podobným genetickým a biologickým charakteristikám [2]. Spektrum klinických příznaků CDI se pohybuje od banálního průjmu po těžkou kolitidu, případně její pseudomembranózní formu, pro kterou je přítomnost toxigenního C. difficile vysoce specifická. Výjimkou není ani paralytický ileus s rizikem toxického magacolon, možností sekundární sepse a s ohrožením života [3].
Nepříznivý je rovněž častý výskyt rekurencí, který dosahuje v průměru 20–30 % a přináší pro pacienta nemalou psychickou i fyzickou zátěž, stejně jako podstatně zvyšující se ekonomické náklady na opakovanou léčbu.
Terapie CDI vyžaduje komplexní přístup, jehož součástí je podání antibiotika volby. Dosavadní doporučení se vesměs shodují ve výběru těchto přípravků:u lehčích a středně těžkých forem CDI je to perorální nebo intravenózní metronidazol (500 mg třikrát denně po dobu 10–14 dnů), v případě těžkého průběhu vankomycin per os (125 mg čtyřikrát denně po dobu 10–14 dnů), u ileózních stavů je jeho aplikace možná klyzmatem nebo nazogastrickou či nazojejunální sondou. Z dalších léčebných možností lze uvést rifaximin, teikoplanin, nitazoxanid nebo tigecyklin. V léčbě úporných rekurencí se kromě podání antibiotik uplatňují další přístupy, z nichž se jako nejefektivnější jeví fekální bakterioterapie [4,5].
Důležitou podmínkou pro uzdravení pacienta je přerušení případné antibiotické léčby, pokud je to možné. Právě předchozí nebo souběžné podání antibiotik je hlavním rizikovým faktorem vzniku CDI. Inhibice přirozené střevní mikroflóry, kterou antibiotika různou měrou navozují, vytváří příznivé prostředí pro přemnožení C. difficile s produkcí toxinů a následným ohrožením vnímavých osob.
Závažnost a s ní související vysoká mortalita [6] stejně jako možné selhání standardní léčby nebo časté rekurence jsou důvody vedoucími k hledání dalších terapeutických možností.
Fidaxomicin
![Obr. 1 Chemický strukturní vzorec fidaxomicinu; podle [8] – Epstein, et al., 2012.](https://www.remedia.cz/photo-a-29008---.jpg) Fidaxomicin je fermentační produkt tiacumicinu, který byl izolován jako metabolit půdní aktinomycety Dactylospor-
Fidaxomicin je fermentační produkt tiacumicinu, který byl izolován jako metabolit půdní aktinomycety Dactylospor-
angium auranticum. Chemicky se jedná o 18člennou makrocyklickou sloučeninu rozpustnou ve vodě (obr. 1). Antibakteriální účinek je podmíněn dvěma mechanismy – kromě inhibice transkripce DNA je stěžejní inhibice RNA transkripce sigma podjednotky RNA polymerázy. Tímto mechanismem působení se fidaxomicin liší od makrolidových antibiotik, s nimiž je chemickou strukturou příbuzný [7].
Antimikrobiální aktivita a rezistence
I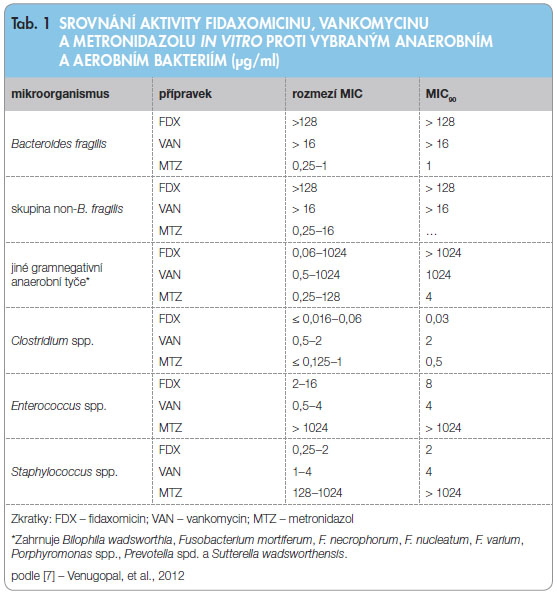 n vitro vykazuje fidaxomicin na C. difficile baktericidní účinnost, která intenzitou a rychlostí předčí účinnost vankomycinu [8]. Hodnoty MIC získané na velkých souborech testovaných kmenů C. difficile se pohybují v rozmezí ? 0,03–1 µg/ml, MIC90 je podle dostupných studií 0,25–0,5 µg/ml [7, 8]. Trvání postantibiotického efektu dosahuje v průměru 5,5–10 hodin. Účinnost na většinu dalších bakterií je omezená, ať již se jedná o enterobakterie, enterokoky, bakteroidy či další mikroorganismy, které jsou součástí přirozené střevní mikroflóry. Výjimkou jsou další druhy klostridií. Srovnání antibakteriální účinnosti fidaxomicinu, vankomycinu a metronidazolu na některé skupiny bakterií uvádí tab. 1.
n vitro vykazuje fidaxomicin na C. difficile baktericidní účinnost, která intenzitou a rychlostí předčí účinnost vankomycinu [8]. Hodnoty MIC získané na velkých souborech testovaných kmenů C. difficile se pohybují v rozmezí ? 0,03–1 µg/ml, MIC90 je podle dostupných studií 0,25–0,5 µg/ml [7, 8]. Trvání postantibiotického efektu dosahuje v průměru 5,5–10 hodin. Účinnost na většinu dalších bakterií je omezená, ať již se jedná o enterobakterie, enterokoky, bakteroidy či další mikroorganismy, které jsou součástí přirozené střevní mikroflóry. Výjimkou jsou další druhy klostridií. Srovnání antibakteriální účinnosti fidaxomicinu, vankomycinu a metronidazolu na některé skupiny bakterií uvádí tab. 1.
Metabolit fidaxomicinu OP-1118, vznikající působením enzymů střevních buněk a hydrolýzou žaludečními kyselinami, si zachovává srovnatelnou antibakteriální aktivitu. Selektivní účinek na klostridie je považován za jednu ze stěžejních výhod fidaxomicinu. Tato vlastnost, stejně jako intenzivní baktericidní aktivita, je možnou, ale zatím ne zcela ověřenou příčinou snížené frekvence rekurencí u pacientů léčených fidaxomicinem ve srovnání s vankomycinem a metronidazolem [9].
Cílený účinek na klostridie má nepochybně příznivý epidemiologický aspekt a tím je minimalizace vzniku rezistence u střevních mikroorganismů. Naopak vankomycin ani metronidazol nejsou v tomto ohledu bez rizika, a to zejména ve vztahu k výskytu VRE (Vancomycin Resistant Enterococci) [7, 9].
Pravděpodobnost vzniku rezistence C. difficile k fidaxomicinu testovaná v laboratorních podmínkách se ukázala jako velmi nízká. Rovněž se neprokázala zkřížená rezistence s makrolidy, rifamyciny ani s dalšími skupinami antibiotik [8].
Farmakokinetika
Fidaxomicin se po perorální aplikaci koncentruje ve stolici, kde dosahuje zhruba pětisetnásobku MIC90 pro C. difficile. Vzhledem k velmi omezené absorpci přípravku v zažívacím traktu je při standardní terapeutické dávce 400 mg denně biologická dostupnost minimální s průměrnými sérovými hladinami 22,8–26,5 ng/ml. Koncentrace ve stolici ani sérové hladiny nejsou ovlivněny příjmem potravy [9]. Riziko kumulace léku nebylo potvrzeno. V moči nejsou fidaxomicin ani jeho aktivní metabolit OP-1118 detekovatelné [7].
Klinická účinnost
Klinický efekt fidaxomicinu, hodnocený v několika rozsáhlých studiích, prokázal, že fidaxomicin není inferiorním
lékem ve srovnání s vankomycinem, s účinností mírně převyšující 90 % včetně CDI vyvolaných hypervirulentním ri-
botypem 027 [7, 8, 10]. U skupiny pacientů, u nichž nebylo možno přerušit konkomitantní podávání antibiotik vzhledem k závažnosti základního onemocnění, byl klinický efekt fidaxomicinu oproti vankomycinu významně vyšší [11]. Další signifikantní rozdíl je ve frekvenci rekurencí, ta je zhruba o 50 % nižší než při léčbě vankomycinem [7, 8].
Nežádoucí účinky a lékové interakce
Fidaxomicin je obecně dobře tolerován. Nejčastější vedlejší účinky zahrnují nauzeu, zvracení (6–10 %), ostatní, jako je bolest břicha, krvácení ze zažívacího traktu, závratě a exantém, se udávají s nižší frekvencí. V závažnosti a četnosti výskytu těchto projevů nebyl zjištěn signifikantní rozdíl mezi pacienty léčenými fidaxomicinem a vankomycinem [8].
Úprava dávky není třeba v závislosti na věku, hmotnosti, ani u renálního či jaterního selhání. Zásadní lékové interakce nebyly popsány, pouze mírně zvýšené sérové hladiny fidaxomicinu byly detekovány při současné medikaci cyklosporinem, ale i tyto koncentrace se pohybovaly v ng/ml, tedy na úrovni vylučující systémové působení [7, 9].
Terapeutické indikace, dávka a registrace
Fidaxomicin jako lék se selektivním účinkem má jedinou indikaci a tou je léčba CDI. Předmětem diskuse jistě je a bude určení pozice tohoto léku ve vztahu k současné standardní antibiotické léčbě CDI (metronidazol, vankomycin). Na základě výše uvedených vlastností fidaxomicinu se v současnosti uvádějí dvě skupiny pacientů s předpokládaným přínosem léčby. Jednak vysoce ohrožení nemocní s primoinfekcí, u kterých je míra rizika dána věkem, komorbiditami, paralelní antibiotickou léčbou, případně dalšími definovanými faktory, a dále ti, u kterých se již rekurence s těžkým průběhem vyskytla a je obava z dalších atak onemocnění [12].
Standardní léčbu fidaxomicinem představuje dávka 200 mg 2krát denně per os po dobu 10 dní. FDA registrovala lék ve formě 200mg tablet pro perorální podání v květnu 2011 a též poskytla fidaxomicinu status „orphan drug" v indikaci pro použití u pediatrických pacientů (< 16 let). Evropská komise (EMA) registrovala fidaxomicin v prosinci roku 2011. Uvolnění přípravku pro evropský trh se očekává postupně v tomto kalendářním roce.
Závěr
Fidaxomicin se na základě úspěšných laboratorních zkoušek a klinických studií zařadil mezi základní léky v terapii CDI. Dosavadní zkušenosti ukazují na značný léčebný potenciál, který lze spatřovat ve vysoké klinické účinnosti a ve srovnání s ostatními léky volby v redukovaném výskytu rekurencí. V době, kdy je v řadě zdravotnických zařízení v ČR registrována narůstající incidence komplikovaných forem CDI, je tento lék významným rozšířením terapeutických možností i v našich podmínkách.
Použité zkratky:
CDI – Clostridium difficile Infection
EMA – European Medicine Agency
FDA – Food and Drug Administration
MIC – minimální inhibiční koncentrace
MIC90 – minimální inhibiční koncentrace inhibující 90 % testovaných kmenů příslušného bakteriálního druhu
VRE – Vancomycin Resistant Enterococci
Seznam použité literatury
- [1] Cartman ST, Heap JT, Kuehne SA, et al. The emergence of ‘hypervirulence’ in Clostridium difficile. Int J Med Microbiol 2010; 300: 387–395.
- [2] Nyč O, Pituch H, Matějková J, et al. Clostridium difficile PCR ribotype 176 in the Czech Republic and Poland. Lancet 2011; 377: 1407.
- [3] Beneš J. Kolitida vyvolaná Clostridium difficile. In: Beneš J. Infekční lékařství. 1. vydání. Praha, Galén 2009: 271–273.
- [4] Bauer MP, Kuijper EJ, van Dissel JT. European Society of Clinical Microbiology and Infectious Diseases (ESCMID): treatment guidance document for Clostridium difficile infection (CDI). Clin Microbiol Inf 2009; 15: 1067–1079.
- [5] Polák P, Freibergerová M, Husa P, et al. První zkušenosti s fekální bakterioterapií v léčbě relabující pseudomembranózní kolitidy způsobené Clostridium difficile. Klin Mikrobiol Inf Lék 2011; 17: 214–217.
- [6] Centers for Disease Control and Prevention (CDC). Vital signs: preventing Clostridium difficile infections. MMWR Morb Mortal Wkly Rep 2012; 61: 157–162.
- [7] Venugopal AA, Johnson S. Fidaxomicin: a novel macrocyclic antibiotic approved for treatment of Clostridium difficile infection. Clin Infect Dis 2012; 54: 568–574.
- [8] Epstein L, Golan Y. Fidaxomicin. A new treatment for Clostridium difficile infections. Drugs Today 2012; 48: 101–108.
- [9] Lancaster JW, Matthews SJ. Fidaxomicin: the newest addition to the armamentarium against Clostridium difficile infections. Clin Ther 2012; 34: 1–13.
- [10] Cornely OA, Crook DW, Esposito R, et al. For the OPT-80-004 Clinical Study Group. Fidaxomicin versus vancomycin for infection with Clostridium difficile in Europe, Canada, and the USA: a double-blind, non-inferiority, randomised controlled trial. Lancet Infect Dis 2012; 12: 281–289.
- [11] Mullane KM, Miller MA, et al. Efficacy of fidaxomicin versus vancomycin as therapy for Clostridium difficile infection in individuals taking concomitant antibiotics for other concurrent infections. Clin Infect Dis 2011; 53: 440–447.
- [12] Wilcox MH. Progress with a difficult infection. Lancet Infect Dis 2012; 12: 256–257.