Fingolimod
Fingolimod (FTY720) je perorální modulátor sfingosin-1-fosfátových (S1P) receptorů s unikátním mechanismem účinku. Odhaluje nový přístup k léčbě roztroušené sklerózy (RS). Redukce exprese receptorů S1P1 snižuje únik lymfocytů z lymfatických uzlin. Tím dochází k ovlivnění cirkulace prozánětlivých lymfocytů, omezení jejich vstupu do centrálního nervového systému a k redukci patologické autoimunitní odpovědi vedoucí k rozvoji onemocnění RS. FTY720 se stává prvním perorálním imunomodulačním preparátem, který ovlivňuje klinickou aktivitu RS, dokumentovanou snížením počtu relapsů, snížením invalidity i zlepšením nálezu na magnetické rezonanci.
Úvod
Roztroušená skleróza mozkomíšní (RS) je chronicky probíhající zánětlivé, demyelinizační a neurodegenerativní onemocnění. Předpokládá se, že v etiopatogenezi sehrává klíčovou úlohu autoimunitní imunopatologická aktivita, která je charakterizována jako zhroucení imunitní tolerance závislé na genetické dispozici, spouštěcích faktorech zevního prostředí a na poruše imunitní regulace [1]. Aktivita onemocnění se projevuje ložisky zánětu, poškozením myelinu, degenerací nervových buněk, oligodendrocytů, astrocytů a dalších mikrogliálních elementů. Proces vede k 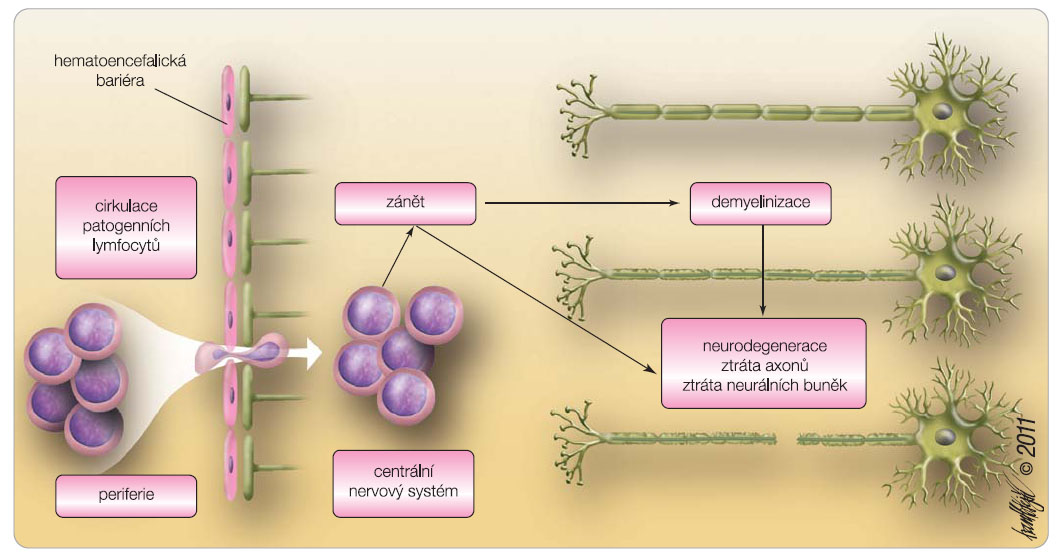 definitivnímu zničení axonů a k zániku neuronů. Počáteční průběh bývá v 80–85 % charakterizován atakovitým vzplanutím autoimunitní patologie a vyznačuje se narůstajícím neurologickým deficitem, který často během několika let invalidizuje nemocné. V patogenezi se promítají zánětlivé i neurodegenerativní pochody, které probíhají od časných stadií nemoci [2]. Histopatologické poznatky prokazují vznik definitivního postižení nervových struktur již v prvních letech onemocnění, což mění postoj k terapeutickému algoritmu. Je snaha zahájit léčbu co nejdříve se záměrem modifikovat průběh onemocnění v době ještě reverzibilních změn. Probíhá intenzivní výzkum léčebných možností. Ideálem je lék, který by eliminoval autoimunitní zánět i neurodegenerativní proces a tím ovlivnil dlouhodobý průběh choroby a měl současně i neuroprotektivní charakter, viz obr. 1. Vývoj ověřený náročnými klinickými studiemi přináší nové poznatky a dostává se až na molekulární úroveň léčiv a jejich účinků. Objev fingolimodu, perorálního imunomodulačního preparátu, otvírá nový přístup k léčbě RS.
definitivnímu zničení axonů a k zániku neuronů. Počáteční průběh bývá v 80–85 % charakterizován atakovitým vzplanutím autoimunitní patologie a vyznačuje se narůstajícím neurologickým deficitem, který často během několika let invalidizuje nemocné. V patogenezi se promítají zánětlivé i neurodegenerativní pochody, které probíhají od časných stadií nemoci [2]. Histopatologické poznatky prokazují vznik definitivního postižení nervových struktur již v prvních letech onemocnění, což mění postoj k terapeutickému algoritmu. Je snaha zahájit léčbu co nejdříve se záměrem modifikovat průběh onemocnění v době ještě reverzibilních změn. Probíhá intenzivní výzkum léčebných možností. Ideálem je lék, který by eliminoval autoimunitní zánět i neurodegenerativní proces a tím ovlivnil dlouhodobý průběh choroby a měl současně i neuroprotektivní charakter, viz obr. 1. Vývoj ověřený náročnými klinickými studiemi přináší nové poznatky a dostává se až na molekulární úroveň léčiv a jejich účinků. Objev fingolimodu, perorálního imunomodulačního preparátu, otvírá nový přístup k léčbě RS.
Charakteristika fingolimodu a sfingosin-1-fosfátu
Fingolimod je imunosupresivní imunomodulační látka. Je odvozena od báze myriocinu, který byl získán z kultury houby Isaria sinclairii, viz obr. 2. Bujón z této houbičky fungoval v čínské medicině jako elixír mládí [3]. Myriocin prokazuje pozitivní imunosupresivní účinky (in vitro měl vliv na reakci lymfocytů a in vivo prodlužoval dobu přežití štěpu kůže). Byl modifikován na fingolimod (kódové jméno FTY720), což je chemicky 2-amino-2-[2-(4-octylfenyl)- -ethyl] propan-1,3-diol, viz obr. 3 [4]. Jedná se o strukturální analog sfingosinu; oba jsou fosforylovány intracelulární sfingosin-kinázou na aktivní formu tj. sfingosin-1-fosfát (S1P) a fingolimod-fosfát. Aktivní forma působí prostřednictvím jednoho z pěti receptorů pro  sfingosin-1-fosfát (S1P1 – S1P5). Receptor S1P patří do třídy receptorů spřažených s G-proteinem a byl objeven v 90. letech minulého století [5–7]. S1P je přirozený sfingolipid, který je generován z intracelulárního sfingosinu a hraje klíčovou roli při rozvoji zánětu [8].
sfingosin-1-fosfát (S1P1 – S1P5). Receptor S1P patří do třídy receptorů spřažených s G-proteinem a byl objeven v 90. letech minulého století [5–7]. S1P je přirozený sfingolipid, který je generován z intracelulárního sfingosinu a hraje klíčovou roli při rozvoji zánětu [8].
Struktura FTY720 byla poprvé popsána v letech 1995–1996. U zvířecích i humánních modelů fingolimod redukuje počet periferních lymfocytů působením na CD4+ T-buňky, CD8+ T- a B-buňky a spekuluje se, že potencuje homing (usídlení) lymfocytů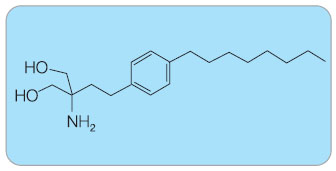 v lymfatických uzlinách (LU) [7].
v lymfatických uzlinách (LU) [7].
Mechanismus účinku fingolimodu
Aktivní forma fingolimodu (fingolimod-fosfát) působí jako agonista na receptorech pro sfingosin-1-fosfát; následně dochází k aktivaci pochodů uvnitř buňky. Fingolimod-fosfát se váže s vysokou afinitou na receptor S1P1, S1P4 a S1P5 a s nízkou afinitou k receptoru S1P3; neváže se na receptor S1P2. Fingolimod se však může chovat i jako funkční antagonista – navozením internalizace receptorů S1P, k níž dochází v důsledku jejich silné stimulace (down-regulace receptorů). Tento účinek je závislý na typu tkáně či buněk, koncentraci léčiva a endogenního sfingosin-1-fosfátu a rovněž na podtypu receptoru [9]. Receptory S1P1 jsou lokalizovány především na imunitních a neurálních buňkách, dále na endoteliích a buňkách hladkých svalů. Exprese těchto receptorů je rozlišná podle orgánů. Gradient výskytu S1P1 byl popsán v tomto pořadí: mozek, plíce a slezina, srdce a cévní systém, ledviny [10]. Předpokládá se, že terapeutická aktivita fingolimodu u RS je zprostředkována inhibiční modulací receptorů S1P1 na lymfocytech a na neurálních buňkách.
Působení na lymfocyty
![Obr. 4 Fingolimod inhibuje migraci lymfocytů z lymfatických uzlin; podle [13] – Brinkmann, et al., 2004.](https://www.remedia.cz/photo-a-28318---.jpg) Aktivované receptory S1P1 umožňují výstup lymfocytů z LU a jejich cirkulaci v periferním oběhu. Fingolimod zamezuje aktivaci těchto receptorů a potlačuje jejich expresi. Snížená exprese receptorů S1P1 na cirkulujících naivních i centrálních paměťových T-lymfocytech (směřujících do druhotných lymfoidních tkání) je pozitivní pro „homing“ přes chemokinový receptor 7 T-buněk (CCR7). Kinetika výstupu prozánětlivých lymfocytů CD4+ Th17 z LU je výrazně zpomalená (obr. 4). Tím je omezena jejich recirkulace, vstup do centrálního nervového systému (CNS) a autoimunitní odpověď vedoucí k centrálnímu zánětu je redukována [11, 12]. Fingolimod selektivně šetří efektorovou paměť CCR7 T-buněk. Tyto buňky se zdržují v T-buněčných oblastech sekundárních lymfoidních orgánů a jejich zapojení může vysvětlit terapeutický efekt FTY720 [12]. Působení fingolimodu je reverzibilní, recirkulace lymfocytů je po přerušení léčby možná a nedochází k definitivnímu úbytku lymfocytů, čímž se preparát odlišuje od jiných imunosupresivních léků [11]. Redukce počtu T-buněk produkujících IL-17 v periferní krvi je významná, viz obr. 4 [8, 12, 13].
Aktivované receptory S1P1 umožňují výstup lymfocytů z LU a jejich cirkulaci v periferním oběhu. Fingolimod zamezuje aktivaci těchto receptorů a potlačuje jejich expresi. Snížená exprese receptorů S1P1 na cirkulujících naivních i centrálních paměťových T-lymfocytech (směřujících do druhotných lymfoidních tkání) je pozitivní pro „homing“ přes chemokinový receptor 7 T-buněk (CCR7). Kinetika výstupu prozánětlivých lymfocytů CD4+ Th17 z LU je výrazně zpomalená (obr. 4). Tím je omezena jejich recirkulace, vstup do centrálního nervového systému (CNS) a autoimunitní odpověď vedoucí k centrálnímu zánětu je redukována [11, 12]. Fingolimod selektivně šetří efektorovou paměť CCR7 T-buněk. Tyto buňky se zdržují v T-buněčných oblastech sekundárních lymfoidních orgánů a jejich zapojení může vysvětlit terapeutický efekt FTY720 [12]. Působení fingolimodu je reverzibilní, recirkulace lymfocytů je po přerušení léčby možná a nedochází k definitivnímu úbytku lymfocytů, čímž se preparát odlišuje od jiných imunosupresivních léků [11]. Redukce počtu T-buněk produkujících IL-17 v periferní krvi je významná, viz obr. 4 [8, 12, 13].
Působení na neurálních buňkách
Fingolimod moduluje receptory S1P1 na astrocytech a při tom dochází k redukci receptorů, čímž se patrně redukuje astrogliosa v časné a později v chronické fázi demyelinizačních procesů. Junkční spojení mezi neuroglií se zlepšuje. To může pomoci restaurovat efektivní komunikaci astrocytů s neurony a s endotelovými buňkami v hematoencefalické bariéře, propojit kontaktní buňky a koordinovat elektrickou a metabolickou aktivitu [14]. FTY720 vyvolává časově závislou modulaci receptorů S1P1 na prekurzorech oligodendrocytů [15], moduluje zralost, dynamiku a přežívání oligodendrocytů s následnou odpovědí relevantní pro remyelinizační proces a integritu myelinu [16]. Je předpoklad, že fingolimod může ovlivňovat receptory S1P1 na membráně migrujících endoteliálních buněk a způsobit menší propustnost bariéry zvláště při probíhajícím zánětu [10]. Schematický pohled na patologii RS a působení fingolimodu na tento proces je znázorněn na obr. 5 [14].
Klinická farmakologie
Klinická farmakologie fingolimodu byla studována na více než 1000 subjektech ve 30 studiích. Lék byl testován v dávce 1,25 mg a 0,5 mg za den podávané perorálně. Fingolimod má pomalou absorpční periodu, maximální koncentrace dosahuje za 12–24 hodin od podání dávky. Eliminační poločas je 9–10 dnů. Při každodenním užívání ![Obr. 5 Model působení fingolimodu u roztroušené slerózy; upraveno podle [14] – Brinkmann, 2009.](https://www.remedia.cz/photo-a-28319---.jpg) je farmakologicky ustálené hladiny dosaženo za 1–2 měsíce. V metabolickém procesu se uplatňuje cytochrom P-450, především enzym CYP4F. Lékové interakce nejsou časté. Farmakodynamika je rychlá, má prudký nástup. Již během několika hodin po podání první dávky dochází k poklesu počtu periferních lymfocytů. Při ustálené denní dávce je pozorováno snížení počtu cirkulujících krevních lymfocytů na 77 % u dávky 1,25 mg a na 73 % při hodnotě 0,5 mg. Počet elementů je pak v dalším průběhu léčebné periody stabilní. Po vysazení léku se hladina lymfocytů upraví do šesti týdnů [10, 16].
je farmakologicky ustálené hladiny dosaženo za 1–2 měsíce. V metabolickém procesu se uplatňuje cytochrom P-450, především enzym CYP4F. Lékové interakce nejsou časté. Farmakodynamika je rychlá, má prudký nástup. Již během několika hodin po podání první dávky dochází k poklesu počtu periferních lymfocytů. Při ustálené denní dávce je pozorováno snížení počtu cirkulujících krevních lymfocytů na 77 % u dávky 1,25 mg a na 73 % při hodnotě 0,5 mg. Počet elementů je pak v dalším průběhu léčebné periody stabilní. Po vysazení léku se hladina lymfocytů upraví do šesti týdnů [10, 16].
Klinické studie
První klinická zkouška terapeutického efektu u RS byla prováděna v 6měsíční placebem kontrolované studii fáze II u 281 pacientů s relabujícím-remitentním (RR) typem onemocnění. Podávaly se tablety obsahující 1,25 mg a 0,5 mg fingolimodu. Při vyšetření magnetickou rezonancí se zkoumal počet aktivních (gadoliniem ohraničených) lézí v mozku a průměrný počet relapsů. Ve srovnání s placebem se snížil medián gadoliniem ohraničených lézí i průměr relapsů u obou léčených skupin. Po ukončení šestiměsíční fáze měli pacienti možnost pokračovat v dlouhodobé extenzní studii s aktivní léčbou. Byl prokázán pokles relapsů [17, 18]. Další klinická zkouška probíhala jako dvojitě slepá klinická studie fáze III známá pod akronymem FREEDOMS, která zahrnovala 1272 nemocných s RR typem RS. Pacientům byla podávána denní dávka 0,5 mg nebo 1,25 mg fingolimodu, nebo placebo. Průměr relapsů byl 0,18 u dávky 0,5 mg fingolimodu, 0,16 ve skupině s dávkou 1,25 mg a 0,40 ve skupině s placebem (p < 0,001 pro jednotlivou dávku versus placebo). U nemocných byl sledován neurologický nález – míra invalidity vyjádřená v běžně používané modifikované Kurtzkeho škále Expanded Disability Status Scale (EDSS). Stejně tak došlo u léčených subjektů k signifikantnímu poklesu rizika progrese invalidity ve 24měsíčním období. Obě dávky fingolimodu prokázaly ovlivnění nálezu na magnetické rezonanci (MR) v počtu nových aktivních ložisek a rovněž v míře mozkové atrofie [19]. Studie TRANSFORMS je další klinický pokus zahrnující 1292 nemocných s RR průběhem RS. Ve studii byl srovnáván efekt perorálně podávaného fingolimodu v dávce 0,5 nebo 1,25 mg denně s intramuskulárním interferonem b-1a podávaným 1krát týdně v dávce 30 mg. Výsledkem byl průkaz vyšší účinnosti fingolimodu na průměr relapsů i na nález na MR ve srovnání s efektem interferonu. Nebyl zjištěn signifikantní rozdíl v progresi invalidity [20]. V těchto již ukončených studiích bylo fingolimodem léčeno více než 2600 pacientů s RR typem onemocnění. Protokol studií s FTY720 zahrnoval pečlivé bezpečnostní hodnocení. Mimo klinické sledování v pravidelných intervalech to byly podrobné laboratorní odběry, sledování vitálních funkcí a elektrokardiogramu. Pacient byl pravidelně sledován pneumologem, oftalmologem, dermatologem a kardiologem. Organizace klinického programu je charakterizována 2letou kontrolovanou studií a pak až 5 let trvající extenzní fází studie. Zde je posuzována invalidita, průměr relapsů, tolerabilita a dlouhodobá bezpečnost fingolimodu. V této části výzkumu se posuzuje míra přínosu proti rizikům léčby. Bylo zjištěno, že bezpečnostní profil nižší dávky fingolimodu (0,5 mg) je lepší a další zkoušky probíhají již jen s touto dávkou.
Vedlejší reakce, nežádoucí účinky
Fingolimod je všeobecně dobře tolerován, o čemž svědčí vysoké procento pacientů, kteří dokončili klinické studie (TRANSFORMS 87 %, FREEDOMS 81,2 %). Většina nežádoucích účinků vyplývá z daného mechanismu působení, a to z negativní modulace receptorů S1P. Je to tranzientní a většinou asymptomatické snížení srdeční akce a zpomalení atrioventrikulárního vedení na počátku léčby (většinou po první dávce). Možná je krátkodobá aktivace draslíkových kanálů v atriálních svalových buňkách při S1P1-receptorových změnách. Výskyt makulárního edému a mírný vzestup krevního tlaku je dán modulací receptorů S1P1 v endoteliálních buňkách. Podobně jsou vysvětlovány ojedinělé případy periferních vaskulárních okluzí [21] nebo ischemických mozkových příhod.
Souhrnná data ze studií nevykazují zvýšený výskyt malignit. Výskyt infekčních onemocnění u léčených pacientů byl srovnatelný s placebovou skupinou, i když byla pozorována lehce vyšší incidence respiračních onemocnění. Naopak byl pozorován nižší výskyt močových infekcí. Ve studii TRANSFORMS proběhly 2 fatální infekce u pacientů léčených 1,25 mg fingolimodu. Šlo o primární varicelu a herpetickou encefalitidu. Oba smrtelné případy postihly pacienty současně léčené kúrou kortikoidů pro relaps onemocnění [20]. Z dalších nežádoucích účinků byly nalezeny zvýšené hodnoty jaterních enzymů. Mechanismus přechodného zvýšení hodnot jaterních enzymů není doposud jasný, úprava nastává po přerušení léčby. Jelikož observace a dlouhodobé sledování pokračuje, je možno očekávat více důležitých informací týkajících se efektu i nežádoucích účinků posuzovaného preparátu [18].
Na podkladě doposud získaných poznatků o fingolimodu došlo v USA a Rusku ke schválení léčby a užívání tohoto léku. Schválení FDA (Food and Drug Administration) proběhlo 22. 9. 2010 [22]. Fingo-limod se stal prvním perorálně účinným imunomodulačním preparátem. Současně probíhají procedury spojené s registrací léku v Evropě. Také v ČR se uskutečňují procedury potřebné k registraci tohoto léku a jsou připravována indikační kritéria.
Závěr
Dlouhodobý výzkum a recentní klinické studie ukázaly, že fingolimod je účinným preparátem v léčbě RR typu roztroušené sklerózy mozkomíšní. Efekt léčby byl prokázán snížením frekvence relapsů a ovlivněním invalidity a byl potvrzen vyšetřením magnetickou rezonancí. Fingolimod se stává prvním perorálním imunomodulačním přípravkem a představuje nový přístup k problematice roztroušené sklerózy a možná i dalších autoimunitních onemocnění. Perorální podání léku je pro nemocné s RS pohodlnější, zlepšuje compliance, odstraňuje vedlejší účinky injekční léčby. Při srovnání účinnosti a tolerability zaznamenané v průběhu klinických studií, rizika a přínosu léčby lze od fingolimodu očekávat, že se stane výrazně prospěšným imunomodulačním lékem pro RR typ roztroušené sklerózy mozkomíšní.
Seznam použité literatury
- [1] Zapletalová O. Léčba časných stadií roztroušené sklerózy mozkomíšní. Remedia 2009; 19: 198–204.
- [2] Havrdová E. Roztroušená skleróza. Neurol pro praxi 2008; 9: 208.
- [3] Adachi K, Chiba K. FTY720 Story. Its Discovery and the Following Accelerated Development of Sphingosine 1-Phosphate Receptor Agonists as Immunomodulators Based on Reverse Pharmacology. Perspect Medicin Chem 2007; 1: 11–23.
- [4] Gilenya Full Prescribing Information. Accessed 31. 1. 2011. http://www.pharma.us.novartis.com/ product/pi/pdf/gilenya.pdf
- [5] Anliker B, Chun J. Lysophospholipid G protein-coupled receptors. J Biol Chem 2004; 279: 20555–20558.
- [6] Hla T, Lee MJ, Ancellin N, et al. Lysophospho-lipids-receptor revelations. Science 2001; 294: 1875–1878.
- [7] Brinkmann V, Lunch KR. FTY720: targetting G-protein-coupled receptors for sphingosine 1-phosphate in transplantation and autoimmunity. Curr Opin Immunol 2002; 14: 569–575.
- [8] Mehling M, Lindberg RL, Kuhle J, et al. Oral fingolimod (FTY720) treatment reduces peripheral IL-17 cells in patients with multiple sclerosis. ECTRIMS 2008; Montreal, Canada. Poster P697.
- [9] Horga A, Montalban X. FTY720 (fingolimod) for relapsing multiple sclerosis. Expert Rev Neurother 2008; 8: 699–714.
- [10] Brinkmann V, Billich A, Baumruker T, et al. Fingolimod (FTY720): discovery and development of an oral drug to treat multiple sclerosis. Nat Rev Drug Discov 2010; 9: 883–897.
- [11] Stüve O. Knows and unknows in the future of multiple sclerosis treatment. Journal of the Neurological Science 2009; 287 (Suppl 1): S30–S36.
- [12] Mehling M, Lindeberg R, Raulf F, et al. Th17 central memory T cells are reduced by FTY720 in patiens with multiple sclerosis. Neurology 2010; 75: 388–389.
- [13] Brinkmann V, Cyster JG, Hla T. FTY720: sphingosine 1-phosphate receptor-1 in the control of lymphocyte egress and endothelial barrier function. Am J Transplant 2004; 4: 1019–1025.
- [14] Brinkmann V. FTY720 (Fingolimod) in Multiple Sclerosis: therapeutic effects in the immune and central nervous system. Br J Pharmacol 2009; 158: 1173–1182.
- [15] Miron VE, Jung CG, Kim HJ, et al. FTY720 modulates human oligodendrocyte progenitor process extension and survival. Ann Neurol 2008; 63: 61–71.
- [16] MironVE, Hall JA, Kennedy TE, et al. Cyclical and dose-dependent response of adult human mature oligodendrocytes to fingolimod. Am J Pathol 2008; 173: 1143–1152.
- [17] O’Conner P, Comi G, Montalban X, et al. Oral fingolimod (FTY720) in multiple sclerosis: two-year results of a phase II extension study. Neurology 2009; 72: 73–79.
- [18] Kappos L, Antel J, Comi G, et al. Oral fingolimod (FTY720) for relapsing multiple sclerosis. N Engl J Med 2006; 355: 1124–1140.
- [19] Kappos L, Radue EW, O’Connor P, et al. A placebo-controlled trial of oral fingolimod in relapsing multiple sclerosis. N Engl J Med 2010; 362: 387–401.
- [20] Cohen JA, Barkhof F, Comi G, et al. Oral fingolimod or intramuscular interferon for relapsing multiple sclerosis. N Engl J Med 2010; 362: 402–415.
- [21] Schwarz A, Korporal M, Hosch W, et al. Critical vasospasm during fingolimod (FTY720) treatment in patient with multiple sclerosis. Neurology 2010; 74: 2022–2024.
- [22] Gilenya Consumer Information. Accessed 31. 1. 2011. http://www.drugs.com/gilenya.html