Gefitinib v léčbě lokálně pokročilého a/nebo metastazujícího nemalobuněčného plicního karcinomu
Gefitinib je jedním z nízkomolekulárních inhibitorů tyrozinkinázy (TK) receptoru pro epidermální růstový faktor (EGFR), který je dostupný pro perorální podávání ve standardní dávce 250 mg denně. EGFR je ve zvýšené míře exprimován u většiny buněk nemalobuněčného plicního karcinomu (NSCLC) a znamená jeho horší prognózu. Podávání inhibitorů TK u neselektované populace s NSCLC bez ohledu na expresi EGFR má limitovanou účinnost. Bylo zjištěno několik klinických charakteristik (asijské etnikum, nekuřáctví, ženské pohlaví, adenokarcinom), které jsou významně spojeny s odpovědí na inhibitory TK EGFR, ale to neznamená, že nemocní bez těchto znaků nemohou mít z léčby gefitinibem žádný užitek. Mutace receptoru EGFR se zatím ukazují být indikátorem prognózy, nikoli prediktorem účinnosti gefitinibu. Aby bylo v budoucnu možné předpovědět účinnost gefitinibu, jsou hledány nové molekulární markery, jako je KRAS či MET, nebo klinické ukazatele, jako je rozvoj kožní toxicity.
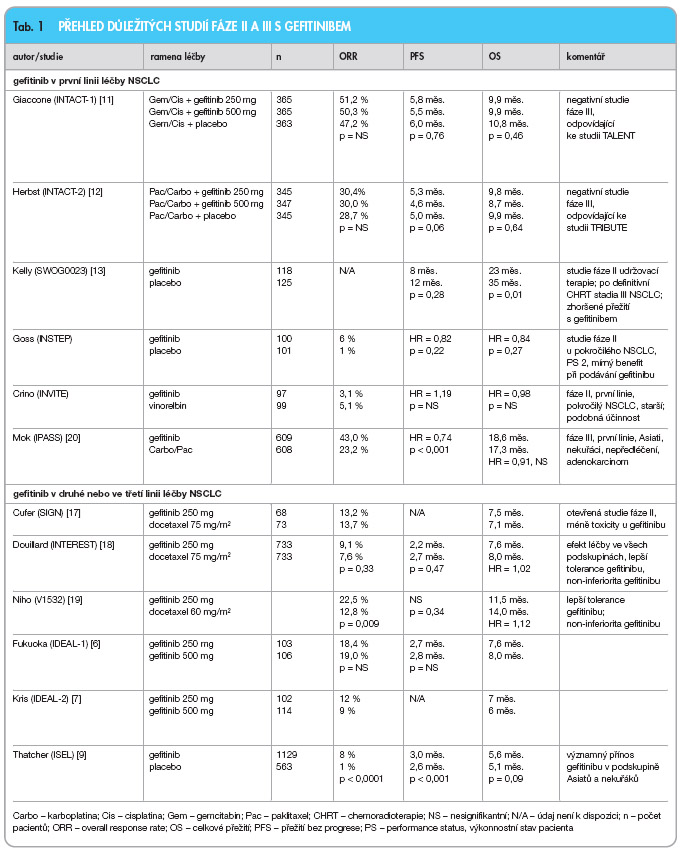
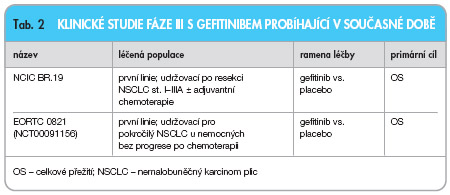
Seznam použité literatury
- [1] Alvarez M, Roman E, Santos ES, Raez LE. New targets for non-small-cell lung cancer therapy. Expert Rev Anticancer Ther 2007; 7: 1423–1437.
- [2] Bunn PA Jr, Franklin W. Epidermal growth factor receptor expression, signal pathway, and inhibitors in nonsmall cell lung cancer. Semin Oncol 2002; 29: 38–44.
- [3] Rusch V, Klimstra D, Venkatraman E, et al. Over-expression of the epidermal growth factor receptor and its ligand transforming growth factor alpha is frequent in resectable nonsmall cell lung cancer but does not predict tumor progression. Clin Cancer Res 1997; 3: 515–522.
- [4] Ohsaki Y, Tanno S, Fujita Y, et al. Epidermal growth factor receptor expression correlates with poor prognosis in nonsmall cell lung cancer patients with p53 overexpression. Oncol Rep 2000; 7: 603–607.
- [5] Volm M, Rittgen W, Drings P. Prognostic value of ERBB-1, VEGF, cyclin A, FOS, JUN and MYC in patients with squamous cell lung carcinomas. Br J Cancer 1998; 77: 663–669.
- [6] Fukuoka M, Yano S, Giaccone G, et al. Multiinstitutional randomized phase II trial of gefitinib for previously treated patients with advanced nonsmall-cell lung cancer (The IDEAL 1 Trial). J Clin Oncol 2003; 21: 2237–2246.
- [7] Kris MG, Natale RB, Herbst RS, et al. Efficacy of gefitinib, an inhibitor of the epidermal growth factor receptor tyrosine kinase, in symptomatic patients with nonsmall cell lung cancer: a randomized trial. Jama 2003; 290: 2149–2158.
- [8] Cohen MH, Williams GA, Sridhara R, et al. United States Food and Drug Administration Drug Approval summary: Gefitinib (ZD1839; Iressa) tablets. Clin Cancer Res 2004; 10: 1212–1218.
- [9] Thatcher N, Chang A, Parikh P, et al. Gefitinib plus best supportive care in previously treated patients with refractory advanced nonsmall-cell lung cancer: results from a randomised, placebo-controlled, multicentre study (Iressa Survival Evaluation in Lung Cancer). Lancet 2005; 366: 1527–1537.
- [10] Chang A, Parikh P, Thongprasert S, et al. Gefitinib (IRESSA) in patients of Asian origin with refractory advanced nonsmall cell lung cancer: subset analysis from the ISEL study. J Thorac Oncol 2006; 1: 847–855.
- [11] Giaccone G, Herbst RS, Manegold C, et al. Gefitinib in combination with gemcitabine and cisplatin in advanced nonsmall-cell lung cancer: a phase III trial: INTACT 1. J Clin Oncol 2004; 22: 777–784.
- [12] Herbst RS, Giaccone G, Schiller JH, et al. Gefitinib in combination with paclitaxel and carboplatin in advanced nonsmall-cell lung cancer: a phase III trial: INTACT 2. J Clin Oncol 2004; 22: 785–794.
- [13] Kelly K, Chansky K, Gaspar LE, et al. Updated analysis of SWOG 0023: A randomized phase III trial of gefitinib versus placebo maintenance after definitive chemoradiation followed by docetaxel in patients with locally advanced stage III non-small cell lung cancer [abstract]. J Clin Oncol 2007; 25: Abstract 7513.
- [14] Hanna N, Shepherd FA, Fossella FV, et al. Randomized phase III trial of pemetrexed versus docetaxel in patients with nonsmall-cell lung cancer previously treated with chemotherapy. J Clin Oncol 2004; 22: 1589–1597.
- [15] Shepherd FA, Dancey J, Ramlau R, et al. Prospective randomized trial of docetaxel versus best supportive care in patients with nonsmall-cell lung cancer previously treated with platinum-based chemotherapy. J Clin Oncol 2000; 18: 2095–2103.
- [16] Shepherd FA, Rodrigues Pereira J, Ciuleanu T, et al. Erlotinib in previously treated nonsmall-cell lung cancer. N Engl J Med 2005; 353: 123–132.
- [17] Cufer T, Vrdoljak E, Gaafar R, et al. Phase II, open-label, randomized study (SIGN) of single-agent gefitinib (IRESSA) or docetaxel as second-line therapy in patients with advanced (stage IIIb or IV) nonsmall-cell lung cancer. Anticancer Drugs 2006; 17: 401–409.
- [18] Douillard JY, Kim E, Hirsh V, et al. Gefitinib (IRESSA) versus docetaxel in patients with locally advanced or metastatic nonsmall-cell lung cancer pretreated with platinum-based chemotherapy: a randomized, open-label Phase III study (INTEREST): PRS-02. J Thorac Oncol 2007; 2: S305–S306.
- [19] Niho S, Ichinose Y, Tamura T, et al. Results of a randomized phase III study to compare the over-all survival of gefitinib (IRESSA) versus docetaxel in Japanese patients with nonsmall-cell lung cancer who failed one or two chemotherapy regimens [abstract]. J Clin Oncol 2007; 25: LBA7509.
- [20] Mok T, Wu YL, Thongprasert S, et al. Phase III, randomised, open/label, first-line study of gefitinib vs carboplatin/paclitaxel in clinically selected patients with advanced non-small-slee lung cancer (IPASS). Ann Oncol 2008; 19 (suppl. 8): LBA2.
- [21] Lee DH, Han JY, Lee HG, et al. Gefitinib as a first-line therapy of advanced or metastatic adenocarcinoma of the lung in never-smokers. Clin Cancer Res 2005; 11: 3032–3037.
- [22] Shepherd FA, Rosell R. Weighing tumor biology in treatment decisions for patients with nonsmall cell lung cancer. J Thorac Oncol 2007; 2 (Suppl. 2): S68–S76.
- [23] Domine M, Gurdipe LA, Rosillo F, et al. Erlotinib as single agent in men with advanced or metastatic NSCLC: A retrospective analysis: P3-080 [abstract]. J Thorac Oncol 2007; 2: S712.
- [24] Hirsch FR, Varella-Garcia M, Bunn PA Jr, et al. Molecular predictors of outcome with gefitinib in a phase III placebo-controlled study in advanced nonsmall-cell lung cancer. J Clin Oncol 2006; 24: 5034–5042.
- [25] Sharma SV, Bell DW, Settleman J, Haber DA. Epidermal growth factor receptor mutations in lung cancer. Nat Rev Cancer 2007; 7: 169–181.
- [26] Marchetti A, Martella C, Felicioni L, et al. EGFR mutations in nonsmall-cell lung cancer: analysis of a large series of cases and development of a rapid and sensitive method for diagnostic screening with potential implications on pharmacologic treatment. J Clin Oncol 2005; 23: 857–865.
- [27] Ahrendt SA, Decker PA, Alawi EA, et al. Cigarette smoking is strongly associated with mutation of the K-ras gene in patients with primary adenocarcinoma of the lung. Cancer 2001; 92: 1525–1530.
- [28] Lynch TJ, Bell DW, Sordella R, et al. Activating mutations in the epidermal growth factor receptor underlying responsiveness of nonsmall-cell lung cancer to gefitinib. N Engl J Med 2004; 350: 2129–2139.
- [29] Paez JG, Janne PA, Lee JC, et al. EGFR mutations in lung cancer: correlation with clinical response to gefitinib therapy. Science 2004; 304: 1497–1500.
- [30] Sasaki H, Shimizu S, Endo K, et al. EGFR and erbB2 mutation status in Japanese lung cancer patients. Int J Cancer 2006; 118: 180–184.
- [31] Eberhard DA, Johnson BE, Amler LC, et al. Mutations in the epidermal growth factor receptor and in KRAS are predictive and prognostic indicators in patients with nonsmall-cell lung cancer treated with chemotherapy alone and in combination with erlotinib. J Clin Oncol 2005; 23: 5900–5909.
- [32] Bell DW, Lynch TJ, Haserlat SM, et al. Epidermal growth factor receptor mutations and gene amplification in nonsmall-cell lung cancer: molecular analysis of the IDEAL/INTACT gefitinib trials. J Clin Oncol 2005; 23: 8081–8092.
- [33] Taguchi F, Solomon B, Gregorc V, et al. Mass spectrometry to classify nonsmall-cell lung cancer patients for c linical outcome after treatment with epidermal growth factor receptor tyrosine kinase inhibitors: a multicohort cross-institutional study. J Natl Cancer Inst 2007; 99: 838–846.
- [34] Zemanová M, Petruželka L, Zatloukal P, et al. Gefitinib toxicity has been significantly correlated with survival in non-small cell lung cancer patients treated in EAP program in Czech Republic. Journal of Thoracic Oncology, 2007; 2 (Suppl. 8): S748–S749.
- [35] Balak MN, Gong Y, Riely GJ, et al. Novel D761Y and common secondary T790M mutations in epidermal growth factor receptor-mutant lung adenocarcinomas with acquired resistance to kinase inhibitors. Clin Cancer Res 2006; 12: 6494–6501.
- [36] Rizvi N, Kris MG, Miller V, et al. A Phase II study of XL647 in nonsmall cell lung cancer (NSCLC) patients enriched for presence of EGFRmutations (abstract). J Thorac Oncol 2007; 2: S737.
- [37] To CT, Tsao MS. The roles of hepatocyte growth factor/scatter factor and met receptor in human cancers (Review). Oncol Rep 1998; 5: 1013–1024.
- [38] Ma PC, Jagadeeswaran R, Jagadeesh S, et al. Functional expression and mutations of c-Met and its therapeutic inhibition with SU11274 and small interfering RNA in nonsmall cell lung cancer. Cancer Res 2005; 65: 1479–1488.
- [39] Cheng TL, Chang MY, Huang SY, et al. Overexpression of circulating c-met messenger RNA is significantly correlated with nodal stage and early recurrence in nonsmall cell lung cancer. Chest 2005; 128: 1453–1460.
- [40] Engelman JA, Zejnullahu K, Mitsudomi T, et al. MET amplification leads to gefitinib resistance in lung cancer by activating ERBB3 signaling. Science 2007; 316: 1039–1043.
- [41] Aviel-Ronen S, Blackhall FH, Shepherd FA, Tsao MS. K-ras mutations in nonsmall-cell lung carcinoma: a review. Clin Lung Cancer 2006; 8: 30–38.
- [42] Broermann P, Junker K, Brandt BH, et al. Trimodality treatment in Stage III nonsmall cell lung carcinoma: prognostic impact of K-ras mutations after neoadjuvant therapy. Cancer 2002; 94: 2055–2062.
- [43] Schiller JH, Adak S, Feins RH, et al. Lack of prognostic significance of p53 and K-ras mutations in primary resected nonsmall-cell lung cancer on E4592: a Laboratory Ancillary Study on an East-ern Cooperative Oncology Group Prospective Randomized Trial of Postoperative Adjuvant Therapy. J Clin Oncol 2001; 19: 448–457.
- [44] Shepherd FA, Ding K, Sakurada A, et al. Updated molecular analyses of exons 19 and 21 of the epidermal growth factor receptor (EGFR) gene and codons 12 and 13 of the KRAS gene in nonsmall cell lung cancer (NSCLC) patients treated with erlotinib in National Cancer Institute of Cancer [abstract]. J Clin Oncol 2007; 25: Abstract 7571.