Inhibice interleukinů 12 a 23 – nová léčba ložiskové lupénky
Psoriáza je chronické recidivující onemocnění kůže, které postihuje 1–2 % populace. Na genetickém podkladě probíhá autoimunitní zánět spuštěný infekcí (např. streptokokovou), léky, stresem. Klíčovou roli v něm hrají T-lymfocyty, které produkují řadu cytokinů, zejména profilu Th1, včetně TNF-a (tumor necrosis factor a). Nověji se prokázala i úloha Th17 a jeho interleukinu IL-23. Ten obsahuje protein p40, který je i součástí IL-12. Blokace p40 pomocí humánních monoklonálních protilátek ustekinumabu a briakinumabu se ukazuje jako účinná biologická léčba těžké ložiskové lupénky.
Úvod
Psoriáza je chronické zánětlivé kožní onemocnění, které postihuje 1–2 % populace prakticky na celém světě. Její závažnost může zvýšit doprovodná psoriatická artritida (až v 35 %) a spojení s celou řadou vážných systémových onemocnění. Těžká lupénka může podle jedné kohortové studie [1] zkrátit délku života v průměru o 3,5 roku u mužů a o 4,4 roku u žen. V každém případě však znamená výrazný zásah do kvality života u jednotlivého nemocného. Proto intenzivní výzkum odhaluje stále nové poznatky v imunopatogenezi lupénky, i když mnoho vztahů zůstává dosud neobjasněných.
Klinické poznámky
Asi 90 % nemocných je postiženo psoriasis vulgaris, která je charakterizována mnoha kožními projevy [2] – k nejčastějším patří gutátní (80 %), numulární, geografické, inverzní; dále pak psoriatická erytrodermie a psoriasis pustulosa (generalizovaná a palmoplantární). Z hlediska průběhu rozlišujeme akutní a chronicky stacionární lupénku. Přitom až 50 % pacientů trpí poškozením nehtových plotének. Psoriatická artritida (PsA) je séronegativní zánět kloubů, který se u většiny nemocných (90 %) objevuje až v průběhu kožní manifestace. Na předpokládaném genetickém základě bývá lupénka spouštěna řadou zevních vlivů. Akutní formy jako kapkovitý výsev a generalizovaná pustulózní psoriáza jsou spojeny s infekcí, nejčastěji b-hemolytickým streptokokem (např. do dvou týdnů po tonzilitidě). Dalšími spouštěči jsou trauma (Koebnerův fenomén), HIV, psychogenní stres, ale také některé léky: lithium, b-blokátory, antimalarika, interferony, nesteroidní antiflogistika, ukončení či přerušení léčby kortikoidy. Kouření a konzumace alkoholu jsou také považovány za rizikové faktory.
Jako doprovodné systémové choroby jsou nejčastěji uváděny [3] metabolický syndrom (obezita, diabetes mellitus, dyslipidemie, hypertenze), kardiovaskulární choro-by, Crohnova choroba, deprese i malignity. Zatím není zcela jasné, zda riziko malignit (lymfomy a kožní rakovina) je ve spojení s lupénkou, nebo s její léčbou.
Genetické vazby
Četná pozorování [4, 5] svědčí pro silnou genetickou vazbu lupénky, ačkoli přesný typ zůstává nejasný. Typ I mívá výskyt lupénky v rodině, zatímco typ II vykazuje negativní rodinnou anamnézu. Osoby s časným výsevem lupénky již v dětství mívají v 71 % pozitivní rodinnou anamnézu. Sourozenci nebo příbuzenský vztah prvního stupně přináší 4krát vyšší riziko vzniku lupénky. Je zmapováno nejméně deset (PSORS1-10) oblastí, které jsou spjaty s lupénkou [6, 7], ale za hlavní je považován PSORS1 (MHC lokalizovaný na 6. chromozomu, který představuje více než 50 % genetické náchylnosti k lupénce). V PSORS1 je zahrnut(?) také lidský leukocytární antigen C (HLA-C) – gen, jehož alela HLA-Cw6 (HLA-Cw0602) je pokládána za nejvyšší riziko pro vznik lupénky. Vyskytuje se u 60 % osob trpících lupénkou na rozdíl od 15 % v běžné populaci (nositelé této alely mají 10–20krát vyšší riziko vývoje lupénky, v případě homozygotního nosičství ještě 2krát vyšší [8] než heterozygotní jedinci). Homozygotní osoby mají také časnější nástup lupénky bez vlivu na její tíži: u HLA-Cw6 pozitivních nemocných se objevuje spíše kapkovitá lupénka, akutní výsevy s delší perzistencí, častěji je u nich zaznamenán Koebnerův fenomén a v těhotenství u nich často dochází k remisi.
Toto silné spojení lupénky s HLA-Cw6 podporuje imunologickou koncepci lupénky. HLA-Cw6 může spouštět přirozenou imunitní odpověď interakcí s KIRs (killer imunoglobulin-like receptors), které jsou vystaveny na povrchu přirozených zabíječských buněk (NK) i T-lymfocytů s podobným zaměřením (NKT). NK produkují IFN-g a mohou způsobit cytolýzu cílových buněk. Aktivita NK je podporována IL-2, IL-12, a IL-15, které jsou ve zvýšeném množství nalézány v psoriatických ložiscích. NK mohou pak zprostředkovávat jak aktivační, tak inhibiční imunitní odpovědi. HLA-Cw6 přítomné na antigen prezentujících buňkách mohou také aktivovat získanou (adaptivní) odpověď.
Imunitní děje v psoriatické kůži
Až do 90. let minulého století byla lupénka považována za onemocnění s poruchou proliferace a diferenciace keratinocytů. Tomuto konceptu odpovídala léčba antimetabolity, jako např. methotrexátem. Avšak další klinické studie svědčily pro to, že psoriáza je zánětlivé kožní onemocnění s účastí T-lymfocytů, jak potvrzovaly účinky léčby pomocí ciklosporinu a takrolimu [9]. Podobně i cílená léčba monoklonálními protilátkami proti CD3 a CD4 (tedy proti strukturám na povrchu T-lymfocytů) vedla ke klinickému zlepšení lupénky. I při podání fúzního proteinu s antigenem 4 cytotoxických T-lymfocytů (CTLA4) docházelo ke zlepšení psoriázy [10]. Tato látka totiž blokuje ko-stimulaci T-lymfocytů dendritickými buňkami, ale nevede k přímému potlačení T-lymfocytů. Tyto údaje i vývoj psoriatických lézí na AGR 129 myším modelu po xeno-transplantaci bezpříznakové (čisté) psoria-tické kůže prokázaly důležitost epidermálních T-lymfocytů ve vývoji lupénky [11]. Akumulace T-lymfocytů v epidermis je jedním z důležitých znaků rozvoje lupénky. T-lymfocyty, které proniknou dermo-epidermálním spojením, zpravidla vystavují na svém povrchu receptor pro kolagen IV, heterodimerický integrin a1b1 (very late antigen 1, VLA1). Detekce VLA1 tak představuje kontrolní signál aktivity T-lymfocytů k infiltraci epidermis, který by mohl posloužit jako nový cíl po moderní léčbu.
Většinu T-lymfocytů infiltrujících kožní ložiska lze rozdělit do skupiny pomocných Th1 (CD4+) a cytotoxických Tc1 (CD8+). Jsou zde však přítomny další dva podtypy: Th17 a regulační T-lymfocyty označované jako Treg. V psoriatických ložiscích jsou nalézány cytokiny IFN-g, TNF-a a IL-12, které patří do profilu Th1, ale nikoli IL-4, IL-5, IL-10, které jsou příznačné pro Th2 (některé cytokiny z profilu Th2 dokonce tlumí psoriatický zánět). Tato pozorování podporují koncepci lupénky jako Th1 onemocnění.
 Významnou (možná klíčovou) roli v rozvoji ložisek lupénky hraje TNF-a; může silně regulovat časnou produkci cytokinů, podporovat zánětlivé děje spojené s IFN-g a aktivovat signální cesty transdukce a aktivace transkripce (STAT), které podporují tvorbu a sekreci regulačních chemokinů [12]. TNF-a bývá také spojen s únavou a depresí, které obojí se mohou u lupénky vyskytnout jako komorbidita (receptory pro TNF-a byly také prokázány v CNS).
Významnou (možná klíčovou) roli v rozvoji ložisek lupénky hraje TNF-a; může silně regulovat časnou produkci cytokinů, podporovat zánětlivé děje spojené s IFN-g a aktivovat signální cesty transdukce a aktivace transkripce (STAT), které podporují tvorbu a sekreci regulačních chemokinů [12]. TNF-a bývá také spojen s únavou a depresí, které obojí se mohou u lupénky vyskytnout jako komorbidita (receptory pro TNF-a byly také prokázány v CNS).
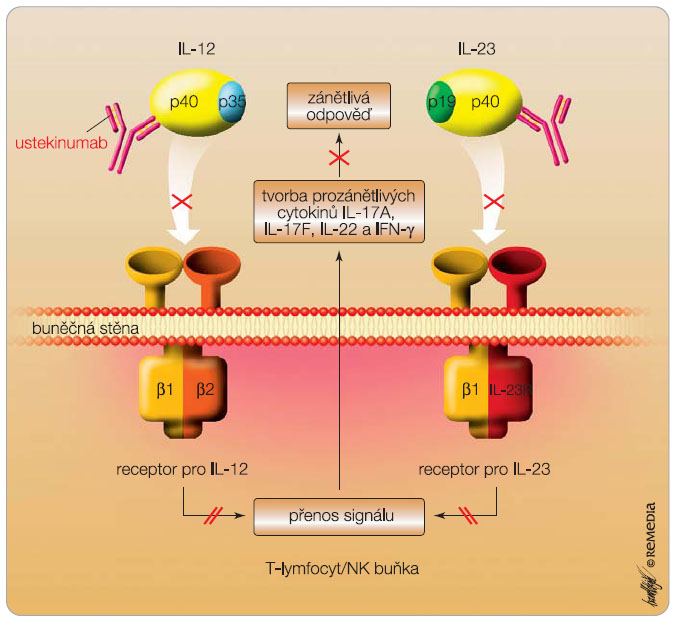
Nověji byla prokázána úloha Th17 a IL-23 v psoriatickém zánětu [13]. IL-23 je heterodimerický cytokin obsahující protein p19 a p40, který je také součástí IL-12 (obr. 1). IL-23 způsobuje epidermální hyper-plazii, akantózu a hyperkeratózu stimulací TNF-a a IL-22 [14], nachází se v zánětlivých ložiscích a je produkován ve tkáni deponovanými dendritickými buňkami a snad i keratinocyty [15]. Úlohu IL-23 v psoriatickém procesu podporují účinky anti-TNF-a, ciklosporinu A, UV fototerapie, jež všechny snižují hladinu IL-23 v korelaci s klinickým zlepšením [16]. Transformující růstový faktor b1 (TGF-b1), IL-6 a IL-21 jsou vyžadovány k přeměně naivních T-lymfocytů, které začnou exprimovat receptor pro signální dráhu STAT3 a receptory pro IL-23 a po jeho navázání dochází k diferenciaci na lymfocyty Th17. Ty pak začnou tvořit IL-17A, IL-17F, IL-22 a IL-26, což jsou prozánětlivé cytokiny, které vzápětí aktivují keratinocyty. Aktivované keratinocyty proliferují a tvoří prozánětlivé cytokiny a antimikrobiální peptidy, které aktivují další imunokompetentní buňky v zanícené kůži, zesílí zánětlivou odpověď i klinický projev psoriázy. Teorii o úloze IL-23 v psoriatickém zánětu podpořilo úspěšné použití monoklonálních protilátek (ustekinumab, briakinumab) v léčbě těžké ložiskové psoriázy.
Treg lymfocyty mají schopnost tlumit aktivaci a proliferaci CD4+ a CD8+ efektorových T-lymfocytů přímým kontaktem s antigen prezentujícími buňkami (APC) nebo uvolňováním IL-10 či TGF-b1. Treg tvoří asi 1–5 % periferní populace CD4+ buněk. Dysfunkční Treg byly prokázány v patogenezi některých autoimunitních chorob, jako je sclerosis multiplex, revmatoidní artritida a další. U psoriázy je funkce i proliferace Treg defektní [17], což může přispívat k aktivaci patogenních T-lymfocytů bez jejich útlumu prostřednictvím Treg.
V rozvoji psoriatických ložisek hrají roli i dendritické buňky. Rozlišujeme Langerhansovy buňky, dermální dendritické buňky a plazmocytoidní dendritické buňky (PDC). Právě PDC produkují IFN-a, který aktivuje některé složky přirozené imunity a podporuje zánět u psoriázy [18] – nasvědčuje tomu i zhoršení lupénky u osob léčených rekombinantním IFN-a pro virové infekty či tumory. PDC jsou řídkou buněčnou populací v periferní krvi a sekundárních lymfatických orgánech [18]. Jsou hlavními výkonnými buňkami v protivirové obraně díky své unikátní schopnosti uvolňovat velké množství IFN-a po stimulaci svých toll-like receptorů (TLR7, TLR9). Produkce IFN-a z PDC narůstá zejména časně a přechodně při rozvoji lupénky a klesá při další progresi onemocnění. To by mohlo být námětem pro prevenci a včasný léčebný zásah, který by předešel dlouhodobé léčbě a monitorování chronické lupénky.
Infekce b-hemolytickými streptokoky je jedním z nejsilnějších spouštěcích momentů lupénky [19], ale specifický antigen zodpovědný za aktivaci T-lymfocytů v kůži zatím nebyl identifikován. Snad APC v tonzilách pozřou fragmenty bakteriálních stěn, recirkulují do kůže, kde aktivují T-lymfocyty [20]. Další teorií je molekulární podobnost struktur streptokoků s keratinem 16 a 17, který se vyskytuje na hyperproliferujících keratinocytech [21].
Lupénka je tedy považována za auto-imunitní onemocnění zprostředkované T-lymfocyty. Klíčovou roli jako spouštěč v této koncepci sehrává antimikrobiální peptid LL37, který je uvolňován keratinocyty na základě poranění nebo infekce, ale také migrujícími zánětlivými buňkami, např. neutrofily. LL37 je specifický pro ložiska psoriázy, nikoliv pro zdravou kůži nebo jiná kožní onemocnění. LL37 se spojuje s vlastní DNA a tyto komplexy pak aktivují PDC vazbou na jejich toll-like receptory TLR7 a TLR9, což vede k uvolnění IFN-a a k další stimulaci psoriatického zánětu. Za normálního stavu PDC rozpoznají vazbu bakteriální a virové DNA a reagují na ni, ale neodpovídají na autologní DNA [22], jako je tomu u psoriázy.
Blokátory p40 v léčbě lupénky
Ustekinumab
Ustekinumab je humánní monoklonální protilátka, která se s vysokou afinitou a specificitou váže na protein p40, podjednotku IL-12 a IL-23 (obr. 1). Aplikuje se s.c. v dávce 45 mg po úvodní injekci za 4 týdny a dále každých 12 týdnů [23]. U osob s hmotností vyšší než 100 kg musí být dávka dvojnásobná, tzn. 90 mg [24]. Průměrná doba k dosažení maximální plazmatické koncentrace u nemocných s psoriázou činí 8,5 dne. Biologická dostupnost po jednorázové dávce je 57 %, biologický poločas vylučování je kolem 21 dní (15–32 dní).
Klinická účinnost ustekinumabu
Ustekinumab prošel klinickými zkouškami I., II. a III. fáze a byl v EU registrován pro léčbu chronické ložiskové lupénky. V ČR je ustekinumab indikován k léčbě středně těžké a těžké formy psoriázy u dospělých, u kterých selhaly alespoň dvě jiné systémové léčby, popř. je nesnášejí, či jsou kontraindikovány.
![Graf 1 Studie PHOENIX 1. Podíl pacientů, kteří dosáhli během 40 týdnů sledování PASI75 (Psoriasis Area and Severity Index, 75% zlepšení). Plné šipky znázorňují návštěvu lékaře spojenou s aplikací ustekinumabu pacientům, kteří jím byli léčeni od počátku studie. Přerušované šipky znázorňují návštěvu lékaře spojenou s aplikací ustekinumabu pacientům, kterým bylo prvních 12 týdnů studie podáváno placebo; podle [25] – Leonardi, et al., 2008.](https://www.remedia.cz/photo-a-28235---.jpg) Ve studii PHOENIX 1 [25] bylo zařazeno celkem 766 pacientů se středně těžkou až těžkou psoriázou, kteří byli léčeni ustekinumabem v dávce 45 mg (n = 255) nebo 90 mg (n = 256) nebo placebem (n = 255). Ustekinumab byl podáván v tý-dnu 0 a 4 a dále pak každých 12 týdnů, placebo bylo podáváno v týdnu 0 a 4 a poté byli pacienti ve 12. týdnu převedeni na léčbu ustekinumabem. Pacienti, kteří dostávali ustekinumab od počátku studie a měli dlouhodobou odpověď na léčbu, byli ve 40. týdnu opětovně randomizováni. Jedna skupina pokračovala v léčbě, u druhé skupiny byla léčba přerušena až do doby opětovného vzplanutí choroby. Nejméně 66 % nemocných dosáhlo při terapii ustekinumabem v dávkách 45 mg a 90 mg PASI75 (Psoriasis Area and Severity Index, který dosáhl 75% zlepšení) ve 12. týdnu, zatímco při podávání placeba byl PASI75 zaznamenán pouze u 3 % pacientů (graf 1). Ve 24. týdnu terapie zlepšení pokračovalo: při léčbě 45 mg bylo PASI75 dosaženo u 76 % pacientů, při aplikaci dávky 90 mg dokonce u 85 % nemocných. Ve 28. týdnu dosáhlo PASI50 v obou skupinách 90 % pacientů a více než polovina léčených měla PASI90. S klinickým zlepšením korelovalo i zlepšení kvality života. I v 76. týdnu (konec studie) přetrvávala původní účinnost při trvající léčbě, zatímco ve skupině s placebem se od 40. týdne nález postupně zhoršoval. Při opětovném zahájení léčby dosáhlo PASI75 ve 12. tý-dnu 85 % pacientů.
Ve studii PHOENIX 1 [25] bylo zařazeno celkem 766 pacientů se středně těžkou až těžkou psoriázou, kteří byli léčeni ustekinumabem v dávce 45 mg (n = 255) nebo 90 mg (n = 256) nebo placebem (n = 255). Ustekinumab byl podáván v tý-dnu 0 a 4 a dále pak každých 12 týdnů, placebo bylo podáváno v týdnu 0 a 4 a poté byli pacienti ve 12. týdnu převedeni na léčbu ustekinumabem. Pacienti, kteří dostávali ustekinumab od počátku studie a měli dlouhodobou odpověď na léčbu, byli ve 40. týdnu opětovně randomizováni. Jedna skupina pokračovala v léčbě, u druhé skupiny byla léčba přerušena až do doby opětovného vzplanutí choroby. Nejméně 66 % nemocných dosáhlo při terapii ustekinumabem v dávkách 45 mg a 90 mg PASI75 (Psoriasis Area and Severity Index, který dosáhl 75% zlepšení) ve 12. týdnu, zatímco při podávání placeba byl PASI75 zaznamenán pouze u 3 % pacientů (graf 1). Ve 24. týdnu terapie zlepšení pokračovalo: při léčbě 45 mg bylo PASI75 dosaženo u 76 % pacientů, při aplikaci dávky 90 mg dokonce u 85 % nemocných. Ve 28. týdnu dosáhlo PASI50 v obou skupinách 90 % pacientů a více než polovina léčených měla PASI90. S klinickým zlepšením korelovalo i zlepšení kvality života. I v 76. týdnu (konec studie) přetrvávala původní účinnost při trvající léčbě, zatímco ve skupině s placebem se od 40. týdne nález postupně zhoršoval. Při opětovném zahájení léčby dosáhlo PASI75 ve 12. tý-dnu 85 % pacientů.
Studie PHOENIX 2 [26] se zaměřila na skupinu osob s částečnou klinickou odpovědí, která po 12 týdnech dosáhla jen PASI50 (nikoli PASI75). Tito ![Graf 2 Studie PHOENIX 2. Pacienti, kteří během studie PHOENIX 1 dosáhli jen PASI50 (Psoriasis Area and Severity Index, 50% zlepšení) a nikoli PASI75 byli ve 28. týdnu sledování znovu randomizováni do dvou skupin – se stejným dávkováním po 12 týdnech a se zkráceným dávkováním po 8 týdnech. Graf znázorňuje podíl pacientů, kteří dosáhli během 28.–52. týdne sledování PASI75. Plné šipky znázorňují 8týdenní interval aplikace ustekinumabu, přerušované šipky znázorňují 12týdenní interval aplikace ustekinumabu; podle [26] – Papp, et al., 2008.](https://www.remedia.cz/photo-a-28236---.jpg) nemocní byli ve 28. týdnu znovu randomizováni do dvou skupin – se stejným dávkováním po 12 týdnech a se zkráceným po 8 týdnech. U nemocných léčených 45 mg ustekinumabu nevedlo zkrácení intervalu ke zlepšení klinické odpovědi, ale ze skupiny s 90 mg dosáhlo v 52. týdnu léčby PASI75 69 % pacientů ve srovnání s 33 % nemocných, kteří tohoto skóre docílili s 12týdenním režimem aplikací (graf 2). Tito částeční „re-spondéři“ činí přibližně 20 % dle odhadu autorů, mají zpravidla nadváhu, delší anamnézu psoriázy, častěji se u nich vyskytuje psoriatická artropatie i větší refrakternost vůči biologické léčbě. Ačkoli vlastní studie trvala 52 týdnů, má ještě extenzivní větev v délce trvání 5 let, zaměřenou ke zhodnocení bezpečnosti a ovlivnění psoriatické artritidy.
nemocní byli ve 28. týdnu znovu randomizováni do dvou skupin – se stejným dávkováním po 12 týdnech a se zkráceným po 8 týdnech. U nemocných léčených 45 mg ustekinumabu nevedlo zkrácení intervalu ke zlepšení klinické odpovědi, ale ze skupiny s 90 mg dosáhlo v 52. týdnu léčby PASI75 69 % pacientů ve srovnání s 33 % nemocných, kteří tohoto skóre docílili s 12týdenním režimem aplikací (graf 2). Tito částeční „re-spondéři“ činí přibližně 20 % dle odhadu autorů, mají zpravidla nadváhu, delší anamnézu psoriázy, častěji se u nich vyskytuje psoriatická artropatie i větší refrakternost vůči biologické léčbě. Ačkoli vlastní studie trvala 52 týdnů, má ještě extenzivní větev v délce trvání 5 let, zaměřenou ke zhodnocení bezpečnosti a ovlivnění psoriatické artritidy.
Ustekinumab se zkouší i v léčbě dětí ve věku 6–18 let s diagnózou pustulózní a artropatické psoriázy [23]. Mimoto se provádějí studie s léčbou sclerosis multiplex při mnohem vyšším dávkování. Dále proběhla i srovnávací studie ustekinumabu 45 mg a 90 mg oproti etanerceptu aplikovanému v dávce 50 mg 2krát týdně. Tato studie s názvem ACCEPT byla unikátní v tom, že šlo o vůbec první přímou srovnávací studii dvou biologických léčiv v indikaci psoriáza. Ve 12. týdnu terapie prokázal ustekinumab vyšší účinnost (74 %, resp. 68 %) v dosažení PASI75 než etanercept (jen 57 %) [27]. Pacienti, kteří nedosáhli odpovědi po etanerceptu, byli převedeni na léčbu ustekinumabem v dávce 90 mg; 53 %, resp. 22 % těchto pacientů dosáhlo PASI 75, resp. PASI 90 v 16. tý-dnu po změně preparátu.
Nežádoucí účinky a bezpečnost ustekinumabu
Nežádoucí účinky, které byly dokumentovány v největších studiích [25, 26], byly zpravidla mírné a nezávažné a nevyžadovaly změny v léčbě. Nejčastěji se jednalo o infekce horních cest dýchacích, nazofaryngu, bolesti hlavy, artralgie a reakce v místě vpichu. Ojediněle se vyskytly případy malignit, infarkt myokardu, gastroenteritida v placebové skupině. Nebyly zjištěny případy tuberkulózy, lymfomů ani demyelinizačních onemocnění.
Zatímco studie s inhibitory IL-12/23 na lidských dobrovolnících nevykazují zvýšené riziko malignit a vážných infekcí, studie na myších pro to nesvědčí. IL-23 je znám jako promotér výskytu a růstu tumorů a jeho blokáda může oslabit růst tumorů [28]. Nicméně myši s neschopností odpovědi IL-12 vykazují zvýšenou incidenci tumorů, rychlejší růst nádorů a také zvýšení výskytu metastáz. Myši s chybějícím IL-12 nebo jeho receptorem jsou citlivé k intracelulárním mikroorganismům. U lidí s prokázanou poruchou IL-12 je však zjištěna zvýšená citlivost pouze k infekcím mykobakteriemi a salmonelou [29]. Tyto osoby také patří k tzv. kompletním non-respondérům na terapii inhibitory p40. Naštěstí je výskyt této poruchy vzácný a ve světové literatuře jsou popsány pouze desítky případů [29].
Proti ustekinumabu se mohou také vytvářet neutralizující protilátky, jejichž výskyt však byl pozorován v nízkém procentu. Při jejich přítomnosti pak zřejmě dochází k rychlejšímu vylučování léčiva.
Jedním z doporučení je zvýšená opatrnost při léčbě osob starších 65 let [30]. Spíše než významné riziko pro tuto věkovou skupinu je podkladem doporučení fakt, že pacienti starší 65 let představovali ne více než 5,5 % dosud léčených. Rozšíření spektra léčených o starší osoby bude ještě námětem dalších studií.
Briakinumab
Briakinumab (ABT-874) je také humanizovaná monoklonální protilátka proti p40. Zatím se uskutečnily úspěšné klinické studie I. a II. fáze, probíhají studie III. fáze. Při dávkování 100 mg a 200 mg briakinumabu s.c. za týden, resp. za 2 týdny, dosáhlo ve 12. týdnu léčby PASI75 více než 90 % léčených a PASI90 v průměru 53 % léčených [31]. Nežádoucí účinky při léčbě briakinumabem byly mírně častější oproti placebové skupině. Převažovaly zejména mírné reakce v místě vpichu. Počet vážných infektů ani malignit zvýšen nebyl.
Účinnost a bezpečnost briakinumabu (200 mg v týdnu 0 a 4, pak 100 mg v týdnu 8) u pacientů s chronickou ložiskovou lupénkou byla také srovnávána s účinností a bezpečností etanerceptu v dávkování 2krát 50 mg/týden [32]. Ve 12. týdnu bylo PASI75 dosaženo u 80,6 % nemocných při léčbě briakinumabem oproti 39,6 % léčených etanerceptem. Ve výskytu nežádoucích účinků (zejména infekce horních cest dýchacích a nazofaryngitidy) se obě skupiny s biologickou léčbou příliš nelišily, výskyt byl o něco častější než v placebové skupině.
Další blokátory p40
Uskutečnila se klinická studie II. fáze s přípravkem STA-5326 v perorální formě, který však nesplnil očekávání při léčbě lupénky. Nicméně stále pokračuje výzkum s jeho podáváním u revmatoidní artritidy a Crohnovy nemoci [33].
Závěr
Blokace proteinu p40, podjednotky společné IL-12 a IL-23, jež hrají nezanedbatelnou úlohu v etiopatogenezi ložiskové lupénky, představuje další způsob léčby těžké psoriázy. Údaje získané z klinických studií prokazují dobrý bezpečnostní profil této léčby, nicméně zatím se doporučují stejná opatření a vyšetření jako při léčbě inhibitory TNF-a [23]. Ustekinumab byl v EU registrován pro léčbu ložiskové chronické lupénky. Při frekvenci aplikace 1krát za 12 týdnů s.c. představuje vysoce pohodlnou léčbu. Další preparáty ze skupiny blokátorů p40 jsou ve fázi klinických zkoušek.
Seznam použité literatury
- [1] Gelfand JM, Troxel AB, Lewis JD, et al. The risk of mortality in patients with psoriasis: results from a population-based study. Arch Dermatol 2007; 143: 1493–1499.
- [2] Mak RKH, Hundhausen C, Nestle FO. Progress in understanding the immunopathogenesis of psoriasis. Actas Dermosifiliogr 2009; 100 (Supl. 2): 2–13.
- [3] Henseler T, Christophers E. Disease concomitance in psoriasis. J Am Acad Dermatol 1995; 32: 982–986.
- [4] Rahman P, Elder JT. Genetic epidemiology of psoriasis and psoriatic arthritis. Ann Rheum Dis 2005; 64 (Suppl. 2): ii37–39, discussion ii40–41.
- [5] Capon F, Trembath RC, Barker JN. An update on the genetics of psoriasis. Dermatol Clin 2004; 22: 339–347, vii.
- [6] Nair RP, Stuart PE, Nistor I, et al. Sequence and haplotype analysis supports HLA-C as the psoriasis susceptibility 1 gene. Am J Hum Genet 2009; 78: 827–851.
- [7] Trembath RC, Clough RL, Rosbotham JL, et al. Identification of a major susceptibility locus on chromosome 6p and evidence for further disease loci revealed by a two stage genome-wide search in psoriasis. Hum Mol Genet 1997; 6: 813–820.
- [8] Gudjonsson JE, Karason A, Antonsdottir A, et al. Psoriasis patients who are homozygous for the HLA-Cw*0602 allele have a 2.5-fold increased risk of developing psoriasis compared with Cw6 heterozygotes. Br J Dermatol 2003; 148: 233–235.
- [9] Jegasothy BV, Ackerman CD, Todo S, et al. Tacrolimus (FK 506)-a new therapeutic agent for severe recalcitrant psoriasis. Arch Dermatol 1992; 128: 781–785.
- [10] Abrams JR, Lebwohl MG, Guzzo CA, et al. CTLA4Ig-mediated blockade of T-cell costimulation in patients with psoriasis vulgaris. J Clin Invest 1999; 103: 1243–1252.
- [11] Conrad C, Boyman O, Tonel G, et al. Alpha1beta1 integrin is crucial for accumulation of epidermal T cells and the development of psoriasis. Nat Med 2007; 13: 836–842.
- [12] Lowes MA, Bowcock AM, Krueger JG. Pathogenesis and therapy of psoriasis. Nature 2007; 445: 866–873.
- [13] Di Cesare A, Di Meglio P, Nestle FO. The IL-23/ Th17 axis in the immunopathogenesis of psoriasis. J Invest Dermatol 2009; 129: 1339–1350.
- [14] Zheng Y, Danilenko DM, Valdez P, et al. Interleukin-22, a T(H)17 cytokine, mediates IL-23-induced dermal inflammation and acanthosis. Nature 2007; 445: 648–651.
- [15] Piskin G, Sylva-Steenland RM, Bos JD, et al. In vitro and in situ expression of IL-23 by keratinocytes in healthy skin and psoriasis lesions: enhanced expression in psoriatic skin. J Immunol 2006; 176: 1908–1915.
- [16] Haider AS, Lowes MA, Suárez-Farinas M, et al. Identification of cellular pathways of „type 1“, Th17 T cells, and TNF- and inducible nitric oxide synthase-producing dendritic cells in autoimmune inflammation through pharmacogenomic study of cyclosporine A in psoriasis. J Immunol 2008: 180: 1913–1920.
- [17] Sugiyama H, Gyulai R, Toichi E, et al. Dysfunctional blood and target tissue CD4+ CD25 high regulatory T cells in psoriasis: mechanism underlying unrestrained pathogenic effector T cell proliferation. J Immunol 2005; 174: 164–173.
- [18] Nestle FO, Conrad C, Tun-Kyi A, et al. Plasmacytoid predendritic cells initiate psoriasis through interferon-alpha production. J Exp Med 2005; 202: 135–143.
- [19] Fry L. Psoriasis. Br J Dermatol 1988; 119: 445–461.
- [20] Baker BS, Laman JD, Powles A, et al. Peptidoglycan and peptidoglycan-specific Th1cells in psoriatic skin lesions. J Pathol 2006; 209: 174–181.
- [21] Johnston A, Gudjonsson JE, Sigmundsdottir H, et al. Peripheral blood T cell responses to keratin peptides that share sequences with streptococcal M proteins are largely restricted to skin-homing CD8(+) T cells. Clin Exp Immunol 2004; 138: 83–93.
- [22] Lande R, Gregorio J, Facchinetti V, et al. Plasmacytoid dendritic cells sense self-DNA coupled with antimicrobial peptide. Nature 2007; 449: 564–569.
- [23] Benáková N. Ustekinumab v celkové léčbě psoriázy. Farmakoterapie 2009; 5: 249–356.
- [24] Lebwohl M, Yeilding N, Szapary P, et al. Impact of weight on the efficacy and safety of ustekinumab in patients with moderate to severe psoriasis: Rationale for dosing recommendations. J Am Acad Dermatol 2010; 63: 571–579.
- [25] Leonardi CL, Kimball AB, Papp KA, et al. Efficacy and safety of ustekinumab, a human interleukin-12/23 monoclonal antibody, in patients with psoriasis: 76-week results from a randomised, double-blind, placebo-controlled trial (PHOENIX 1). Lancet 2008; 371: 1665–1674.
- [26] Papp KA, Lebwohl M, Krueger GG, et al. Efficacy and safety of ustekinumab, a human interleukin-12/23 monoclonal antibody, in patients with psoriasis: 52-week results from a randomised, double-blind, placebo-controlled trial (PHOENIX 2). Lancet 2008; 371: 1675–1684.
- [27] Griffiths C, Strober B, van de Kerkhof PC, et al. A phase 3, multicenter, randomized study comparing ustekinumab and etanercept for the treatment of moderate to severe psoriasis. Presented at: 2008 European Academy of Dermatology Venereology (EADV), Paris, Poster FP1336. Ref Type: Conference Proceeding.
- [28] Langowski JL, Zhang X, Wu L, et al. IL-23 promotes tumour incidence and growth. Nature 2006; 442: 461–465.
- [29] Fieschi C, Casanova J. The role of interleukin-12 in human infectious diseases: only a faint signature. Eur J Immunol 2003; 33: 1461–1464.
- [30] Zhu Y, Hu C, Lu M, et al. Population pharmacokinetic modeling of ustekinumab, a human monoclonal antibody targeting IL-12/23p40 in patients with moderate to severe plaque psoriasis. J Clin Pharmacol 2009; 49: 162–175.
- [31] Wu JJ. Interleukin-12, interleukin-23, and psoriasis: ABT-874 in clinical trials. J Am Acad Dermatol 2008; 58: 1083.
- [32] Strober AE, Crowley JJ, Yamauchi PS, et al. Efficacy and safety results from a Phase III, randomized controlled trial comparing the safety and efficacy of briakinumab to etanercept and placebo in patients with moderate to severe chronic plaque psoriasis. Presented at Psoriasis 2010, Congress of the Psoriasis International Network, 1–4 July 2010, Paris, France.
- [33] Kinney MA, Yentzer BA, Feldman SR. IL-12/23 inhibitors and their potential benefits and risks for psoriasis patients. Psoriasis Forum 2010; 16: 16–20.