Inhibitory JAK2 v léčbě primární myelofibrózy
Souhrn:
Primární myelofibrózu řadíme mezi Ph-negativní myeloproliferativní onemocnění. V léčbě jsou historicky používány hydroxyurea, kortikosteroidy, interferon alfa, anagrelid a thalidomid. Inhibitory Janusovy kinázy 2 (JAK2) představují novou lékovou skupinu. Ruxolitinib, perorální selektivní inhibitor JAK1 a JAK2, prokázal v klinických studiích COMFORT-I a COMFORT-II u pacientů s primární myelofibrózou vysokou účinnost na zmírnění celkových symptomů onemocnění a na regresi splenomegalie. Dlouhodobé sledování pacientů, kteří byli ruxolitinibem léčeni, prokazuje i signifikantní zlepšení celkového přežití. Mezi nežádoucí účinky léčby ruxolitinibem patří trombocytopenie a anemie.
Key words: Ph negative myeloproliferative illness – primary myelofibrosis – JAK2 inhibitors – ruxolitinib – thrombocytopenia
Summary:
Primary myelofibrosis is one of Ph-negative myeloproliferative disorders. Hydroxyurea, corticosteroids, interferon alpha, anagrelid, and thalidomide have been used in its treatment. Janus kinase 2 (JAK2) inhibitors represent a novel drug class. Ruxolitinib, selective oral inhibitor of JAK1 and JAK2, showed high effectiveness in clinical trials COMFORT-I and COMFORT-II comprising patients with primary myelofibrosis, alleviating the global symptoms of illness and leading to regression of splenomegaly. Long term follow up of patients treated with ruxolitinib also demonstrates significant improvement in their long term survival. Thrombocytopenia and anemia are common adverse effects of ruxolitinib.
Úvod
Primární myelofibróza (PMF) je nosologická jednotka, kterou přesně definuje klasifikace Světové zdravotnické organizace (World Health Organization, WHO) z roku 2008. V léčbě PMF převládají konzervativní postupy, jedinou kurativní léčbou je transplantace hematopoetických krvetvorných buněk (hematopoietic stem cells transplantation, HSCT). Poměrně novou možnost léčby pacientů s PMF představují inhibitory Janusovy kinázy 2 (JAK2), z nichž ruxolitinib je schválen do rutinního klinického užívání.
Primární myelofibróza
Primární myelofibróza je charakterizována postupným rozvojem nejdříve retikulární, později kolagenní fibrózy a osteomyelosklerózy kostní dřeně při primárním, chronickém, klonálním Ph‑negativním (BCR/ABL‑negativním) myeloproliferativním onemocnění. Incidence PMF je odhadována na 0,1–1,0 případu na 100 000 obyvatel ročně. Medián věku nemocných při stanovení diagnózy PMF je 69–76 let [1].
Patogeneze PMF není zcela objasněna. Přibližně u 50–60 % pacientů je prokazatelná mutace genu V617F tyrosinové kinázy JAK2. Zhruba 5 % nemocných má namísto mutace JAK2V617F mutovaný gen MPL (myeloproliferative leukemia virus oncogene) kódující receptor trombopoetinu. Až 10 % pacientů s PMF může nést některou z prognosticky nepříznivých mutací genu ASXL1 (additional sex‑combs‑like 1).
Prognóza primární myelofibrózy
Prognóza pacientů s PMF závisí na několika parametrech. Mezi negativní prognostické faktory PMF podle Mezinárodního prognostického systému (International Prognostic Scoring System, IPSS) patří věk vyšší než 65 let, celkové příznaky, sérová koncentrace hemoglobinu < 100 g/l, počet leukocytů > 25 × 109/l a přítomnost blastických elementů v periferní krvi převyšující 1 %. Přítomnost jednoho z vyjmenovaných faktorů hodnotíme jedním bodem. Pacienti nízkého rizika (0 bodů) a středního rizika (1 bod) mají medián přežití 10 let, respektive 8 let. Naproti tomu u vysoce rizikových pacientů (3 body a více) je předpokládaný medián přežití pouze 2,3 roku [2].
Kromě uvedeného skóre IPSS existují i jeho další modifikace: skóre DIPSS (Dynamic International Prognostic Scoring System) má shodné parametry jako IPSS, ale je možno ho stanovit kdykoliv během léčby; další modifikací je skóre DIPSS plus, v němž je navíc zohledněna závislost na transfuzích, počet trombocytů (< 100 × 109/l) a karyotyp (zohledněny nepříznivé nálezy karyotypu, tedy komplexní karyotyp a abnormity +8, –7/7q‑, i(17q), –5/5q‑, 12p‑, inv(3) nebo 11q23 přestavba) [3,4].
Standardní léčba primární myelofibrózy
V léčbě PMF jsou rutinně používány různé farmakoterapeutické postupy, např. podávání hydroxyurey, kortikosteroidů, interferonu alfa, anagrelidu, event. léčba inhibitory angiogeneze (thalidomid), anebo provedení splenektomie či radioterapie zvětšené sleziny.
Podrobné informace ohledně standardní léčby PMF v rámci České republiky byly publikovány v roce 2012 [5]. Tyto léčebné postupy neprokázaly v přímém srovnání s ruxolitinibem v rámci klinické studie COMFORT II (ruxolitinib versus nejlepší dostupná léčba) superioritu nad podáváním ruxolitinibu [8].
Inhibitory JAK2
Objev konstitutivní aktivace JAK 2 (mutace JAK2V617F), popsané u Ph‑negativních myeloproliferativních onemocnění, vedl k vývoji selektivních inhibitorů JAK a k jejich aplikaci v léčbě PMF (včetně post‑polycytemické – post‑PV – myelofibrózy a post‑trombocytemické – post‑ET – myelofibrózy), polycythemia vera. Byly provedeny klinické studie s ruxolitinibem u pacientů s PMF (včetně post‑PV myelofibrózy a post‑ET myelofibrózy) a publikovány výsledky americké a evropské studie fáze III (COMFORT‑I a COMFORT‑II); délka sledování je u nich již dostatečně dlouhá na to, aby bylo možné prokázat superioritu v přežití pacientů léčených tímto inhibitorem JAK1/JAK2.
Ruxolitinib je 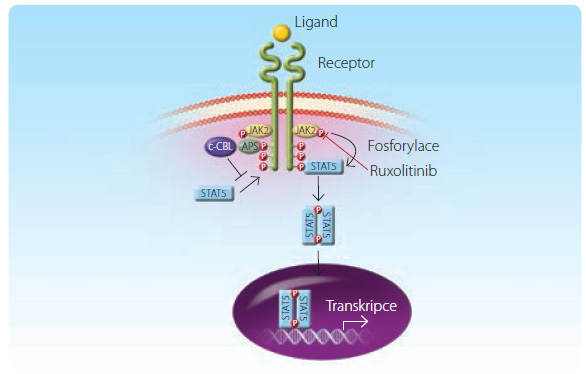 perorální selektivní inhibitor JAK1 a JAK2 (obr. 1). Přípravek je v současnosti schválen americkými i evropskými regulačními autoritami (Food and Drug Administration, FDA; European Medicines Agency, EMA) k léčbě PMF, a to k odstranění či ke zmírnění symptomů spojených s PMF (profuzních potů, svědění kůže, únavy, kachektizace apod.) a symptomatické splenomegalie. Na základě výsledků studie fáze I a II byly u pacientů s PMF provedeny s ruxolitinibem dvě zásadní klinické studie fáze III. Právě výsledky těchto studií vedly ke schválení ruxolitinibu pro léčbu PMF. Šlo o studie označené akronymy COMFORT‑I a COMFORT‑II. Do těchto studií byli zařazeni nejen pacienti s PMF, ale i s post‑ET myelofibrózou a s post‑PV myelofibrózou.
perorální selektivní inhibitor JAK1 a JAK2 (obr. 1). Přípravek je v současnosti schválen americkými i evropskými regulačními autoritami (Food and Drug Administration, FDA; European Medicines Agency, EMA) k léčbě PMF, a to k odstranění či ke zmírnění symptomů spojených s PMF (profuzních potů, svědění kůže, únavy, kachektizace apod.) a symptomatické splenomegalie. Na základě výsledků studie fáze I a II byly u pacientů s PMF provedeny s ruxolitinibem dvě zásadní klinické studie fáze III. Právě výsledky těchto studií vedly ke schválení ruxolitinibu pro léčbu PMF. Šlo o studie označené akronymy COMFORT‑I a COMFORT‑II. Do těchto studií byli zařazeni nejen pacienti s PMF, ale i s post‑ET myelofibrózou a s post‑PV myelofibrózou.
Ruxolitinib versus placebo (studie COMFORT‑I)
Ve studii publikované Verstovsekem a kol. [6] byl ruxolitinib srovnáván s placebem. Šlo o dvojitě zaslepenou, randomizovanou klinickou studii kontrolovanou placebem. Do studie bylo zařazeno 309 pacientů. Pacienti byli randomizováni v poměru 1 : 1 pro léčbu ruxolitinibem (n = 155) či placebem (n = 154). Pacienti ve větvi s ruxolitinibem byli léčeni zahajovací dávkou ruxolitinibu 15 mg nebo 20 mg 2× denně podle vstupní hodnoty trombocytů (100–200 × 109/l, nebo > 200 × 109/l). Dávka ruxolitinibu byla upravována, pokud byla zjištěna toxicita léčby či pokud nebyl prokázán léčebný účinek ve vztahu ke snížení velikosti sleziny, které bylo primárním cílovým ukazatelem studie.
Ruxolitinib, na rozdíl od placeba, vedl u pacientů k výraznému zmenšení objemu sleziny (nejméně o 35 % v týdnu 24 ve srovnání se vstupní hodnotou). K uvedenému zmenšení sleziny došlo u 41,9 % pacientů léčených ve větvi s ruxolitinibem (n = 65) ve srovnání s 0,7 % pacientů ve skupině s podáváním placeba (n = 1; p < 0,001). Toto zmenšení sleziny bylo u většiny nemocných trvalé při pokračování terapie ruxolitinibem. U celých 97 % (n = 150) pacientů léčených ruxolitinibem došlo aspoň k nějaké redukci splenického objemu. Naopak ve skupině s placebem bylo až u 67 % pacientů pozorováno zvětšení sleziny. Signifikantně více pacientů ve větvi s ruxolitinibem (45,9 %) mělo rovněž v týdnu 24 méně celkových symptomů nemoci, než tomu bylo u pacientů ve větvi s placebem (5,3 %). Ve studii nebyly zaznamenány rozdíly v počtech ukončení terapie mezi ruxolitinibem a placebem. Ve skupině s ruxolitinibem byly nejčastějšími nežádoucími účinky únava, anemie, trombocytopenie, bolesti břicha, průjmy a bolesti kloubů. Dlouhodobá analýza celkového přežití pacientů zařazených do studie COMFORT‑I prokázala při mediánu sledování více než 149 týdnů průměrné zmenšení objemu sleziny ve skupině s ruxolitinibem o 31,6 % ve 24. týdnu léčby a o 34,1 % do 144. týdne léčby. Ve 149. týdnu (mediánu) léčby byl zjištěn signifikantní účinek léčby ruxolitinibem na celkové přežití. Ve skupině s ruxolitinibem došlo ke 42 úmrtím, ve skupině s placebem k 54 úmrtím (poměr rizik – hazard ratio – HR: 0,69; 95% interval spolehlivosti – confidence interval – CI: 0,46–1,03; p = 0,067) [7].
Ruxolitinib versus nejlepší dostupná léčba (studie COMFORT‑II)
COMFORT‑II byla otevřená, randomizovaná studie fáze III [8]. Celkem 219 pacientů bylo rozděleno do větve s ruxolitinibem či do větve s léčbou dle rozhodnutí investigátora (hydroxyurea, kortikosteroidy, pouze sledování bez léčby). Pacienti, kteří splňovali vstupní kritéria studie, byli rozděleni podle prognostického skóre a poté zařazeni v poměru 2 : 1 do větve s ruxolitinibem (n = 146) či s nejlepší dostupnou léčbou (n = 73).
Primárním cílem studie COMFORT‑II bylo zjistit, jaký počet pacientů dosáhne více než 35% zmenšení splenického objemu ve 48. týdnu léčby. Hodnocené 35% snížení objemu sleziny (měřeno počítačovou tomografií či magnetickou rezonancí) odpovídá přibližně 50% zmenšení palpovatelné velikosti sleziny. Kromě sledování velikosti sleziny probíhalo ve studii i sledování kvality života nemocných.
Pacienti ve větvi s ruxolitinibem byli léčeni zahajovací dávkou ruxolitinibu 15 mg nebo 20 mg podávanou 2× denně v závislosti na vstupním počtu trombocytů (100–200 × 109/l, nebo > 200 × 109/l). Celkem 33 % pacientů ve větvi s nejlepší dostupnou terapií bylo zcela bez léčby, většina ostatních byla léčena hydroxyureou. U 28 % pacientů léčených ruxolitinibem bylo dosaženo alespoň 35% zmenšení sleziny ve 48. týdnu terapie ve srovnání s 0 % u pacientů léčených nejlepší dostupnou terapií (p < 0,001). Stejná analýza v týdnu 24 ukázala poměr 32 % versus 0 % (p < 0,001). Úbytek celkových symptomů u pacientů léčených ruxolitinibem byl rovněž významně vyšší ve srovnání s jinou léčbou. Ruxolitinib měl ale ve srovnání s nejlepší dostupnou terapií vyšší počet nežádoucích účinků, z nichž nejčastějším a nejhlubším byla anemie a trombocytopenie. Analýza celkového přežití byla jedním ze sekundárních cílů ve studii COMFORT‑II. Vzhledem k uspořádání studie a k velkému počtu pacientů, kteří přešli z ramene nejlepší dostupné léčby do větve s ruxolitinibem, byla statisticky významná data týkající se vyšší míry přežití pacientů ve větvi s ruxolitinibem získána až u souboru s mediánem sledování 151 týdnů [9]. Ve 144. týdnu byla pravděpodobnost přežití pacientů ve skupině s ruxolitinibem 81 %, u pacientů s běžně dostupnou léčbou 61 %.
Závěr
Na základě výsledků výše uvedených studií je ruxolitinib indikován pro léčbu dospělých pacientů s PMF, s post‑PV myelofibrózou a s post‑ET myelofibrózou, kteří trpí výraznou splenomegalií nebo u nich jsou přítomny celkové příznaky přidružené k PMF (profuzní poty, kachektizace, horečky, výrazná únava). Indikace není u daného pacienta závislá na přítomnosti mutace genu JAK2.
Doporučená počáteční dávka ruxolitinibu je 2× denně 15 mg u pacientů s počtem trombocytů 100–200 × 109/l a 2× denně 20 mg u pacientů s hodnotou trombocytů převyšující 200 × 109/l. U pacientů s počtem trombocytů 50–100 × 109/l by se měla léčba zahájit dávkou 5 mg podávanou 2× denně. Při hodnotách trombocytů nižších než 50 × 109/l a stejně tak při neutropenii (< 0,5 × 109/l) je léčba ruxolitinibem kontraindikována. Přípravek je též kontraindikován v těhotenství či při laktaci. Redukce dávky je nutná i u pacientů s poškozením funkcí ledvin a jater. Léčba má pokračovat, dokud její přínos převažuje nad rizikem, které je s léčbou spojeno. Pokud ale nedojde během šesti měsíců od zahájení léčby ke zmenšení velikosti sleziny nebo ke zmírnění příznaků, má být léčba ukončena. Ukončení terapie může ale provázet výrazné zhoršení celkových příznaků, splenomegalie, dokonce až stav podobný šoku – je tedy třeba opatrnosti a může být vhodné léčbu ukončovat postupně [10].
Seznam použité literatury
- [1] Barosi G. Myelofibrosis with myeloid metaplasia: diagnostic definition and prognostic classification for clinical studies and treatment guidelines. J Clin Oncol 1999; 17: 2954–2970.
- [2] Cervantes F, Dupriez B, Pereira A, et al. New prognostic scoring system for primary myelofibrosis based on a study of the International Working Group for Myelofibro-sis Research and Treatment. Blood 2009; 113: 2895–2901.
- [3] Passamonti F, Cervantes F, Vannucchi AM, et al. A dynamic prognostic model to predict survival in primary myelofibrosis: a study by the IWG MRT (International Working Group for Myeloproliferative Neoplasms Research and Treatment). Blood 2010; 115: 1703–1708.
- [4] Gangat N, Caramazza D, Vaidya R, et al. DIPSS plus: a refined Dynamic International Prognostic Scoring System for primary myelofibrosis that incorporates prognostic information from karyotype, platelet count, and transfusion status. J Clin Oncol 2011; 29: 392–397.
- [5] Penka M, Schwarz J, Campr V, et al. Shrnutí doporučení České pracovní skupiny pro Ph negativní myeloproliferativní onemocnění (CZEMP) České hematologické společnosti ČLS JEP pro diagnózu a terapii BCR/ABL negativních myeloproliferací. Vnitř Lék 2012; 58: 163–168.
- [6] Verstovsek S, Mesa RA, Gotlib J, et al. A double blind, placebo controlled trial of ruxolitinib for myelofibrosis. N Engl J Med 2012; 366: 799–807.
- [7] Verstovsek S, Mesa RA, Gotlib J, et al. Long term outcomes of ruxolitinib therapy in patients with myelofibrosis: 3 year update from COMFORT I. Haematologica 2015; 100: 479–488.
- [8] Harrison C, Kiladjian J J, Al Ali HK, et al. JAK inhibition with ruxolitinib versus best available therapy for myelofibrosis. N Engl J Med 2012; 366: 787–798.
- [9] Cervantes F, Vannucchi AM, Kiladjian JJ, et al. Three year efficacy, safety, and survival findings from COMFORT II, a phase 3 study comparing ruxolitinib with best available therapy for myelofibrosis. Blood 2013; 122: 4047–4053.
- [10] Tefferi A, Pardanani A. Serious adverse events during ruxolitinib treatment discontinuation in patients with myelofibrosis. Mayo Clin Proc 2011; 86: 1188–1191.