Kabazitaxel – nová možnost léčby karcinomu prostaty
Kabazitaxel je nový semisyntetický derivát taxanů. Klinické studie fáze I prokázaly, že kabazitaxel má podobný efekt a toxicitu jako taxany. Následné klinické studie prokázaly efektivitu kabazitaxelu u žen s taxanrezistentním metastatickým karcinomem prsu a u mužů s metastatickým kastračně-rezistentním karcinomem prostaty po předchozí léčbě docetaxelem. Ze závěrů studie fáze III TROPIC vyplývá, že kombinace kabazitaxel/prednison ve srovnání s režimem mitoxantron/prednison statisticky signifikantně prodlužuje přežití u mužů s metastatickým kastračně-rezistentním karcinomem prostaty po předchozí léčbě docetaxelem.
Úvod
Taxany patří do skupiny protinádorových léků působících na mikrotubuly, které mají klíčovou roli v buněčném dělení. Kabazitaxel je nový semisyntetický derivát taxanů se zajímavými farmakologickými vlastnostmi. Je částečně syntetizován jako jednoduchý diastereoizomer z 10-deacetylbaccatinu III, hlavního přírodního taxoidu, derivovaného z jehel tisu (Taxus spp.). Má široké spektrum antitumorózní aktivity, a to jak in vitro, tak in vivo.
Mechanismus účinku/preklinická data
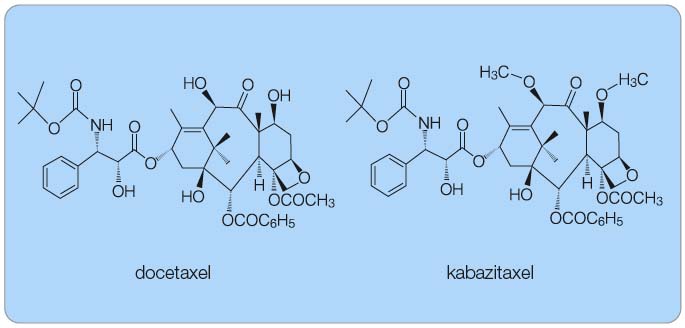 Taxany svým účinkem urychlují tvorbu mikrotubulů a stabilizují již vytvořené tubuly, čímž blokují mitózu a následně vedou k buněčné smrti [1]. I když se mechanismus účinku kabazitaxelu na mikrotubuly nezdá být odlišný od docetaxelu nebo paklitaxelu, je to přesto strukturálně odlišná látka. Jak ukazuje obr. 1, hydroxylová skupina docetaxelu je u kabazitaxelu nahrazena methoxyskupinou.
Taxany svým účinkem urychlují tvorbu mikrotubulů a stabilizují již vytvořené tubuly, čímž blokují mitózu a následně vedou k buněčné smrti [1]. I když se mechanismus účinku kabazitaxelu na mikrotubuly nezdá být odlišný od docetaxelu nebo paklitaxelu, je to přesto strukturálně odlišná látka. Jak ukazuje obr. 1, hydroxylová skupina docetaxelu je u kabazitaxelu nahrazena methoxyskupinou.
Preklinická data prokázala aktivitu kabazitaxelu in vitro, byly testovány buňky zahrnující P388 (lymfoblastická leukemie), HL60 (promyelocytární leukemie), KB (karcinom cervixu) a Calc18 (karcinom prsu) [2]. Při 4denní expozici testované látce byla cytotoxicita zaznamenána při relativně nízké koncentraci kabazitaxelu (IC50 = 3–29 ng/ml). V doprovodných testech in vivo byla zaznamenána signifikantní antitumorózní aktivita. Následně byla testována dvě dávkovací schémata:
1. dávka 58 mg/kg, aplikována den 1 a 5;
2. dávka 12 mg/kg 3krát denně, aplikována den 1 až 5.
Maximálně tolerovatelná dávka (MTD) byla 4,8krát vyšší, než bylo původně plánováno. U části nádorových buněk rezistentních k řadě jiných cytostatik (např. antra-cykliny, vinka-alkaloidy nebo starší taxany) byl kabazitaxel schopen ještě dále navodit regresi. Efektivita kabazitaxelu byla následně dokumentována na humánních buněčných tkáních. Dlouhodobé přežití bez přítomnosti nádoru (přesahující 133 dní) a kompletní remise byly prokázány u tkání nádorů pankreatu, hlavy a krku a hormonálně refrakterního karcinomu prostaty [3]. Kabazitaxel neprokázal zkříženou rezistenci s cytarabinem, cyklofosfamidem, cisplatinou, 5-fluorouracilem, methotrexátem, vinkristinem nebo melfalanem [4]. Vysoká antitumorózní aktivita byla zaznamenána u glioblastomu, kde se předpokládá překonání ochranné mozkové bariéry.
Bezpečnost podání kabazitaxelu
Ve studii fáze I, v níž byl kabazitaxel podáván v jednohodinové infuzi 4 týdny po sobě (den 1, 8, 15 a 22) každých 5 týdnů v dávkovacím rozmezí 1,5 mg/m2 až 12 mg/m2, byla jako MTD stanovena aplikace 12 mg/m2. Takto léčení nemocní měli zkušenost s dávkou limitovanou toxicitou, která se projevila průjmem stupně 3 [5]. Další dávkou limitovanou toxicitu představovala únava stupně 3, neutropenie stupně 4 trvající déle než 5 dní a febrilní neutropenie. Z hematologické toxicity byla nejčastěji zaznamenána neutropenie, z nehematologické průjem, únava, hypersenzitivita středního stupně a senzorické poruchy. Centrální neurologická toxicita prokázána nebyla.
Při aplikaci jednohodinové infuze každé 3 týdny [6] byla jako dávkou limitovaná toxicita stanovena neutropenie, zejména prolongovaná neutropenie stupně 4 a febrilní neutropenie při dávce 25 mg/m2. Celkem byla neutropenie stupně 4 zaznamenána ve 42 % celkově podaných cyklů. Trombocytopenie a anémie stupně 3 byla zjištěna pouze u jednoho pacienta. Nehematologická toxicita zejména stupně 1–2 zahrnovala nauzeu, zvracení, průjem, neurotoxicitu a únavu. Neurotoxicita představovala především akrální parestezie. Kumulativní neurotoxicita byla zaznamenána po podání více než tří sérií aplikovaných ve vyšších dávkovacích schématech.
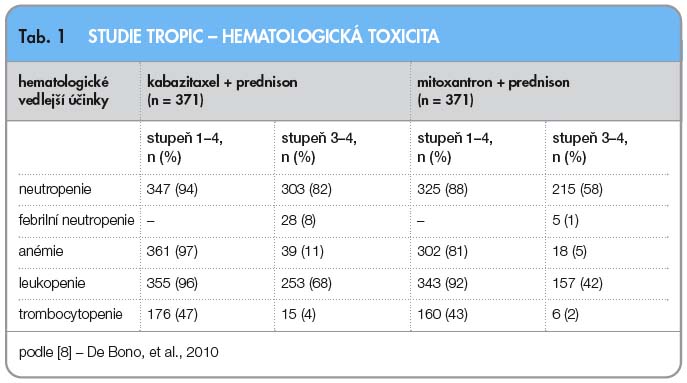
Bezpečnostní profil kabazitaxelu byl dále hodnocen ve studii fáze II, v jednohodinové infuzi podávané každé 3 týdny s dávkou 20 mg/m2 u pacientek s metastatickým karcinomem prsu rezistentním vůči léčbě taxany [7]. Neutropenie stupně 3/4 byla zaznamenána v 73 %, leukopenie stejného stupně v 55 %, zatímco febrilní neutropenie se vyskytla u velmi malého počtu léčených, pouze u 3 %. Trombocytopenie a anémie stupně 3/4 byla velmi raritní. Nehematologická toxicita vyšších stupňů byla zaznamenána u malého počtu pacientů, zahrnovala zejména hypersenzitivitu (4 %), únavu (3 %) a hemoragickou cystitidu (3 %). Studie fáze III hodnotila efektivitu kabazitaxelu v dávce 25 mg/m2, který byl podáván v kombinaci s prednisonem v dávce 10 mg/den u mužů s kastračně-rezistentním metastatickým karcinomem prostaty (mCRPC) po předchozí léčbě docetaxelem [8]. Nejčastější toxicitou stupně 3/4 byla neutropenie, a to u 81,7 % pacientů. Febrilní neutropenie se objevila v 7,5 % případů.
Klinické studie s kabazitaxelem
Na bezpečnost a toleranci podávání kabazitaxelu byly zaměřeny dvě studie fáze I [5, 6]. V první z nich [5] byl kabazitaxel (1,5–12 mg/m2) podáván týdně jako jednohodinová infuze ve dnech 1, 8, 15 a 22 každých 5 týdnů. Zařazeno bylo 25 pacientů, většina z nich s předléčeným pokročilým karcinomem prsu. Jako maximálně tolerovatelná dávka bylo stanoveno 12 mg/m2. U pacientek s karcinomem prsu předléčených taxany byla při dávce 8,4 mg/m2 a 12 mg/m2 prokázána odpověď na léčbu. U 12 nemocných s karcinomy žaludku, ovaria, dále cholangiokarcinomem, nemalobuněčným karcinomem plic a karcinoidem byla prokázána stabilizace onemocnění.
Další studie fáze I [6] byla provedena s kabazitaxelem podávaným v jednohodinové infuzi každé 3 týdny v dávkovacím rozmezí od 10 do 25 mg/m2. Úkolem studie bylo stanovení MTD, doporučení dávky a předběžné hodnocení efektivity. Celkem 25 pacientů s pokročilými solidními tumory bylo léčeno 102 cykly kabazitaxelu ve 4 dávkovacích schématech. Medián podaných cyklů na jednoho pacienta byl 4 cykly (od 1 do 9 cyklů); 22 pacientů (88 %) bylo předléčeno chemoterapií, u 8 nemocných byly aplikovány taxany. U všech 25 léčených (100 %) byla hodnocena bezpečnost a u 24 (96 %) efektivita podání. Při dávce 25 mg/m2 byla u tří ze 7 takto léčených subjektů zaznamenána protrahovaná neutropenie (> 5 dní) stupně 4 a febrilní neutropenie. Parciální odpovědi na léčbu bylo dosaženo u dvou nemocných s metastatickým karcinomem prostaty, jedna nepotvrzená parciální odpověď byla zjištěna u invazivního karcinomu močového měchýře, dále minimální odpověď u pacienta s karcinomem prostaty a u pacienta s osteosarkomem. Studie doporučila pro klinické hodnocení fáze II dávku kabazitaxelu 20 mg/m2.
![Graf 1 Studie TROPIC – hodnocení celkového přežití (OS); podle [8] – De Bono, et al., 2010.](https://www.remedia.cz/photo-a-28750---.jpg) Multicentrická studie fáze II hodnotila kabazitaxel v léčbě metastatického karcinomu prsu rezistentního vůči léčbě taxany [7]. Na začátku byla rozvržena jako tříramenná studie srovnávající efektivitu a bezpečnost kabazitaxelu a larotaxelu. Vzhledem k přijetí nízkého počtu pacientů během prvních 6 měsíců byl protokol studie pozměněn a ponecháno pouze jedno rameno s kabazitaxelem. Ten byl aplikován v jednohodinové infuzi den 1 každé 3 týdny v dávce 20 mg/m2. U pacientů, kteří po prvním cyklu netrpěli nežádoucími účinky, byla dávka eskalována na 25 mg/m2. Do studie bylo zařazeno 71 pacientů s mediánem věku 53 let, hodnoceno bylo 61 nemocných.
Multicentrická studie fáze II hodnotila kabazitaxel v léčbě metastatického karcinomu prsu rezistentního vůči léčbě taxany [7]. Na začátku byla rozvržena jako tříramenná studie srovnávající efektivitu a bezpečnost kabazitaxelu a larotaxelu. Vzhledem k přijetí nízkého počtu pacientů během prvních 6 měsíců byl protokol studie pozměněn a ponecháno pouze jedno rameno s kabazitaxelem. Ten byl aplikován v jednohodinové infuzi den 1 každé 3 týdny v dávce 20 mg/m2. U pacientů, kteří po prvním cyklu netrpěli nežádoucími účinky, byla dávka eskalována na 25 mg/m2. Do studie bylo zařazeno 71 pacientů s mediánem věku 53 let, hodnoceno bylo 61 nemocných. ![Graf 2 Studie TROPIC – hodnocení přežití bez progrese onemocnění (PFS), které zahrnovalo dobu bez progrese tumoru, bez elevace PSA (prostatický specifický antigen), bez progrese bolesti nebo dobu bez zhoršení symptomů a úmrtí; podle [8] – De Bono, et al., 2010.](https://www.remedia.cz/photo-a-28751---.jpg) Celkem bylo podáno 345 cyklů chemoterapie s mediánem 4 cykly (od 1 do 25 cyklů). Medián dávkové intenzity byl 0,98 (0,60–1,14). Objektivní odpovědi bylo dosaženo ve 14 % (2 kompletní a 7 parciálních remisí) s mediánem trvání 7,6 měsíce (2,6–18,7 měsíce). Čtvrtina nemocných měla stabilizaci onemocnění trvající déle než 3 měsíce. Po dobu dalšího sledování (20 měsíců) byl medián doby do progrese 2,7 měsíce a medián celkového přežití 12,3 měsíce. Výsledkem studie byl závěr, že kabazitaxel je aktivní a dobře tolerovatelný ve skupině pacientů s metastatickým karcinomem prsu rezistentním vůči léčbě taxany.
Celkem bylo podáno 345 cyklů chemoterapie s mediánem 4 cykly (od 1 do 25 cyklů). Medián dávkové intenzity byl 0,98 (0,60–1,14). Objektivní odpovědi bylo dosaženo ve 14 % (2 kompletní a 7 parciálních remisí) s mediánem trvání 7,6 měsíce (2,6–18,7 měsíce). Čtvrtina nemocných měla stabilizaci onemocnění trvající déle než 3 měsíce. Po dobu dalšího sledování (20 měsíců) byl medián doby do progrese 2,7 měsíce a medián celkového přežití 12,3 měsíce. Výsledkem studie byl závěr, že kabazitaxel je aktivní a dobře tolerovatelný ve skupině pacientů s metastatickým karcinomem prsu rezistentním vůči léčbě taxany.
 Kabazitaxel byl následně hodnocen ve studii TROPIC. Tato studie fáze III hodnotila efektivitu a bezpečnost kabazitaxelu u mužů s metastatickým kastračně-rezistentním karcinomem prostaty předléčených docetaxelem [8]. Do studie bylo zařazeno 775 mužů s progresí onemocnění během léčby nebo po léčbě docetaxelem (kumulativní dávka > 225 mg/m2), kteří při léčbě perorálním prednisonem v dávce 10 mg/den byli randomizováni do ramene s mitoxantronem (infuze 12 mg/m2 každé 3 týdny; n = 377) nebo do ramene s kabazitaxelem (infuze 25 mg/m2 každé 3 týdny; n = 378). Primárním cílem studie bylo hodnocení celkového přežití; sekundární cíl zahrnoval přežití bez progrese onemocnění, hodnocení odpovědi na léčbu, měření bolesti a bezpečnost podání. Medián dalšího sledování byl 12,8 měsíce. Medián počtu léčebných cyklů byl 6 pro rameno s kabazitaxelem a 4 pro rameno s mitoxantronem. V primární analýze dosáhli pacienti léčení kombinací kabazitaxel/prednison signifikantně delšího celkového přežití ve srovnání s režimem mitoxantron/prednison (15,1 měsíce vs. 12,7 měsíce, HR: 0,70; 95% CI: 0,59–0,83; p < 0,0001), viz graf 1.
Kabazitaxel byl následně hodnocen ve studii TROPIC. Tato studie fáze III hodnotila efektivitu a bezpečnost kabazitaxelu u mužů s metastatickým kastračně-rezistentním karcinomem prostaty předléčených docetaxelem [8]. Do studie bylo zařazeno 775 mužů s progresí onemocnění během léčby nebo po léčbě docetaxelem (kumulativní dávka > 225 mg/m2), kteří při léčbě perorálním prednisonem v dávce 10 mg/den byli randomizováni do ramene s mitoxantronem (infuze 12 mg/m2 každé 3 týdny; n = 377) nebo do ramene s kabazitaxelem (infuze 25 mg/m2 každé 3 týdny; n = 378). Primárním cílem studie bylo hodnocení celkového přežití; sekundární cíl zahrnoval přežití bez progrese onemocnění, hodnocení odpovědi na léčbu, měření bolesti a bezpečnost podání. Medián dalšího sledování byl 12,8 měsíce. Medián počtu léčebných cyklů byl 6 pro rameno s kabazitaxelem a 4 pro rameno s mitoxantronem. V primární analýze dosáhli pacienti léčení kombinací kabazitaxel/prednison signifikantně delšího celkového přežití ve srovnání s režimem mitoxantron/prednison (15,1 měsíce vs. 12,7 měsíce, HR: 0,70; 95% CI: 0,59–0,83; p < 0,0001), viz graf 1. 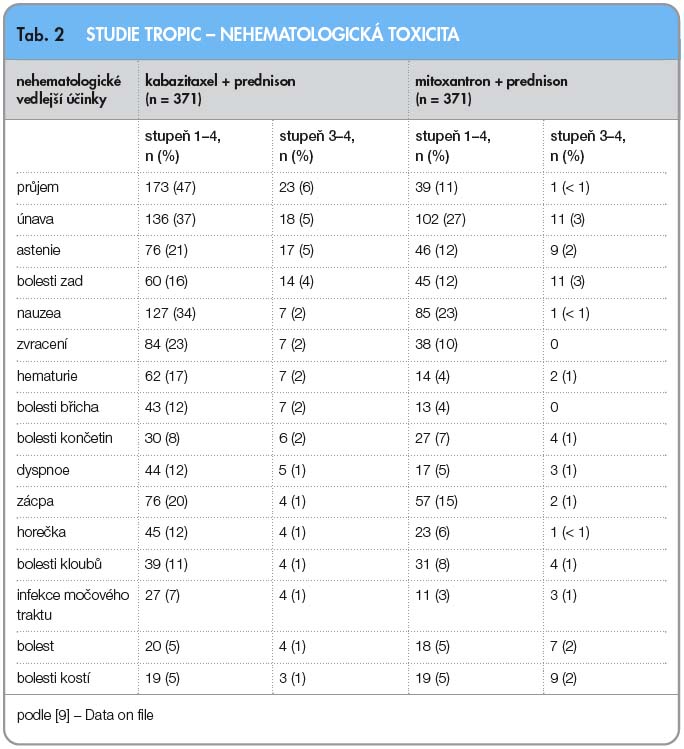 Doba přežití bez progrese onemocnění (složeno z doby bez progrese tumoru, bez elevace PSA a progrese bolesti; nebo úmrtí) a hodnocení odpovědi na léčbu RECIST kritérii a rovněž hodnocení odpovědi sérové hladiny PSA (prostatický specifický antigen) byly také statisticky signifikantní ve prospěch ramene s kabazitaxelem, viz graf 2. Odpověď tumoru na léčbu ve skupině s kabazitaxelem byla zaznamenána u 14,4 % léčených ve srovnání se 4,4 % ve skupině s mitoxantronem. Ve studii byly hodnoceny nežádoucí účinky, hematologická a nehematologická toxicita (tab. 1, 2). Závěrem studie TROPIC je konstatování, že podávání kabazitaxelu v kombinaci s prednisonem statisticky signifikantně prodlužuje přežití u pacientů s metastatickým kastračně-rezistentním karcinomem prostaty po předchozí léčbě docetaxelem.
Doba přežití bez progrese onemocnění (složeno z doby bez progrese tumoru, bez elevace PSA a progrese bolesti; nebo úmrtí) a hodnocení odpovědi na léčbu RECIST kritérii a rovněž hodnocení odpovědi sérové hladiny PSA (prostatický specifický antigen) byly také statisticky signifikantní ve prospěch ramene s kabazitaxelem, viz graf 2. Odpověď tumoru na léčbu ve skupině s kabazitaxelem byla zaznamenána u 14,4 % léčených ve srovnání se 4,4 % ve skupině s mitoxantronem. Ve studii byly hodnoceny nežádoucí účinky, hematologická a nehematologická toxicita (tab. 1, 2). Závěrem studie TROPIC je konstatování, že podávání kabazitaxelu v kombinaci s prednisonem statisticky signifikantně prodlužuje přežití u pacientů s metastatickým kastračně-rezistentním karcinomem prostaty po předchozí léčbě docetaxelem.
Závěr
Klinický úspěch taxanů v léčbě solidních tumorů byl stimulací pro výzkum nových analog se stejnou aktivitou a vyšší efektivitou. Kabazitaxel ve studii fáze III TROPIC u kastračně-rezistentního metastatického karcinomu prostaty po předchozí léčbě docetaxelem prokázal jak efektivitu, tak bezpečnost a je kandidátem pro standardní terapii druhé linie.
Seznam použité literatury
- [1] Jordan MA, Wilson L. Microtubules as a target for anticancer drugs. Nat Rev Cancer 2004; 4: 253–265.
- [2] Bissery MC, Bouchard H, Riou JF, et al. Preclinical evaluation of TXD258, a new taxoid [abstract 1364]. Proc Am Assoc Cancer Res 2000; 41: 214.
- [3] Vrignaud P, Lejeune P, Chaplin D, et al. In vivo efficacy of TXD258, a new taxoid, against human tumor xenografts [abstract 1365]. Proc Am Assoc Cancer Res 2000; 41: 214.
- [4] Aller AW, Kraus LA, Bissery M-C: In vitro activity of TXD258 in chemotherapeutic resistant tumor cell lines [abstract 1923]. Proc Am Assoc Cancer Res 2000; 41: 303.
- [5] Fumoleau P. Phase I and pharmacokinetic studies of RPR116258A given as a weekly 1-h infusion at day 1, day 8, Day 15 and day 22 every 5 weeks in patients with advanced solid tumors. AACR-NCI-EORTC Int Conf Mol Target Cancer Ther 2001; A282.
- [6] Mita AC, Denis LJ, Rowinsky EK, et al. Phase I and pharmacokinetic study of XRP6258 (RPR 116258A), a novel taxane, administered as a 1-hour infusion every 3 weeks in patients with advanced solid tumors. Clin Cancr Res 2009; 15: 723–730.
- [7] Pivot X, Koralewski P, Hidalgo J, et al. A multicenter phase II study of XPR6258 administered as a 1-h i.v. infusion every 3 weeks in taxane-resistant metastatic breast cancer patients. Ann Oncol 2008; 19: 1547–1552.
- [8] De Bono JS, Oudard S, Ozguroglu M, et al. Prednisone plus cabazitaxel or mitoxantrone for metastatic castration-resistant prostate cancer progressing after docetaxel treatment: a randomised open-label trial. Lancet 2010; 376: 1147–1154.
- [9] Data on file. Clinical study report. EFC6193 (TROPIC).