Klinický pohled na psoriatickou artritidu a hodnocení progrese u spondyloartritid
Třeboňské revmatologické dny, které se konaly 9.–11. ledna 2019, přivítaly mezi přednášejícími uznávané odborníky z oblasti revmatologie. Přednáškové dny byly naplněny aktuálními poznatky a obohaceny klinickým pohledem specialistů v oboru. Sympozium společnosti Novartis, kterému předsedali prof. MUDr. Karel Pavelka, DrSc., a prof. MUDr. Jiří Vencovský, DrSc., z Revmatologického ústavu v Praze, bylo zaměřeno na psoriatickou artritidu a spondyloartritidy v širším kontextu.
Prvním řečníkem byla MUDr. Petra Hánová, Ph.D., odbornice na sonografii pohybového aparátu z Českých Budějovic, působící rovněž v Revmatologickém ústavu v Praze. Ve svém sdělení se věnovala tématu Praktické použití ultrazvuku při hodnocení psoriatické artritidy.
Psoriatická artritida v sobě pojímá několik anatomických druhů lézí, které je možné ultrazvukem detekovat, vedle entezitid a synovitid například změny kůže a nehtů. Ultrazvuk může detekovat léze zánětlivé i strukturální. Ze zánětlivých jsou to synovitidy, tenosynovitidy, entezitidy, tendinitidy, paratenonitidy a burzitidy. U strukturálních změn hodnotíme kortikální kost (eroze, nepravidelnosti či osteoprodukci), kalcifikace šlach a měkkých tkání nebo destruktivní poškození, jako jsou ruptury šlach.
V posledních letech jsou enteze a entezitidy vnímány jako samostatná oblast. Do orgánového poškození je možné zahrnout šlachu, kalkaneární kost, oblast burzy a vazivové chrupavky, které se samostatně podílejí na patogenezi entezitidy. Mnoho z těchto změn je možné sledovat ultrazvukem. Ke kvantifikaci a standardizaci ultrazvukových nálezů bylo publikováno množství skórovacích ultrazvukových indexů, příkladem může být GUESS (Glasgow Ultrasound Enthesitis Scoring System), MASEI (Madrid Sonographic Enthesitis Index), SEI (Spanish Enthesitis Index) a další. Liší se v počtu vyšetřovaných entezí či způsobem měření.
Entezitida je definována (Outcome Measures in Rheumatology – OMERACT, 2018) jako hypoechogenita a/nebo ztluštění úponu šlachy v blízkosti kosti, v případě aktivity vykazuje dopplerovské signály (do vzdálenosti 2 mm od povrchu kosti); mohou být přítomny eroze, entezofyty nebo kalcifikace jako známky strukturálního poškození. Tyto anatomické změny v předchozích definicích zahrnuty nebyly.
„Nepanuje jednoznačný konsenzus, kde entezitidu hledat. Dle doporučení OMERACT z loňského roku bychom měli zkoumat entezitidy bilaterálně, a to úpon kvadricepsu na patellu, úpon Achillovy šlachy, úpon plantární fascie či proximální a distální úpon patelár ligamenta,“ přiblížila doktorka Hánová. Diferenciálně diagnostickým problémem může být odlišení entezitidy od entezopatie. Výraz byl nově vymezen pro entezopatii související s mechanickým stresem včetně sportovních aktivit. Rozdíl je zejména ve vzdálenosti dopplerovských signálů (dále než uvedené 2 mm od kosti). Doktorka Hánová vyzdvihla důležitost odběru anamnézy a souvislosti s klinickým nálezem.
Přednášející se dále věnovala výhodám ultrazvukového vyšetření u entezitid. Klinické vyšetření entezitidy se závěrem palpační bolestivosti v místě enteze je velice nespecifické a nekoreluje (v oblasti Achillovy šlachy a zejména v oblasti lokte) se zobrazovacími vyšetřeními (ultrazvuk, magnetická rezonance). S rostoucím věkem se zvyšuje pravděpodobnost degenerativního a bolestivého postižení úponů, jež je rovněž možné ultrazvukem rozlišit. Vzhledem k většímu důrazu na přítomnost entezitid v rámci diagnózy, hodnocení aktivity a zejména pro potřebu klasifikace pacientů pro podání biologických chorobu modifikujících antirevmatických léčiv (bDMARDs) je vhodné podpořit diagnózu zobrazovací metodou. Někdy se může stát, že magnetická rezonance a ultrazvukové vyšetření si nálezem neodpovídají; může to být zapříčiněno i tím, že jednotlivá vyšetření definují odlišné znaky entezitidy. Ultrazvuk například není schopen zachytit osteitidu a edém kostní dřeně, které mohou způsobovat bolest. Vyšetření mohou pomoci v rámci diferenciální diagnostiky. O ultrazvuku se hovoří jako o metodě, která je závislá na kvalifikaci a zkušenosti vyšetřujícího lékaře, nicméně hodnocení shody hodnotitelů zobrazení magnetickou rezonancí ukázala rovněž velký rozptyl.
V případě synovitid, kde je viditelný výpotek, synoviální hypertrofie či vaskularizace jako známka aktivity, je využití ultrazvukového vyšetření obdobné – stanovení diagnózy, hodnocení aktivity nemoci v průběhu terapie, nalezení subklinické aktivity nebo hodnocení přítomnosti aktivního nálezu u artralgií (diferenciální diagnóza při deformacích kloubů).
U tenosynovitid má ultrazvukové vyšetření větší specificitu i senzitivitu než klinické vyšetření. Dle nové definice by měl být dopplerovský signál použit pouze v přítomnosti peritendinózního rozšíření šlachové pochvy v B módu, což umožňuje vyloučit normální vaskularizaci v oblasti šlachových pochev a poutek.
Daktylitida je klinická diagnóza, jedná se o lokální edém podkožní tkáně, tenosynovitidu a synovitidu přilehlých kloubů. Ultrazvuk je schopen rozpoznat jednotlivé komponenty a může být velmi nápomocný při navádění injekčních procedur.
Doktorka Hánová přiblížila přítomným klinická hodnocení posledních několika let, která se nově zaměřují na psoriázu nehtů zachycenou ultrazvukem. Dle provedeného klinického hodnocení (Acquitte, et al., 2017) je pro psoriázu nehtů typická ztráta trilaminární struktury, ztluštění nehtové matrix a zvýšená vaskularizace kůže v oblasti distálních interfalangeálních kloubů. Klinické hodnocení zkoumající změny nehtů u nemocných s psoriatickou artritidou v porovnání s pacienty s psoriázou a zdravými kontrolami (Janta, et al., 2017) hodnotilo morfologické a vaskulární abnormality nehtového lůžka. Oproti zdravým kontrolám byla síla nehtového lůžka a ploténky u nemocných signifikantně vyšší, v případě vaskularizace nebyly ale rozdíly signifikantní a nebyla nalezena žádná korelace vaskularizace se skóre NAPSI (Nail Psoriasis Severity Index).
Podle doporučení Evropské ligy proti revmatismu (EULAR, European League Against Rheumatism) pro použití zobrazovacích metod u periferních spondyloartritid, kam patří psoriatická artritida, můžeme použít ultrazvuk v případě podezření ke stanovení diagnózy (detekce periferní entezitidy, artritidy, burzitidy a tenosynovitidy). Díky dostatečné senzitivitě lze použít ultrazvuk k monitoraci aktivity (zejména u synovitidy a entezitidy). K monitoraci strukturálních změn je doporučen konvenční RTG snímek, nicméně ultrazvukové vyšetření může poskytnout přídatné informace.
Doktorka Hánová v závěru shrnula, že ultrazvukové vyšetření lze spolehlivě použít v denní klinické praxi pro diagnostiku a monitoraci aktivity synovitidy, tenosynovitidy a zejména entezitidy. Ultrazvukové vyšetření je dobrým pomocníkem v každodenní praxi revmatologa, jeho senzitivita je dobrá. Ultrazvukové nálezy jsou nicméně poměrně nespecifické v případě diferenciální diagnostiky artritid, některé nálezy se častěji nacházejí u psoriatické artritidy.
Jako druhý v pořadí předstoupil před auditorium MUDr. Heřman Mann z Revmatologického ústavu v Praze s přednáškou Terapie psoriatické artritidy sekukinumabem, výsledky z klinických studií i z běžné klinické praxe. Přítomným přiblížil data získaná z registrů, včetně registru ATTRA.
Sekukinumab byl u nás do klinické praxe uveden před necelými dvěma roky. V léčbě spondyloartritid se jedná o přípravek s odlišným mechanismem účinku. Inhibicí interleukinu 17A, cytokinu na hranici mezi přirozenou a adaptivní imunitou, dochází k potlačení autoimunitních procesů s nízkým rizikem nežádoucích účinků. Účinnost a bezpečnost sekukinumabu v léčbě psoriatické artritidy byla hodnocena v programu klinických studií FUTURE (1–5). Doktor Mann se podrobněji zaměřil na pětiletá data ze studie FUTURE 1 a na roční data ze studie FUTURE 5.
V klinické studii FUTURE 1, prvním klinickém hodnocení, jehož předmětem bylo i ověřování vhodné dávky, bylo použito z dnešního pohledu nestandardní dávkování sekukinumabu – počáteční intravenózní infuze (10 mg/kg) následovaná subkutánně podanou dávkou 75 mg nebo 150 mg. V současnosti schválenými jsou dávky 150 mg nebo 300 mg. Léčba byla kontrolována placebem, po určité době byli všichni pacienti převedeni na aktivní léčbu. Primárním cílovým ukazatelem byla odpověď ACR 20 (20% zlepšení dle kritérií American College of Rheumatology) ve 24. týdnu.
Sledování dále pokračovalo, data po třech letech ukazují, že ve skupině léčených dávkou 150 mg sekukinumabu nedošlo u více než 78 % pacientů k RTG progresi, a to jak u nemocných s dřívější expozicí anti TNF léčbě, tak ani u tzv. anti TNF naivních. V průběhu pěti let sledování byla možnost zintenzivnit dávkování; z pacientů, kteří užívali dávku 75 mg, jich 81 % v průběhu pěti let dávku zvýšilo (na 150 mg nebo 300 mg), ve skupině, kde byla podávána dávka 150 mg, došlo k jejímu zvýšení u 36 % nemocných. Při zvýšení léčebné dávky byl zaznamenán pokles podílu pacientů, kteří nedosáhli ACR 20, a naopak se zvýšil počet pacientů, kteří dosáhli léčebné odpovědi ACR 50. Podobné výsledky byly zaznamenány i v efektu na kožní postižení u psoriatické artritidy při hodnocení pomocí indexu PASI (Psoriasis Area and Severity Index). Ze sledování vyplývá, že v případě nižší účinnosti léčby máme při podávání sekukinumabu možnost navýšit dávku (dle schváleného dávkování tedy ze 150 mg na 300 mg).
V současnosti již máme
k dispozici pětiletá data (Mease‚ et al., 2018), která
ukazují, že dosažení léčebné odpovědi zůstává i v tomto
časovém horizontu zachováno (ACR 20 i ACR 50), graf 1A, B. Ve studii byly sledovány i parametry
subjektivního hodnocení pacientem (dle dotazníků HAQ DI
i SF 36 PCS), léčba vykazuje rovněž dobrý efekt
na entezitidy a daktylitidy.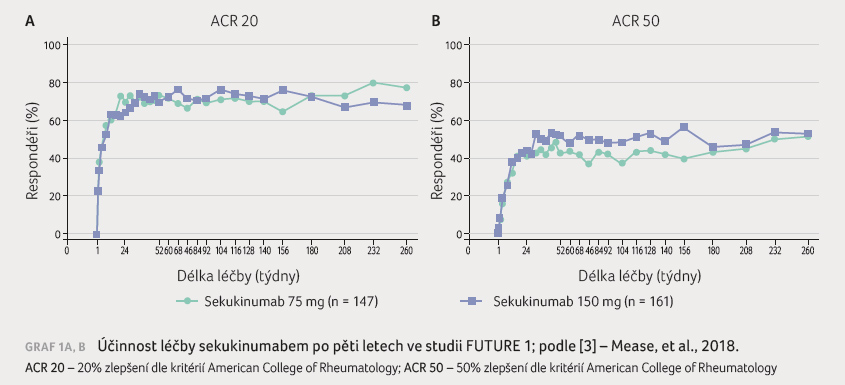
V klinickém hodnocení FUTURE 5 byli pacienti zařazeni do ramen s dávkou sekukinumabu 150 mg nebo 300 mg podávanou v prvním měsíci každý týden a dále pak jednou měsíčně, do placebové větve, ale rovněž do ramene s dávkou 150 mg sekukinumabu, avšak bez úvodní intenzivní terapie v prvním měsíci (tj. druhá subkutánní dávka byla podána až čtyři týdny po první). Odpověď ACR 20 ukazuje velmi dobrou účinnost léčby sekukinumabem, srovnatelnou s účinností u pacientů s předchozí anti TNF léčbou, ačkoliv čím byla dávka vyšší, tím byly výsledky pozitivnější. U pacientů, u nichž došlo k selhání při léčbě inhibitory TNF, byly rozdíly markantnější, proto dnešní schválená dávka sekukinumabu, která je u pacientů se selháním anti TNF léčby spojena s nejlepší odpovědí, je 300 mg.
I ve studii FUTURE 5 byl prokázán dobrý vliv na entezitidu a daktylitidu. Vliv na RTG progresi se v týdnu 24 jeví jako pozitivní, došlo k jejímu zpomalení ve všech skupinách s aktivní léčbou, nicméně hodnocení tohoto parametru po půlroce je zatím předčasné. Výsledky sledování po jednom roce, zveřejněné zatím pouze ve formě abstraktu, ukazují, že vliv na strukturální progresi byl nejvýraznější ve skupině s nejintenzivnější léčbou, nicméně ve všech léčebných větvích byla progrese poměrně nízká. Odpověď ACR 20 byla obdobná ve všech větvích (68,9 % sledovaných při dávce 300 mg, 64,1 % při dávce 150 mg a 65,8 % při dávce 150 mg sekukinumabu bez úvodní intenzivní fáze). Parametru PASI 75 dosáhl nejvyšší podíl sledovaných ve skupině s nejagresivnější léčbou (74,5 % nemocných ve skupině s dávkou 300 mg, 63,2 % ve skupině s dávkou 150 mg a 59,6 % ve skupině bez úvodní „loading“ fáze).
Data extrapolovaná z různých klinických hodnocení ukazují, že léčba má vliv nejen na výše uvedené klinické parametry, ale rovněž na hodnocení subjektivního vnímání pacienty. Dotazník (SF 36) sledující fyzické i psychické zdraví ukazuje výrazné zlepšení, a to jak u nemocných bez předchozí léčby anti TNFα, tak u pacientů, kde tato léčba selhala a sekukinumab je podáván jako léčba druhé linie.
Doktor Mann se v závěru svého vystoupení dále věnoval údajům z běžné klinické praxe. Vzhledem ke krátké době, kdy je sekukinumab k dispozici, jich zatím není mnoho. Nicméně data z německého registru (Kiltz, et al., 2018) ukazují na souboru 486 sledovaných pacientů s psoriatickou artritidou i ankylozující spondylitidou zmírnění kožního postižení v průběhu léčby sekukinumabem (PASI 100, PASI 75) a dále pozitivní vliv léčby na depresi (hodnoceno BD II). Ovlivnění psychického stavu pacientů je vnímáno jako velmi důležitý faktor.
Registr ATTRA přináší výsledky prvního roku léčby (duben 2017 až duben 2018) 222 pacientů s psoriatickou artritidou (Mann, et al., 2018). Celkem 163 nemocných bylo léčeno inhibitory TNF, 59 pacientů sekukinumabem. V obou souborech se zhruba u poloviny pacientů jednalo o první linii léčby biologiky. Při selhání první linie léčby byly obvykle upřednostněny jiné přípravky ze skupiny inhibitorů TNF, ale po selhání dvou a více inhibitorů TNF byl již preferován sekukinumab. Pozitivně byly vnímány výsledky sledování, které ukazují, že po selhání dvou inhibitorů TNF byl preferován sekukinumab, tedy účinné léčivo, ačkoliv na trhu přítomné jen krátce.
Bezpečnost léčby hodnocená v postmarketingové analýze (> 96 000 pacientoroků) z celého světa ukazuje, že výskyt infekcí, reakcí z přecitlivělosti, neutropenie, malignit, idiopatických střevních zánětů ani výskyt závažných kardiovaskulárních komplikací v průběhu léčby nestoupá (Deodhar, et al., 2018).
Sekukinumab zmírňuje příznaky psoriatické artritidy, zlepšuje kvalitu života, funkční stav a zpomaluje RTG progresi. Přípravek je indikován pro první linii léčby nebo po selhání terapie inhibitory TNF. Pro léčbu psoriatické artritidy se používá dávka 150 mg nebo v indikovaných případech 300 mg podávaných subkutánně. Léčba je dobře snášena, nejsou dostupné nové informace týkající se její bezpečnosti. Podle dat z registru ATTRA je sekukinumab používán v ČR jako lék první linie nebo po selhání léčby více inhibitory TNF, shrnul své vystoupení doktor Mann.
Třetí přednáška Modifikace choroby, modifikace života pacienta?, s níž vystoupil před auditorium profesor MUDr. Karel Pavelka, DrSc., z Revmatologického ústavu v Praze, se věnovala hodnocení strukturální progrese u spondyloartritid. Proč ji hodnotit s ohledem na vztah struktury a funkce, kvality života a práceschopnosti, jaké jsou možnosti hodnocení a jaká dostupná klinická sledování máme k dispozici.
Jako klíč k tématu přiblížil profesor Pavelka u ankylozující spondylitidy tzv. biopsychosociální model. Onemocnění je ve vztahu k řadě faktorů, které ovlivňují život pacienta. Vedle délky trvání choroby, komorbidit, vlivu nemoci na tělesné funkce a aktivity se uplatňují osobnostní rysy, věk, vzdělání a další faktory prostředí, jako jsou profese, pracovní podmínky i vnímání pracovního kolektivu. Klinická hodnocení ukazují, jak výrazný vliv tyto činitele mají, jak jsou významné pro práceschopnost (Boonen, et al., 2015).
Studie GESPIC (Poddubnyy, et al., 2018) doložila, jak RTG progrese u axiální spondyloartritidy koreluje s funkčním stavem, který je hodnocen pomocí parametru BASFI (Bath Ankylosing Spondylitis Functional Index). Funkční stav je určován jak strukturálním poškozením páteře, tak aktivitou nemoci. Zdá se, že aktivita nemoci má větší vliv na funkci v časném stadiu onemocnění. Strukturální progrese začíná být funkčně významnější u pacientů s rychlou progresí a u pacientů s pokročilou axiální spondyloartritidou. Rychlou progresí jsou ohroženi zejména nemocní s přítomnými syndesmofyty, s vysokou zánětlivou aktivitou a ti, kteří kouří. Diskutována je otázka biomarkerů (sklerostin, kalprotektin aj.), jejich prediktivní význam je třeba ještě ověřit, výsledky hodnocení jsou rozporuplné.
Ke zhodnocení radiografické progrese je k dispozici několik zobrazovacích technik. Konvenční RTG zobrazení je levnější variantou, široce dostupnou, umožňující rychlé vyhodnocení. Nevýhodou je radiační zátěž a neschopnost zobrazit spolehlivě hrudní páteř. Magnetická rezonance hodnotí zánětlivé změny kosti a měkkých tkání a umožňuje vizualizaci hrudní páteře, jedná se ale o finančně nákladnější a méně dostupné vyšetření a je zde omezeno hodnocení detekce nové kostní formace. Výpočetní tomografie (CT) je rychlá technika s vynikajícím zobrazením kosti, rovněž umožňuje vizualizaci hrudní páteře a je senzitivní metodou pro detekci kostní formace, nicméně využívá ionizační záření a je finančně nákladnější.
Stále nejhojněji využíváno je RTG zobrazení. Ke zhodnocení radiografické progrese byla vytvořena řada skórovacích systémů, v praxi se aplikuje zejména tzv. modifikované stoke skóre u ankylozující spondylitidy (modified Stoke Ankylosing Spondylitis Spine Score, mSASSS) s rozsahem hodnot 0–72. Metodikou, která se začíná využívat, je nízkodávková výpočetní tomografie skeletu (low dose CT scan), jak název napovídá, s nižší radiační zátěží.
Radiografická progrese je předmětem hodnocení mnoha klinických studií. Velkou pozornost vzbudilo například porovnání léčby inhibitory TNF (etanercept, infliximab, adalimumab) s historickou kohortou ze studie OASIS, které neukázalo výrazný vliv anti TNF léčby na rentgenovou progresi (van der Heijde, et al., 2008, 2009). Následně se ukázalo, že radiografickou progresi u ankylozující spondylitidy zpomalí tato léčba pravděpodobně až při dlouhodobém podávání trvajícím déle než čtyři roky (Maas, et al., 2017).
Ve studii
MEASURE 1 se sekukinumabem, která doložila dobrý a dlouhodobý
efekt léčby na aktivitu a funkční stav, byla hodnocena
i RTG progrese. U přibližně 80 % pacientů léčených
sekukinumabem nebyla popsána radiografická progrese (graf 2).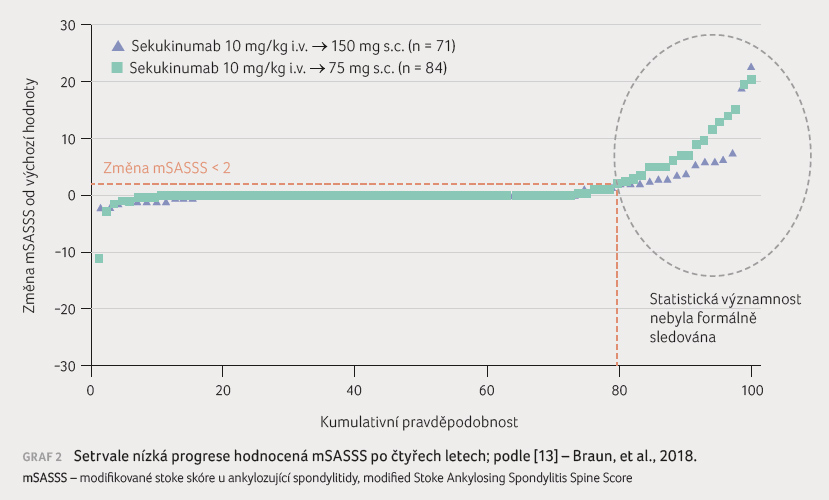
Profesor Pavelka se v další části věnoval datům z registru ATTRA, která jsou vyhodnocením kvality života 1 700 nemocných s ankylozující spondylitidou léčených biologickou léčbou. Kvalita života je intenzivně sledována, k jejímu posuzování je nejčastěji využíván dotazník SF 36, který sleduje různé aspekty života, jako jsou fyzikální funkce, bolest, celkové zdraví, sociální role aj. Data ukazují, že kvalita života nemocných léčených biologickou léčbou se blíží kvalitě života běžné populace.
Přednášející v závěru shrnul, že strukturální progrese ankylozující spondylitidy koreluje se zhoršováním funkce a práceschopnosti. Nejčastěji využívanou metodou hodnocení strukturální progrese je radiologické skóre mSASSS, v klinickém hodnocení využívané vždy jako sekundární cílový ukazatel. Zpomalení RTG progrese při biologické léčbě je průkazné až při jejím delším trvání (> 2 roky). U 79 % pacientů nebyla po čtyřech letech léčby sekukinumabem v dávce 150 mg pozorována radiografická progrese (změna skóre mSASSS < 2). Během dvou let se u pacientů léčených sekukinumabem objevil numericky vyšší počet jedinců bez progrese a numericky nižší změna mSASSS ve srovnání s kontrolní kohortou pacientů bez předchozí biologické léčby. Biologická léčba ankylozující spondylitidy nejen modifikuje průběh choroby, ale i průběh života, jak prokazují studie hodnotící kvalitu života, ale i práceschopnost těchto pacientů.
Redakčně zpracovala PharmDr. Kateřina Viktorová
Seznam použité literatury
- [1] Acquitter M, Misery L, Saraux A, et al. Detection of subclinical ultrasound enthesopathy and nail disease in patients at risk of psoriatic arthritis. Joint Bone Spine 2017; 84: 703–707.
- [2] Janta I, Baniandres Rodriguez O, Valor L, et al. Ultrasound nail assessment in psoriatic arthritis and psoriasis compared with healthy controls. Ann Rheum Dis 2017; 76(Suppl 2): 1414–1415.
- [3] Mease PJ, Kavanaugh A, Reimold A, et al. Secukinumab Provides Sustained Improvements in the Signs and Symptoms in Psoriatic Arthritis: Final 5 Year Efficacy and Safety Results from a Phase 3 Trial. Meeting Abstracts American College of Rheumatology Congress 2018, Abstr 2568.
- [4] Kiltz U, Kaestner P, Krauel H, et al. Real World Secukinumab Study in Ankylosing Spondylitis and Psoriatic Arthritis – Comorbidities and Extraarticular Manifestations: Incidence and Status throughout a Non‑Interventional Study in Germany. Meeting Abstracts American College of Rheumatology Congress 2018, Abstr 645.
- [5] Mann HF, Zavada J, Nekvindova L, et al. Real‑World Use of Secukinumab in Psoriatic Arthritis: First Year Data from the Czech National Registry. Meeting Abstracts American College of Rheumatology Congress 2018, Abstr 2592.
- [6] Deodhar AA, Gladman DD, McInnes IB, et al. Post‑Marketing Safety of Secukinumab in Adult Patients with Psoriasis, Psoriatic Arthritis and Ankylosing Spondylitis: Cumulative Analysis across >96,000 Patient‑Treatment Years Exposure. Meeting Abstracts American College of Rheumatology Congress 2018, Abstr 2582.
- [7] Boonen A, Boone C, Albert A, Mielants H. Understanding limitations in at‑work productivity in patients with active ankylosing spondylitis: the role of work‑related contextual factors. J Rheumatol 2015; 42: 93–100.
- [8] Poddubnyy D, Listing J, Haibel H, et al. Functional relevance of radiographic spinal progression in axial spondyloarthritis: results from the GErman SPondyloarthritis Inception Cohort. Rheumatology (Oxford) 2018; 57: 703–711.
- [9] van der Heijde D, Landewé R, Einstein S, et al. Radiographic progression of ankylosing spondylitis after up to two years of treatment with etanercept. Arthritis Rheum 2008; 58: 132401331.
- [10] van der Heijde D, Landewé R, Baraliakos X, et al. Radiographic findings following two years of infliximab therapy in patients with ankylosing spondylitis. Arthritis Care Res 2008; 69: 3063–3070.
- [11] van der Heijde D, Salonen D, Weissman BN, et al. Assessment of radiographic progression in the spines of patients with ankylosing spondylitis treated with adalimumab for up to 2 years. Arthritis Res Ther 2009; 11: R127.
- [12] Maas F, Arends S, Brouwer E, et al. Reduction in Spinal Radiographic Progression in Ankylosing Spondylitis Patients Receiving Prolonged Treatment With Tumor Necrosis Factor Inhibitors. Arthritis Care Res 2017; 69: 2011–2019.
- [13] Braun J, Baraliakos X, Deodhar A, et al. Secukinumab shows sustained efficacy and low structural progression in ankylosing spondylitis: 4‑year results from the MEASURE 1 study. Rheumatology (Oxford) 2018; doi: 10.1093/rheumatology/key375.