Kvadrivalentní meningokoková vakcína konjugovaná na protein CRM
K zabránění invazivních onemocnění způsobených bakteriemi Neisseria meningitidis séroskupiny A, C, W135 a Y je nyní k dispozici kvadrivalentní vakcína konjugovaná na protein CRM (Menveo). Tato meningokoková vakcína je určena k aktivní imunizaci dospívajících a dospělých osob; u těchto populačních skupin je dobře tolerována a imunogenní. Důkaz byl podán ve srovnávacích studiích s dalšími kvadrivalentními meningokokovými vakcínami (Menactra a Menomune). Vakcína se aplikuje intramuskulárně obvykle do deltového svalu v jedné dávce a může být podána i současně s jinými vakcínami.
Neisseria meningitidis způsobuje závažná bakteriální onemocnění v celosvětovém měřítku zpravidla ve formě meningitidy nebo jako celkové horečnaté onemocnění: sepsi či toxický šok (Waterhouseův-Friderichsenův syndrom). Vyvolávající patogen je mezi ostatními původci bakteriálních meningitid unikátní svojí schopností vyvolávat epidemie. Invazivní meningokoková onemocnění jsou i v éře antibiotik život ohrožující. Jejich zákeřnost spočívá ve velmi prudkém rozvoji klinického obrazu, který může progredovat často během pouhých několika hodin až do stadia, kdy veškerá léčba selhává, a může skončit i úmrtím. Vzhledem k praktickým obtížím s včasným rozeznáním tohoto onemocnění hraje rozhodující roli prevence [1].
V České republice se desítky let používala polysacharidová vakcína, následně byla zavedena vakcína konjugovaná. Z pěti nejčastějších séroskupin A, B, C, Y, W135 však byly očkováním pokryty pouze séroskupiny A a C. Zatím není licencována vakcína proti séroskupině B s celosvětovým pokrytím. Ochranu proti čtyřem zbývajícím séro-skupinám zajišťují kvadrivalentní vakcíny.
Kvadrivalentní vakcína konjugovaná na protein CRM197 (Menveo) je určena k aktivní imunizaci dospívajících (od 11 let) a dospělých osob k zabránění invazivních onemocnění, která jsou způsobena bakteriemi Neisseria meningitidis séroskupiny A, C, W135 a Y. Od srpna roku 2010 je k dispozici i u nás.
Složení
Jedna dávka (0,5 ml rekonstituované vakcíny) obsahuje:
- Neisseriae meningitidis A oligosacharidum 10 µg konjugovaný s proteinem Corynebacterium diphtheriae CRM197 16,7–33,3 µg,
- Neisseriae meningitidis C oligosacha-ridum 5 µg konjugovaný s proteinem Corynebacterium diphtheriae CRM197 7,1–12,5 µg,
- Neisseriae meningitidis W135 oligosacharidum 5 µg konjugovaný s proteinem Corynebacterium diphtheriae CRM197 3,3–8,3 µg,
- Neisseriae meningitidis Y oligosacha-ridum 5 µg konjugovaný s proteinem Corynebacterium diphtheriae CRM197 5,6–10,0 µg.
Pomocné látky v prášku: dihydrogenfosforečnan draselný a sacharóza.
Pomocné látky v roztoku: chlorid sodný, dihydrát hydrogenfosforečnanu sodného, monohydrát dihydrogenfosforečnanu sod-ného a voda na injekci.
Imunogenita
Účinnost vakcíny Menveo byla hodnocena v randomizovaných, multicentrických, kontrolovaných klinických studiích, které zahrnovaly dospívající (11–18 let), dospělé (19–55 let) a starší dospělé (56–65 let). 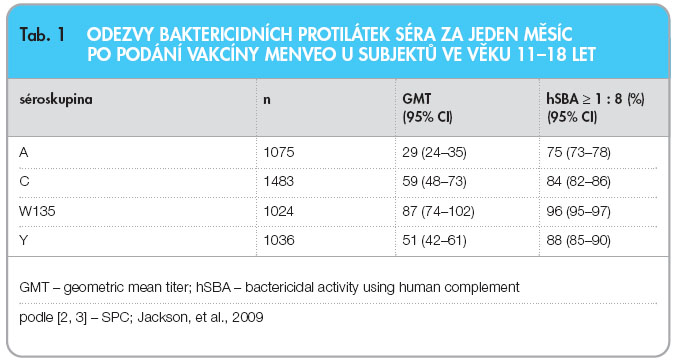 V pilotní studii (V59P13) byla účast-níkům aplikována buď dávka přípravku Menveo (n = 2649), nebo jako komparátor kvadrivalentní meningokoková vakcína konjugovaná s toxoidem difterie (ACWY-D, Menactra; n = 875). V populaci věkové skupiny 11–18 let byla imunogenita jediné dávky přípravku Menveo za jeden měsíc po očkování porovnávána s imunogenitou kvadrivalentní konjugované vakcíny Menactra. Výsledky hodnocení jsou shrnuty v tab. 1. Ve srovnání s vakcínou Menac-tra dosáhlo po podání vakcíny Menveo více jedinců protektivní imunitní odpovědi. Kritéria superiority vakcíny Menveo byla splněna pro některé séroskupiny v závislosti na věku a sledovaných cílech studie. Perzistence u séroskupiny C, W135 a Y byla demonstrována v populaci adolescentů s odstupem 12 měsíců po očkování.
V pilotní studii (V59P13) byla účast-níkům aplikována buď dávka přípravku Menveo (n = 2649), nebo jako komparátor kvadrivalentní meningokoková vakcína konjugovaná s toxoidem difterie (ACWY-D, Menactra; n = 875). V populaci věkové skupiny 11–18 let byla imunogenita jediné dávky přípravku Menveo za jeden měsíc po očkování porovnávána s imunogenitou kvadrivalentní konjugované vakcíny Menactra. Výsledky hodnocení jsou shrnuty v tab. 1. Ve srovnání s vakcínou Menac-tra dosáhlo po podání vakcíny Menveo více jedinců protektivní imunitní odpovědi. Kritéria superiority vakcíny Menveo byla splněna pro některé séroskupiny v závislosti na věku a sledovaných cílech studie. Perzistence u séroskupiny C, W135 a Y byla demonstrována v populaci adolescentů s odstupem 12 měsíců po očkování.
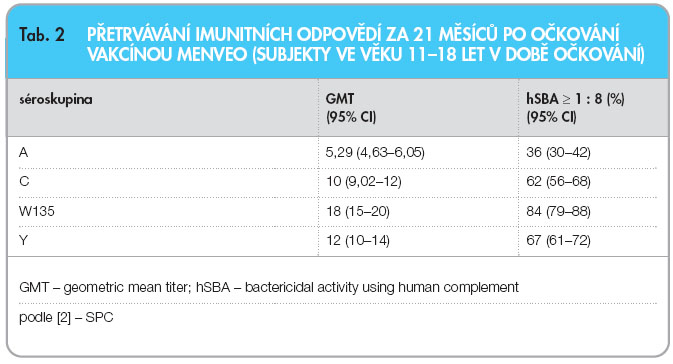 V jiné studii (V59P6), provedené u 524 osob, byla imunogenita vakcíny Menveo porovnávána s imunogenitou kvadrivalentní meningokokové polysacharidové vakcíny (ACWY-PS, Menomune). V této studii non-inferiority byla hodnocena imunogenita u dospívajících ve věku 11–17 let, kteří byli randomizováni k podání vakcíny Menveo nebo Menomune. Přípravek Menveo se ukázal být na základě odezvy non-inferiorní vůči vakcíně Menomune pro všechny séroskupiny. Přetrvávání imunitních odpovědí po podání vakcíny Menveo u adolescentů ve věku 11–18 let je uvedeno v tab. 2. Ve srovnání s vakcínou Menomune indukovala vakcína Menveo vyšší imunitní odpověď u adolescentů a dospělých. Vakcína Menveo demonstrovala u adolescentů perzistenci pro séroskupiny C, W135 a Y s odstupem 12 měsíců po očkování. Menveo může tedy nabídnout širokou séroskupinovou protekci (s výjimkou séro-skupiny B) u adolescentů a dospělých od 11 let věku [2–5].
V jiné studii (V59P6), provedené u 524 osob, byla imunogenita vakcíny Menveo porovnávána s imunogenitou kvadrivalentní meningokokové polysacharidové vakcíny (ACWY-PS, Menomune). V této studii non-inferiority byla hodnocena imunogenita u dospívajících ve věku 11–17 let, kteří byli randomizováni k podání vakcíny Menveo nebo Menomune. Přípravek Menveo se ukázal být na základě odezvy non-inferiorní vůči vakcíně Menomune pro všechny séroskupiny. Přetrvávání imunitních odpovědí po podání vakcíny Menveo u adolescentů ve věku 11–18 let je uvedeno v tab. 2. Ve srovnání s vakcínou Menomune indukovala vakcína Menveo vyšší imunitní odpověď u adolescentů a dospělých. Vakcína Menveo demonstrovala u adolescentů perzistenci pro séroskupiny C, W135 a Y s odstupem 12 měsíců po očkování. Menveo může tedy nabídnout širokou séroskupinovou protekci (s výjimkou séro-skupiny B) u adolescentů a dospělých od 11 let věku [2–5].
Aplikace a uchovávání
U dospívajících a dospělých osob se vakcína podává intramuskulárně obvykle do deltového svalu. Pro dospívající od 11 let a dospělé osoby se doporučuje jedna dávka (0,5 ml) vakcíny. Pro osoby ve věku 56–65 let jsou k dispozici pouze omezené údaje, pro osoby starší než 65 let tato data zatím zcela chybí.
Očkovací látka Menveo se uchovává v chladničce při standardní teplotě +2 °C až +8 °C. Před podáním je nutno ji rekonstituovat. Do prášku v lahvičce je třeba vstříknout celý obsah injekční stříkačky a jemně protřepat až do rozpuštění usazeného prášku. Vakcína je po rekonstituci čirým bezbarvým roztokem bez viditelných cizorodých částic. Po rekonstituci musí být přípravek okamžitě použit. Chemická a fyzikální stabilita po rekonstituci byla prokázána na dobu 8 hodin při teplotě uchovávání nižší než 25 °C [2].
Přípravek Menveo může být podán současně s jinými vakcínami. Tyto zahrnují:
– kombinovanou vakcínu proti tetanu, záškrtu se sníženou koncentrací a dávivému kašli s acelulární složkou ve snížené koncentraci (Tdap),
– vakcínu proti lidskému papilomaviru (HPV).
Uvedené vakcíny však musí být podány do jiné paže, než do které je provedena aplikace vakcíny Menveo.
Bezpečnost
Nežádoucí účinky
 Podobně jako všechny léky může mít i přípravek Menveo nežádoucí účinky, které se mohou vyskytnout s různou mírou pravděpodobnosti (tab. 3). Doba trvání nejčastějších nežádoucích účinků zaznamenaných během klinických studií se po-hybovala obvykle od jednoho do dvou dnů.
Podobně jako všechny léky může mít i přípravek Menveo nežádoucí účinky, které se mohou vyskytnout s různou mírou pravděpodobnosti (tab. 3). Doba trvání nejčastějších nežádoucích účinků zaznamenaných během klinických studií se po-hybovala obvykle od jednoho do dvou dnů.
Kontraindikace
Kontraindikací podání je alergie na účinnou nebo na kteroukoli další složku vakcíny. Protože uzávěr stříkačky obsahuje 10 % suchého přírodního kaučuku, doporučuje se zdravotnickým pracovníkům, aby zvážili poměr rizika a prospěchu před podáním vakcíny pacientům se známou anamnézou hypersenzitivity vůči latexu, ačkoli nebezpečí vzniku alergické reakce na latex je velmi nízké. Jiné specifické kontraindikace nejsou známy.
Doposud neexistuje dostatek údajů o imunitní odpovědi u imunokompromitovaných osob v důsledku užívání imunosupresivních léčiv, infekce HIV či jiných možných příčin. U těchto osob může být účinnost přípravku Menveo nižší. Rovněž zatím není dostatek dat o aplikaci u těhotných a kojících. Pokud existuje vysoké riziko onemocnění, může však lékař aplikaci i v tomto případě doporučit.
Doporučení
Dle nejnovějších doporučení světových expertů je vhodné provést základní očkování proti meningokokům konjugovanou vakcínou v dětském věku a přeočkování v preadolescentním věku. Národní imunizační komise doporučuje na základě dat tzv. surveillance v České republice a dle postupů v ostatních zemích následující vakcinační strategii pro Českou republiku:
- U dětí před nástupem do kolektivu, zpravidla ve věku 2–6 let, provést individuál-ně základní očkování jednou dávkou meningokokové konjugované vakcíny proti séroskupině C.
- U preadolescentů ve věku 11–14 roků provést očkování jednou dávkou meningokokové konjugované kvadrivalentní vakcíny proti séroskupinám A, C, Y, W135. Alternativně lze u preadolescentů použít meningokokovou konjugovanou vakcínu proti séroskupině C. Toto očkování by bylo přeočkováním u preadolescentů, kteří již byli očkováni v dětském věku meningokokovou konjugovanou vakcínou proti séroskupině C a primovakcinací u těch, kteří v dětském věku očkováni nebyli.
Doporučený interval mezi základním očkováním a přeočkováním je 7–10 roků, v případě zvýšeného epidemiologického rizika je možno jej zkrátit [6].
Seznam použité literatury
- [1] Plotkin S, Orenstein W, Offit P. Vaccines, 5th Edition, 2008: 399–434.
- [2] Souhrn údajů o přípravku (SPC) Menveo, srpen 2010.
- [3] Jackson LA, Baxter R, Reisinger K, et al. Phase III comparison of an investigational quadrivalent meningococcal conjugate vaccine with the licensed meningococcal ACWY conjugate vaccine in adolescents. Clin Infect Dis 2009; 49: e1–10.
- [4] Jackson LA, Jacobsen RM, Reisinger KS, et al. A randomized trial to determine the tolerability and immunogenicity of a quadrivalent meningococcal glycoconjugate vaccine in healthy adolescents. Pediatr Infect Dis J 2009; 28: 86–91.
- [5] Reisinger KS, Baxter R, Block SL. Quadrivalent meningococcal vaccination in adults: A Phase III comparison of an investigational conjugate vaccine, Menactra. Clin Vaccine Immunol 2009; 16: 1810–1815.
- [6] Doporučení Národní imunizační komise (NIKO), ČR, 2010.