Léčba nemocných s relabujícím či refrakterním agresivním non‑hodgkinským lymfomem: účinnost a bezpečnost pixantronu
Souhrn:
Léčebné možnosti nemocných s relabujícím/refrakterním agresivním non‑hodgkinským lymfomem (NHL) jsou omezené. Kombinace rituximabu s režimy obsahujícími antracykliny zůstávají základem terapie. Nicméně opakované podávání antracyklinů je spojeno se značným rizikem kardiotoxicity. Pixantron je cytostatikum antracyklinového typu se zachovanou antitumorózní aktivitou a sníženou kardiotoxicitou, které má prokazatelnou účinnost v léčbě NHL. Na základě výsledků mezinárodní randomizované studie PIX 301 byla monoterapie pixantronem schválena Evropskou lékovou agenturou (EMA) pro léčbu dospělých pacientů s opakovaně relabujícím či refrakterním agresivním B‑buněčným NHL.
Key words: pixantrone – diffuse large B‑cell lymphoma – cardiotoxicity – anthracyclines.
Summary:
Treatment options for recurrent/refractory aggressive non‑Hodgkin’s lymphoma (NHL) are limited. Rituximab combined with anthracycline based regimens remain the mainstay of therapy. However, repeated administration of anthracyclines is associated with substantial risk of cardiotoxicity. Pixantrone is anthracycline‑like cytostatic with preserved antitumor activity and decreased cardiotoxicity with proven efficacy in the treatment of NHL. On the basis of results from an international randomized PIX 301 trial, pixantrone monotherapy was approved by the European Medicines Agency (EMA) for the treatment of adults with multiply relapsed or refractory aggressive B‑NHL.
Úvod
Difuzní velkobuněčný B lymfom (diffuse large B cell lymphoma, DLBCL) je nejčastěji se vyskytujícím histologickým podtypem non hodgkinských lymfomů (non Hodgkin lymphoma, NHL) na západní polokouli [1]. Jedná se o agresivní onemocnění s heterogenním biologickým a klinickým chováním. Přes nesporné pokroky v léčbě v poslední dekádě, kterých bylo dosaženo především začleněním anti CD20 monoklonální protilátky rituximabu do léčebných protokolů, dochází asi u 30–35 % nemocných k relapsům po první linii léčby. Pouze 10 % z těchto nemocných dosáhne dlouhodobé remise onemocnění, dochází k relapsům a k rozvoji refrakterní choroby s extrémně nepříznivou prognózou (medián celkového přežití OS [overall survival] 4–7 měsíců) [2,3]. Příčinou neúspěšné léčby je rozvoj chemorezistence, nemožnost podat intenzivní režimy pro závažné přidružené choroby či toxicita terapie. V případě využití antracyklinů, které jsou základem léčebných režimů, je limitujícím faktorem kardiotoxicita. Tento přehledový článek se věnuje pixantronu, cytostatiku antracyklinového typu se zachovanou antitumorózní aktivitou a sníženou kardiotoxicitou.
Charakteristika, farmakodynamika a farmakokinetika pixantronu
Pixantron dimaleinát je azaanalog anthrachinonu, který je strukturně podobný doxorubicinu. Strukturální změny pixantronu v porovnání s molekulou doxorubicinu jsou znázorněny na obr. 1. Díky modifikacím se pixantron kovalentně váže na DNA, má sníženou schopnost produkovat reaktivní formy kyslíku, vázat železo a způsobuje nižší tvorbu metabolitů alkoholu, jež jsou spojeny s kardiotoxicitou antracyklinů. Důležité je, že působení pixantronu je zesíleno v přítomnosti methylovaných CpG dinukleotidů, které ovlivňují buněčnou proliferaci u maligních onemocnění. Působení na enzym topoizomerázu IIα je u pixantronu nižší [4]. Pixantron ovlivňuje spíše přesnost v průběhu mitózy a segregace genetického materiálu [5].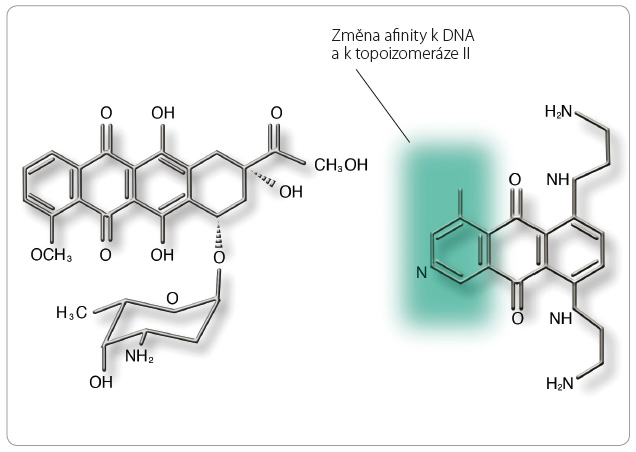
Plazmatické koncentrace pixantronu dosáhly po intravenózním podání maximální hodnoty na konci infuze a poté polyexponenciálně klesaly. Farmakokinetika pixantronu byla v rozmezí podávaného množství 3–105 mg/m2 nezávislá na dávce a nebyly pozorovány žádné podstatné rozdíly při užívání tohoto léčivého přípravku samostatně nebo ve studiích s kombinacemi přípravků.
Distribuční objem pixantronu je velký (26 litrů) a vazba na plazmatické bílkoviny činí 50 %. Pixantron je metabolizován velmi omezeně na acetylované metabolity. V jeho eliminaci se dominantně uplatňuje exkrece stolicí, naopak vylučování ledvinami má malý význam (< 10 %). Plazmatická clearance je vysoká (0,8–1,3 l/h/kg). V průběhu léčby pixantronem v dávkách ≥ 75 mg/m2/týden dochází charakteristicky k reverzibilnímu modravému zbarvení kůže a moče [6], které zpravidla vymizí v průběhu několika dnů až týdnů podle toho, jak je lék z těla vylučován.
Účinnost
V rámci studií fáze I byla zkoumána farmakokinetika, farmakodynamika a maximální tolerovatelná dávka pixantronu u nemocných s NHL, s chronickou lymfocytární leukemií a také u pacientů se solidními tumory [6–8]. Pixantron byl podáván ve dvou léčebných schématech: 1× za 3 týdny nebo 1× týdně (3 týdny + 1 týden pauza). Závažná neutropenie byla hlavním nežádoucím účinkem limitujícím dávku (low dose test, LDT), naopak závažná trombocytopenie a anémie se vyskytovaly vzácně. U žádného z nemocných nebyla zaznamenána kardiovaskulární příhoda. Z hematologického pohledu je nejvýznamnější studie německých autorů Borchmanna a kol. [8], v níž bylo pixantronem (v dávce 5–84 mg/m2) léčeno 26 pacientů s refrakterním či pokročilým NHL (nejčastěji DLBCL). U pěti nemocných byla pozorována léčebná odpověď (kompletní odpověď u tří pacientů). Ve studii AZA 106 prokázala kombinace pixantron (120 mg/m2), fludarabin, dexamethason a rituximab u 29 nemocných s indolentním relabujícím nebo refrakterním NHL uspokojivou léčebnou odpověď (overall response rate [ORR] 89 %) s celkovým přežitím 92 % v průběhu tří let [9]. Kardiotoxicita byla i v této studii přijatelná. U pixantronu bylo v klinických studiích pozorováno přechodné a na dávce nezávislé snížení ejekční frakce (EF) (19,1 %), srdeční selhání se objevilo u necelých 9 % nemocných, 4,4 % pacientů vykazovalo tachykardii, arytmii, sinusovou tachykardii nebo bradykardii [19].
Do studie fáze II u dospělých s agresivním relabujícím NHL (DLBCL 73 %, lymfom z plášťové zóny 27 %) bylo zařazeno 33 nemocných (věkový medián 66 let; medián počtu předchozích linií 2; předchozí autologní transplantace krvetvorných buněk n = 2). Pixantron byl podáván v dávce 85 mg/m2 v den 1, 8 a 15 (6 cyklů po 28 dnech) [10]. Celkové léčebné odpovědi/kompletní remise (complete response, CR) bylo dosaženo u 9/5 pa-
cientů. Většina nemocných nedokončila plánovanou léčbu (58 %) z důvodu progrese onemocnění; nedostatečná účinnost byla pozorována u nemocných s lymfomem z buněk plášťové zóny (ORR 14 %). Pixantron byl velmi dobře tolerován. Přestože byla většina pacientů předléčena antracykliny, k poklesu ejekční frakce levé komory (left ventricular ejection fraction, LVEF) o více než 10 % došlo pouze u tří pacientů.
Multicentrická randomizovaná studie nazvaná PIX 301 (EXTEND) testovala podání pixantronu u pacientů s agresivním relabujícím/refrakterním NHL (n = 140) [11,12]. Monoterapie pixantronem podávaným v dávce 85 mg/m2 1., 8. a 15. den 28denního cyklu byla porovnávána s chemoterapií (etoposid, gemcitabin, ifosfamid, mitoxantron, oxaliplatina či vinorelbin). Léčebné výsledky byly hodnoceny podle principu „intention to treat“. Léčba pixantronem vedla častěji ke kompletní remisi (CR či nepotvrzená kompletní remise [uCR] u 24 % vs. 7 % pacientů; p = 0,009). Nebylo dosaženo statisticky významného prodloužení celkového přežití (OS 10,2 měsíce vs. 7,6 měsíce, HR [hazard ratio] 0,79; 95% CI [confidence interval] 0,53–1,18; p = 0,251), ale bylo prodlouženo období do progrese (PFS 5,3 měsíce vs. 2,6 měsíce; HR 0,60; 95% CI 0,42–0,86; p = 0,005). Starší nemocní (věk ≥ 65 let), ženy a nemocní s relabujícím NHL, kteří nebyli předléčeni rituximabem a podstoupili více než tři předchozí léčebné linie, měli větší prospěch z terapie pixantronem. S ohledem na nízký počet pacientů zařazených do studie byla studie předčasně ukončena a pravděpodobně z tohoto důvodu nebylo možné dosáhnout jejího primárního cíle (vyššího počtu kompletních remisí na konci léčby u pacientů s nezávislým čtením histologického nálezu).
V roce 2016 byla publikována retrospektivní analýza britských autorů, která posuzovala účinnost pixantronu u nemocných s relabujícím/refrakterním DLBCL v běžné praxi [13]. Dávkování pixantronu bylo identické jako ve studii PIX 301. Celkově bylo hodnoceno 90 pacientů s věkovým mediánem 66 let (rozmezí 20–86 let). Léčebné odpovědi – celkové a částečné – dosáhlo 24 % nemocných (CR 10 %; PR [partial response] 14 %) a medián období do progrese a celkové přežití byly velmi krátké (PFS 2 měsíce; OS 3,4 měsíce). Přes veškerá rizika vyplývající z retrospektivního hodnocení je studie přínosná, neboť poskytuje informace o účinnosti pixantronu u nemocných, kteří byli předléčeni novějšími přístupy, jež nebyly použity jako komparátory ve studii PIX 301 (např. bendamustin či lenalidomid).
Ve studii PIX 302 byli nemocní s relabujícím/refrakterním indolentním NHL (n = 38) randomizováni k léčbě pixantronem + rituximabem nebo k monoterapii pixantronem. Výsledky ukázaly vyšší účinnost režimu pixantron + rituximab (ORR/CR 75/35 % vs. 33/11 %) a delší dobu do progrese (13 měsíců vs. 8 měsíců) [14]. Studie byla předčasně ukončena pro malý nábor pacientů, proto nebyl k dispozici dostatečný počet nemocných pro statistickou významnost nálezů.
Studie PIX 306 představuje aktuálně probíhající sledování, které porovnává účinnost pixantronu s rituximabem proti gemcitabinu s rituximabem u relabujících nemocných s DLBCL (včetně transformací z indolentních lymfomů) nevhodných k intenzivní léčbě (autologní transplantace krvetvorných buněk) [15].
Bezpečnost
Nejčastější nežádoucí účinky spojené s léčbou pixantronem jsou shrnuty v tab. 1. Na základě dat z provedených studií s pixantronem lze shrnout, že závažné infekce se vyskytují vzácně a hematologická toxicita je přijatelná. Podávání pixantronu je stejně jako u jiných cytotoxických přípravků doprovázeno nauzeou, zvracením či průjmy, ale tyto nežádoucí účinky byly zpravidla mírného stupně. Ani závažná hepatotoxicita či rozvoj ledvinného selhání nebyly pozorovány.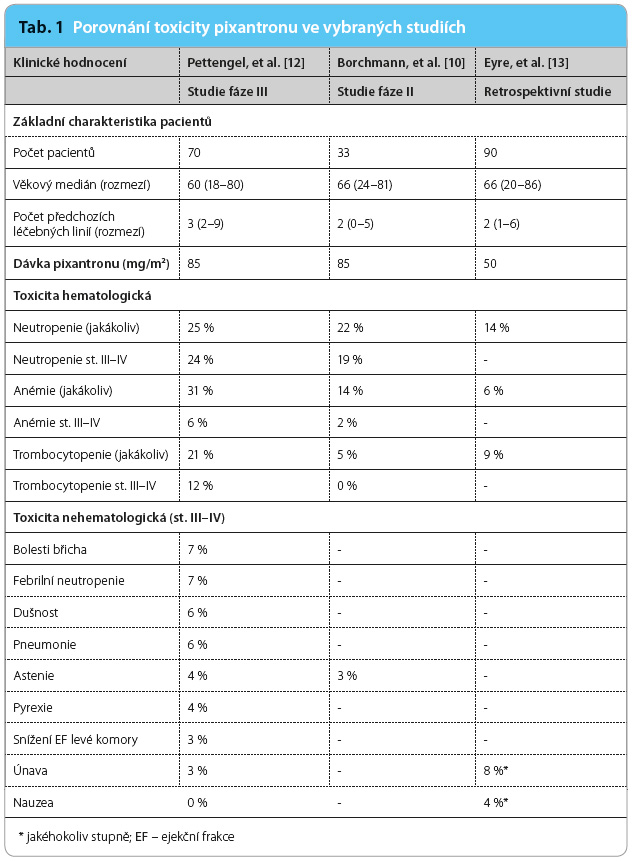
Jak již bylo uvedeno, unikátní vlastností pixantronu je nízká incidence kardiotoxicity ve srovnání s jinými antracykliny [16–18]. V preklinickém testování byl zkoumán pixantron u myší, a to v dávce až 27 mg/kg podávané 2× týdně po dobu čtyř týdnů. Kardiotoxické účinky nebyly pozorovány ani při opakovaném podání. Naopak mitoxantron byl podle předpokladu kardiotoxický ve všech zkoumaných dávkách (0,6–1,5 mg/kg). Důležitý byl také poznatek, že pixantron nezhoršoval již přítomné srdeční postižení, k němuž dochází při léčbě doxorubicinem či mitoxantronem. Klinické studie fáze I a II následně potvrdily nízkou kardiotoxicitu léčby pixantronem. V rozporu s předchozími výsledky byl průkaz vyššího výskytu kardiálního postižení, které bylo pozorováno u nemocných léčených pixantronem v rámci randomizované studie PIX 301 ve srovnání s kontrolní větví studie (35 % vs. 21 %). Konkrétně došlo k asymptomatickému snížení ejekční frakce levé komory (medián snížení LVEF o 4 % proti vstupním hodnotám). Nebyla zaznamenána kumulativní či dávkově závislá toxicita pixantronu. Příčinou vyšší incidence kardiotoxicity mohla byt předchozí léčba antracykliny. Ve skupině léčených pixantronem byly přítomny chronické srdeční selhání či kardiomyopatie u pěti pacientů, zatímco v kontrolní větvi nebyl žádný takový pacient. Lékové interakce pixantronu nebyly zkoumány v žádné studii. Studie in vitro poukázaly na možnou inhibici smíšeného typu CYP1A2 a CYP2C8 (nejvýznamnějšími enzymy cytochromu P450), která může mít klinický význam (potenciální zvýšení koncentrací theofylinu, warfarinu, amitriptylinu, haloperidolu, clozapinu, ondansetronu či propranololu při terapii pixantronem) [19].
Indikace a dávkování
Podle aktuální platné souhrnné informace o přípravku (SPC) je pixantron indikován v monoterapii u dospělých pacientů s opakovaně relabujícím nebo refrakterním agresivním NHL z B lymfocytů. Přínos léčby pixantronem jako chemoterapie páté nebo vyšší linie u pacientů, kteří neodpověděli na poslední léčbu, nebyl prokázán. Doporučení dávkování pixantronu je 50 mg/m2 podávaných v den 1, 8 a 15 každého 28denního cyklu (až 6 cyklů). Pixantron je aplikován formou pomalé intravenózní infuze (nejméně 60 minut) s použitím in line filtru. Dávky pixantronu se upravují podle eventuální hematologické toxicity při předchozím cyklu, proto je nutná pečlivá monitorace parametrů krevního obrazu v průběhu léčby. Pro nemocné s ledvinnou nedostatečností není v SPC k dispozici žádné doporučení, jak postupovat. Je nutné pamatovat na to, že nemocní s koncentrací kreatininu převyšující 1,5násobek horního limitu normálního rozmezí byli z klinických studií vyřazeni. Podobně chybí i konkrétní doporučení pro nemocné s mírnou či středně těžkou poruchou funkce jater. Pixantron se nedoporučuje používat u pacientů s těžkou poruchou exkreční funkce jater. Dávku pixantronu není nutné upravovat u starších pacientů (≥ 65 let). V průběhu léčby pixantronem je nutné pečlivě monitorovat kardiální funkce [19].
Závěr
V současnosti je rituximab s antracykliny základem terapie nemocných s agresivním NHL, a to bez ohledu na věk pacientů či na pokročilost onemocnění. Limitujícím faktorem léčby antracykliny je jejich kumulativní kardiotoxicita. Dále je nutné brát v potaz také možné zhoršení preexistujícího srdečního onemocnění u starších či komorbidních pacientů při této léčbě. S ohledem na příznivý bezpečnostní profil (zejména minimální kardiotoxicita) pixantron poskytuje vhodnou alternativu k antracyklinům. Na základě výsledků klinické studie PIX 301 byla Evropskou lékovou agenturou (European Medicines Agency, EMA) v roce 2012 registrována monoterapie pixantronem pro nemocné s relabujícím/refrakterním agresivním B NHL. Probíhající klinické studie přinesou odpovědi na otázky možného začlenění pixantronu do kombinačních režimů pro nemocné s NHL. V České republice je pixantron doporučen jako jedna z léčebných možností starších nemocných s DLBCL dle aktuálních Doporučení pro léčbu maligních lymfomů od Kooperativní lymfomové skupiny České hematologické společnosti (ČHS) ČLS JEP.
Seznam použité literatury
- [1] Morton LM, Wang SS, Devesa SS, et al. Lymphoma incidence patterns by WHO subtype in the United States, 1992–2001. Blood 2006; 107: 265–276.
- [2] Van Den Neste E, Schmitz N, Mounier N, et al. Outcome of patients with relapsed diffuse large B‑cell lymphoma who fail second‑line salvage regimens in the International CORAL study. Bone Marrow Transplant 2016; 51: 51–57.
- [3] Crump M, Neelapu SS, Farooq U, et al. Outcomes in refractory aggressive diffuse large B‑cell lymphoma (DLBCL): Results from the international SCHOLAR‑1 study. 2016 ASCO Annual Meeting 2016.
- [4] De Isabella P, Palumbo M, Sissi C, et al. Topoisomerase II DNA cleavage stimulation, DNA binding activity, cytotoxicity, and physico‑chemical properties of 2‑aza‑ and 2‑aza‑oxide‑anthracenedione derivatives. Mol Pharmacol 1995; 48: 30–38.
- [5] Beeharry N, Di Rora AG, Smith MR, et al. Pixantrone induces cell death through mitotic perturbations and subsequent aberrant cell divisions. Cancer Biol Ther 2015; 16: 1397–1406.
- [6] Faivre S, Raymond E, Boige V, et al. A phase I and pharmacokinetic study of the novel aza‑anthracenedione compound BBR 2778 in patients with advanced solid malignancies. Clin Cancer Res 2001; 7: 43–50.
- [7] Dawson LK, Jodrell DI, Bowman A, et al. A clinical phase I and pharmacokinetic study of BBR 2778, a novel anthracenedione analogue, administered intravenously, 3 weekly. Eur J Cancer 2000; 36: 2353–2359.
- [8] Borchmann P, Schnell R, Knippertz R, et al. Phase I study of BBR 2778, a new aza‑anthracenedione, in advanced or refractory non‑Hodgkin’s lymphoma. Ann Oncol 2001; 12: 661–667.
- [9] Srokowski TP, Liebmann JE, Modiano MR, et al. Pixantrone dimaleate in combination with fludarabine, dexamethasone, and rituximab in patients with relapsed or refractory indolent non‑Hodgkin lymphoma: phase 1 study with a dose‑expansion cohort. Cancer 2011; 117: 5067–5073.
- [10] Borchmann P, Morschhauser F, Parry A, et al. Phase‑II study of the new aza‑anthracenedione, BBR 2778, in patients with relapsed aggressive non‑Hodgkin’s lymphomas. Haematologica 2003; 88: 888–894.
- [11] Influence of anesthetic procedures on surgical sequelae. An update. Holland, September 7–9, 1987. Acta Chir Scand Suppl 1989; 550: 1–193.
- [12] Pettengell R, Coiffier B, Narayanan G, et al. Pixantrone dimaleate versus other chemotherapeutic agents as a single‑agent salvage treatment in patients with relapsed or refractory aggressive non‑Hodgkin lymphoma: a phase 3, multicentre, open‑label, randomised trial. Lancet Oncol 2012; 13: 696–706.
- [13] Eyre TA, Linton KM, Rohman P, et al. Results of a multicentre UK‑wide retrospective study evaluating the efficacy of pixantrone in relapsed, refractory diffuse large B‑cell lymphoma. Br J Haematol 2016; 173: 896–904.
- [14] Santoro A, Voglova J, Gabrail N, et al. Comparative trial of BBR 2778 (pixantrone) + rituximab vs single agent rituximab in the treatment of relapsed/refractory indolent non‑Hodgkin’s lymphoma (NHL). J Clin Oncol 2006; 24(No 18S): 7578.
- [15] Belada D, Georgiev P, Dakhil S, et al. Pixantrone‑rituximab versus gemcitabine‑rituximab in relapsed/refractory aggressive non‑Hodgkin lymphoma. Future Oncol 2016; 12: 1759–1768.
- [16] Longo M, Della Torre P, Allievi C, et al. Tolerability and toxicological profile of pixantrone (Pixuvri®) in juvenile mice. Comparative study with doxorubicin. Reprod Toxicol 2014; 46: 20–30.
- [17] Cavalletti E, Crippa L, Mainardi P, et al. Pixantrone (BBR 2778) has reduced cardiotoxic potential in mice pretreated with doxorubicin: comparative studies against doxorubicin and mitoxantrone. Invest New Drugs 2007; 25: 187–195.
- [18] Beggiolin G, Crippa L, Menta E, et al. Bbr 2778, an aza‑anthracenedione endowed with preclinical anticancer activity and lack of delayed cardiotoxicity. Tumori 2001; 87: 407–416.
- [19] Pixuvri, Souhrn údajů o přípravku, 2016.