Leuprorelin – nová depotní léková forma
Zhoubné nádory prostaty patří k nejčastějším zhoubným nádorům mužské populace, jejich incidence trvale narůstá. Celkově v evropských zemích představují asi 16 % všech malignit mužské populace, v roce 2004 bylo v zemích EU zachyceno 237 800 onemocnění. Mortalita se pohybuje kolem 4 %. Naše snaha o časnou detekci onemocnění vede k posunu stadií směrem k lokalizovaným a lokálně pokročilým formám onemocnění. Předpokládaný kurativní vliv léčby se omezuje pouze na lokalizované formy onemocnění, ale i ve vyšších stadiích vede multimodální léčba založená na androgenní supresi k dlouhodobé stabilizaci. Zlatým standardem endokrinní léčby karcinomu prostaty byla orchiektomie. Pro nežádoucí vedlejší účinky a psychický vliv bývá v moderní medicíně chirurgická kastrace nahrazena kastrací farmakologickou. Účinnost srovnatelnou s orchiektomií vykazují LHRH analoga. Obdobně jako orchiektomie vede podávání LHRH analog k oddálení progrese nádoru, ke zlepšení příznaků a k prodloužení nádorově specifického přežití. Podle doporučení Evropské urologické asociace je aplikace LHRH analog základním postupem hormonální suprese pacientů s lokálně pokročilým a generalizovaným karcinomem prostaty. K zajištění optimálního snížení hladin testosteronu, srovnatelného s chirurgickou kastrací, byla připravena nová léková forma leuprorelinu. Vedlejší účinky léčby jsou srovnatelné s účinky analog nižší generace.
Úvod
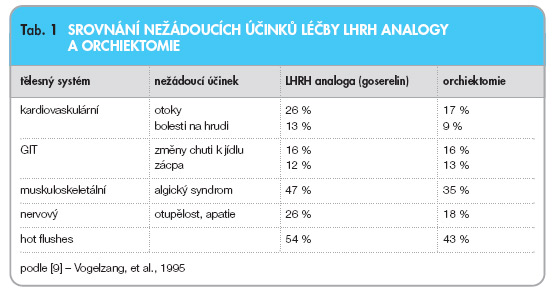
Před více než šedesáti lety prokázal Charles Huggins vliv androgenů na růst a přežití nádorových buněk prostaty. Za své objevy byl v roce 1966 oceněn Nobelovou cenou za medicínu. Více než 40 let představuje suprese androgenů základní léčebnou modalitu v endokrinní léčbě pokročilého a generalizovaného karcinomu prostaty, který je hormonálně dependentní. Kastrace navodí rychlou, důkladnou a trvalou supresi testikulárních androgenů. Od optimální farmakologické kastrace očekáváme shodný efekt. Původní alternativou chirurgické kastrace bylo podávání estrogenů. Častý výskyt retence tekutin, městnavé srdeční nedostatečnosti, hluboké žilní trombózy, plicní embolizace, infarktu myokardu či cévních mozkových příhod navozených estrogeny omezil jejich podávání. Objev struktury gonadoliberin releasing hormonů (LHRH), který učinil profesor Andrew Schelly, vedl k vývoji syntetických inhibitorů peptidu LHRH. Jednotlivá LHRH analoga na trhu (goserelin, buserelin, leuprorelin, triptorelin) se liší sekvencí aminokyselin na pozici 6 a 10. Obecně je léčba analogy spojena s přechodným zvýšením hladin testosteronu v prvním týdnu aplikace a u nemocných s generalizací dochází ke vzniku tzv. flare-up fenoménu s exacerbací obtíží, včetně algického syndromu, kardiovaskulárních obtíží a mikčních příznaků [2]. Předcházet obtížím lze přidáním antiandrogenu v úvodu terapie. Ovlivnění sérové hladiny testosteronu LHRH analogy je spojeno s nežádoucími účinky, jako jsou návaly horka (hot flushes), ztráta libida a impotence. Obvyklou aplikační formou LHRH analog jsou depotní měsíční a tříměsíční injekce. Srovnání nežádoucích účinků léčby LHRH analogy s nežádoucími účinky provázejícími chirurgickou kastraci předkládá tab. 1.
Významný rozdíl je pouze ve výskytu tzv. hot flushes. Podávání LHRH analog samostatně i v kombinaci s antiandrogeny je spojeno s poklesem kostní denzity a s možným rozvojem osteoporózy. Hormonální suprese se podílí na vzniku metabolického syndromu se zvýšením rizika kardiovaskulárních onemocnění. Ovlivnění nežádoucích účinků endokrinní léčby je nezbytnou součástí komplexní léčby uroonkologicky nemocného (tab. 2) [3].
LHRH analoga mohou být podávána adjuvantně, neoadjuvantně nebo intermitentně.
Dosažení kastračních hladin testosteronu při androgenní supresi je považováno za nezbytné pro léčebnou odpověď. Historicky je za hranici kastrace považována hladina 1,73 nmol/l (tj. 50 ng/dl). Tato hladina vycházela z poznatků o výši hladin zjištěných u pacientů po kastraci metodami dostupnými v minulých letech. Moderní metody chemoluminiscence posunuly střední hodnotu testosteronu na 0,7 nmol/l (20 ng/dl).
Hladiny testosteronu při aplikaci LHRH analog nejsou neměnné. Změny hladin testosteronu při dlouhodobé aplikaci LHRH analog mají dvojí původ. Při aplikaci dochází k vzestupu hladiny testosteronu po podání analog (mini flare) nebo dojde k průlomu odpovědi vůči přípravku a pozvolnému nárůstu navzdory dalšímu podávání. K úniku z hormonální kontroly dochází u 31 % nemocných s hladinami mezi 0,7–1,73 nmol/l a u 25 % pacientů s hladinami nad 1,73 nmol/l. Doba do PSA progrese u nemocných s nedostatečnými hladinami testosteronu dosahuje 88 měsíců ve srovnání se 137 měsíci u nemocných s kastračními hladinami [5]. Doplnění bikalutamidu (antiandrogenu) do kombinační léčby působící maximální androgenní blokádu (MAB) prolonguje dobu do progrese. První generace LHRH analog u 13–40 % pacientů nevede k dosažení kastračních hodnot testosteronu a až v 10 % je spojena s výskytem tzv. mini flare výkyvů hladin testosteronu [8]. Opakovaná aplikace LHRH analog první generace je v dlouhodobém sledování spojena s únikem z hormonální kontroly ve 2–24 % [5]. Konvenční LHRH agonisté nedosáhnou či neudrží doporučenou kastrační hladinu u signifikantního počtu pacientů. Výsledky nových studií vedou k nezbytnosti definovat „optimální kontrolu testosteronu" srovnatelnou s orchiektomií.
Prostata a androgenní závislost
Přestože byla již před desítkami let rozpoznána hormonální citlivost buněk karcinomu prostaty (KP) na přítomnost androgenů, není tato léčebná modalita dostatečně účinná u všech případů onemocnění nebo se v průběhu léčby nádor stává hormonálně independentním. Této změně senzitivity je již dlouhou dobu věnována velká pozornost a bylo dosaženo značných pokroků v rozpoznání mechanismu posunu hormonální dependence. Protože tyto změny mohou zásadně ovlivnit náš léčebný postup, považujeme za užitečné se zde též stručně zmínit o buněčné morfologii a biologii prostatické žlázy, jak je dnes známa. I když jde o výsledky experimentální, mají dosažené výsledky velmi blízko k praktickému využití.
Prostata je složena ze stromatu a složky epiteliální. Je protkána bohatou cévní sítí, obsahuje hladkou svalovinu a nervová vlákna. Pro účely tohoto sdělení je nejdůležitější složka epiteliální. Obsahuje bazální epiteliální buňky tvořící bazální membránu. Bazální epiteliální buňky charakterizuje velmi nízká přítomnost androgenních receptorů (AR) [4]. Mezi těmito buňkami se nacházejí v relativně malém počtu buňky kmenové, jež mají pluripotentní potenciál a jsou málo diferencované, bez AR. Z těchto buněk se postupně vyvíjejí vysoce diferencované glandulární buňky sekretorické, které vytvářejí acinární lumina, do nichž produkují prostatický specifický antigen (PSA), prostatickou kyselou fosfatázu (PAP) a prostaglandiny. Acinární vyzrálé buňky mají vysoký mitotický index a vysokou hladinu androgenních receptorů. Přes nízkou proliferaci je jejich sekretorická činnost i životnost zásadně ovlivňována androgeny [6]. Z buněk kmenových se v malém množství diferencují dále buňky neuroendokrinní typické sekrecí neuropeptidů (např. chromograninu A). Touto parakrinní sekrecí jsou stimulovány k proliferaci okolní acinární buňky sekretorické (epiteliální). Neuroendokrinní buňky nemají androgenní receptory, jejich funkci tudíž hladina androgenů neovlivňuje.
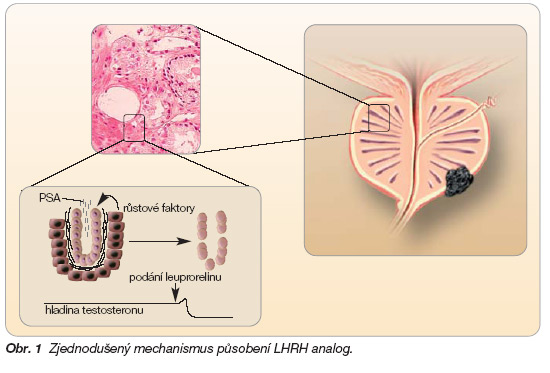
Stroma, oddělené od acinů tenkou bazální membránou, tvoří extracelulární matrix obsahující fibroblasty, buňky hladké svaloviny, endotelie a nervové buňky. Mezi tyto složky migrují např. lymfocyty, mastocyty aj. Skrze stroma proudí do složky epiteliální výživa, androgeny, ale také řada rozpustných růstových faktorů (GF), jako IGF (inzulin-like GF), EGF (epiteliální GF), bFGF (bazický fibroblastový GF), kGF (keratinocytový GF) a další. Je prokázáno, že všechny tyto faktory ovlivňují jak parakrinní stimulaci, tak inhibici růstu epiteliálních buněk (obr. 1).
Intracelulární patologické pochody probíhající v populaci vyzrávajících epiteliálních buněk charakterizují imunofenotypické i biologické odlišnosti. Na podkladě exprese keratinů (K) lze identifikovat různá stadia diferenciace epiteliálních buněk. Podle exprese podskupin keratinů (K5, K14, K18), dále exprese hepatocytárního růstového faktoru c-met a hladiny přítomných androgenních receptorů se ukazuje možnost stanovit v biopticky odebraném vzorku karcinomu prostaty pravděpodobnost odpovědi na hormonální léčbu. U vyzrávajících epiteliálních buněčných linií prostatických acinů, kde imunohistochemicky není vyjádřen K5 a c-met, a naopak je patrna exprese AR (AR+), lze očekávat farmakologickým potlačením hladiny testosteronu (chemickou kastrací) výrazný léčebný účinek [7].
I když výše popsaný velmi složitý mechanismus je zmíněn jen zjednodušeně, je prokázáno, že časná fáze diferenciace kmenových buněk v kmenové buňky nádorové je zásadně ovlivněna androgeny. Typizace a stanovení objemu těchto transformovaných kmenových buněk v bioptickém materiálu by umožnily rozpoznat ty nemocné s KP, kde lze androgenní ablací dosáhnout požadovaného dlouhodobého léčebného efektu.
Druhá generace LHRH agonistů
Depotní léková forma leuprorelinu byla vyvinuta ke zlepšení suprese testosteronu a snížení počtu nemocných s únikem z hormonální kontroly onemocnění. Leuprorelin acetát je syntetický nonapeptidový agonista přirozeně vznikajícího gonadoliberinu (GnRH), který inhibuje hypofyzární sekreci gonadotropinu a potlačuje tvorbu steroidů ve varlatech u mužů. Tento účinek je po přerušení lékové terapie reverzibilní. Agonista je účinnější než přirozený hormon.
Původní depotní forma leuprorelinu se skládala z lyofilizovaných mikročástic v transportním systému. Nová depotní forma leuprorelinu je tvořena jednotlivými částicemi leuprorelinu. Transportním systémem (Atrigel) je biodegradabilní polymer D,L-laktid-koglykolid rozpuštěný v N-methyl-2-pyrolidonu. Po smíchání leuprorelinu a nosiče je léčivý přípravek aplikován subkutánně. V místě aplikace dojde k vytvoření biodegradabilního viskózního polymeru s léčivem, který se postupně odbourává a vstřebává, a tím se léčivo postupně uvolňuje do systémového oběhu. Po přechodném zvýšení hladin LH a FSH dochází k jejich snížení a hladina testosteronu se snižuje na kastrační úroveň. Dlouhodobé studie ukázaly, že pokračování terapie udržuje hladinu testosteronu pod kastračním prahem po dobu až sedmi let a pravděpodobně ještě déle.
V ČR je v této nové lékové formě k dispozici přípravek Eligard 7,5 mg jako jednoměsíční depotní forma, Eligard 22,5 mg jako tříměsíční depotní forma. Nově byl na kongresu Evropské urologické asociace v Berlíně představen přípravek určený k šestiměsíční aplikaci. Escape fenomén (zvýšení hladiny testosteronu během léčby nad hranici 50 ng/dl) se pohyboval v průběhu léčby kolem 1 %, a to i u šestiměsíční formy [1]. Zvýšení hladin testosteronu po první aplikaci je přechodné a odeznívá během prvních 2 týdnů (graf 1, 2). Výhodou šestiměsíční formy přípravku je snížení počtu návštěv ve zdravotnických zařízeních, větší volnost nemocných a velmi podstatné je sporadičtější připomínání vlastního zhoubného onemocnění pacientovi, a tím snížení jeho obav z relapsu onemocnění. Léčba všemi dávkami vede k dosažení optimální kontroly hladiny testosteronu.
Závěr
Efekt léčby prvními lékovými formami LHRH analog nebyl srovnatelný s efektem chirurgické kastrace, především ve schopnosti potlačit a dlouhodobě udržet nízké hladiny testosteronu. Alternativní možností s dosažením optimálního stavu hormonálního prostředí je podávání nové generace depotního leuprorelinu, který ve všech dávkách dosahuje hladin testosteronu nižších než 0,7 mmol/l. Při nežádoucích účincích léčby srovnatelných s minulou generací LHRH analog je aplikace nové depotní lékové formy leuprorelinu spojena s vyšší onkologickou bezpečností léčby. Nová šestiměsíční forma pak přináší větší komfort pro pacienta.
Seznam použité literatury
- [1] Crawford ED, Sartor O, Chu F, et al. A 12-month clinical study of LA-2585 (45.0 mg): a new 6-month subcutaneous delivery systém for leuprolideacetate for the treatment of prostate cancer. J Urol 2006; 175: 533–536.
- [2] Denmeade SR, Lin XS, Isaac JT. Role of programmed (apoptic) cell death during the progression and therapy for prostate cancer. Prostate 1996; 28: 251–265.
- [3] Heidenreich A. EAU guidelines update, March 2007, Eur Urol, (in press).
- [4] Isaacs JT. The biology of hormone refractory prostate cancer. Why does it develop? Urol Clin North Am 1999; 26: 263–273.
- [5] Morote J, Planas J, Raventos CX, et al. The serum testosterone castration level with clinical relevance. Eur Urol 2007; 6 (Suppl 2): str. 29, abstrakt č. 25.
- [6] Perez-Marreno R, Chu FM, Gleason D, et al. A six-month open-label study assessing a new formulation of leuprolide 7.5 mg for suppression of testosterone in patiens with prostate cancer. Clin Ther 2002; 24: 1902–1914.
- [7] Schalke J. Androgen Receptor Mediated Growth of Prostate (Cancer). Eur Urol 2005; 47 (Suppl 4): 4–11.
- [8] Tombal B, Jasienski S, Debie B, et al. Is there a significant difference in testosterone level after surgical castration, goserelin or triptorelin? Eur Urol 2007; 51: str. 29, abstrakt č. 260.
- [9] Vogelzang NJ, Chodak GW, Soloway MS, et al. Goserelin versus orchiectomy in the treatment of advanced prostate cancer: final results of a randomized trial. Zoladex Prostate Study Group. Urology 1995; 46: 220–226.