Lipidový komplex amfotericinu B – jeho role mezi ostatními antimykotiky v léčbě invazivní kandidózy. Analýza klinických studií
Invazivní kandidóza a kandidémie patří mezi nejčastěji se vyskytující systémové fungální infekce. Zatímco mortalita v posledních desetiletích klesá, incidence zůstává prakticky neovlivněna. Změna spektra původců kandidových infekcí (u kandidózy převažují v současnosti infekce kmeny non-albicans, u kandidémie jsou to stále infekce kmeny Candida albicans), klade vyšší nároky na cílenou diagnostiku, přesné určení agens a citlivosti na antimykotika in vitro. Při volbě antimykotické terapie je vedle citlivosti vhodné vzít v úvahu i vlastnosti jednotlivých kandid, klinický stav pacienta či farmakokinetické vlastnosti jednotlivých léčiv. Výsledky studie CLEAR potvrzují dobrou účinnost i toleranci lipidového komplexu amfotericinu B (ABLC) srovnatelnou s ostatními preparáty, pro přesnější zhodnocení koloidní disperze amfotericinu B (ABCD) chybí kvalitní dostatečně početná studie. Jak ze studie CLEAR, tak z Walshovy studie vyplývá, že hlavní indikací ABLC je 2. linie léčby invazivní kandidové infekce po selhání, intoleranci nebo z důvodů toxicity předchozí léčby antimykotiky 1. řady.
Epidemiologie invazivní kandidózy a kandidémie
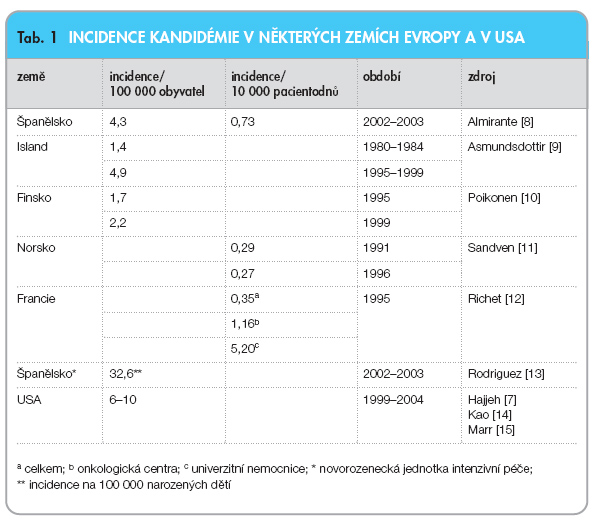
Invazivní kandidóza a kandidémie jsou nejčastějším klinickým projevem systémové fungální infekce, která je také spojena s nejvyšší mortalitou. Kandida postihuje nejen nemocné v hematoonkologických a transplantačních centrech, ale je nejčastějším mykotickým patogenem i na jednotkách intenzivní péče [1]. Vzestupný trend incidence kandidémie pozorovaný od 80. let [2, 3] se koncem 90. let zastavil; v souvislosti se širokým zavedením flukonazolu do klinické praxe dokonce došlo v některých centrech jak k poklesu výskytu kandidémie [4], tak i k poklesu mortality [5]. Přesto zůstává celková incidence vysoká a zásadně neovlivněna [6, 7]. V různých evropských státech je celková incidence kandidémie obdobná (tab. 1).
Orientaci při srovnání však ztěžuje různý způsob uvádění epidemiologických dat – v některých centrech je incidence uváděna na 100 000 obyvatel, v jiných centrech na 10 000 pacientodnů.
Mortalita u invazivních kandidóz a kandidémií se pohybuje kolem 40 %, dříve dosahovala až 60 % [8, 16, 17], na jednotkách intenzivní péče dosahuje v současné době až 47 % [1].
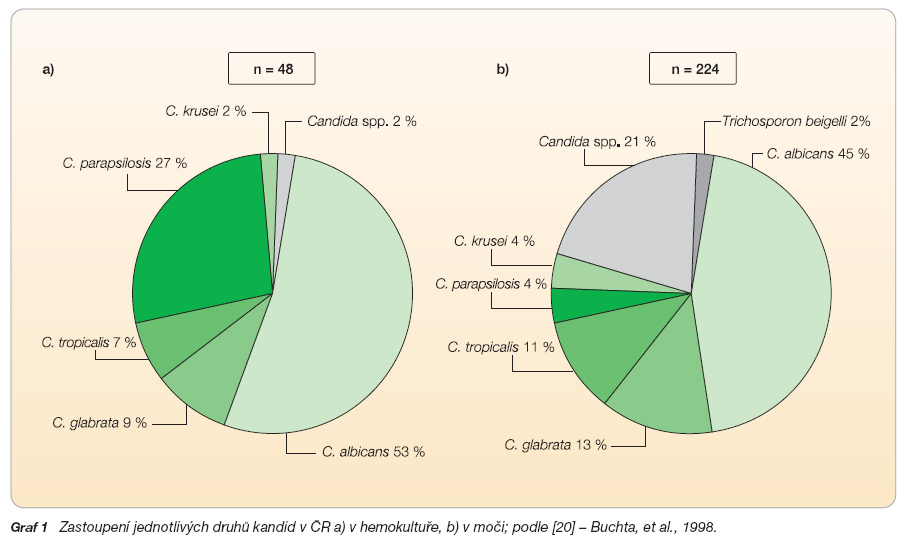
V posledních dvou desetiletích se postupně mění zastoupení jednotlivých druhů kandid izolovaných z hemokultur. Ve vyšším procentu se objevují kmeny non-albicans. V 60. a 70. letech 20. století převažovala Candida albicans (85–90 % všech případů kandidémie), v 90. letech v některých centrech USA (MD Anderson Cancer Center) poklesl záchyt na 42 %, zatímco v ostatních případech byly izolovány kandidy non-albicans. Šlo především o druhy C. tropicalis (18 %), C. parapsilosis (17 %), C. glabrata (11 %), C. krusei (4 %) a další. Jiná centra uvádějí záchyt C. albicans ve 45 %, C. glabrata ve 24 %, C. parapsilosis ve 13 % a C. tropicalis ve 12 % případů. Ve Švýcarsku dokumentuje situaci Marchetti [18]. Ve výsledku studie ze 17 univerzitních nemocnic, které reprezentují 79 % všech hospitalizačních lůžek, uvádí záchyt C. albicans v 66 %, C. glabrata v 15 %, C. tropicalis v 9 % a zjišťuje pokles incidence C. parapsilosis na 1 % a C. krusei na 2 %. Martin [19] ve francouzském Lyonu analyzoval kultivační nálezy 5 laboratoří a u 190 pozitivních záchytů byla nejčastějším nálezem C. albicans (49,5 %), následovaná C. glabrata (12,6 %) a C. parapsilosis (12,1 %). Pemán [17] ve Španělsku uvádí nálezy 290 vzorků z 19 nemocnic z let 1997–1999 u dospělých (n = 210) a dětí (n = 80) s výskytem C. albicans 46,2 % (děti 36,2 %), C. parapsilosis 21,9 % (50 %), C. tropicalis 12,8 % (3,75 %) a C. glabrata 10,1 % (5 %). Na dětské JIP (jednotka intenzivní péče) [13] převládá C. parapsilosis (67 %). V České republice zmapovali výskyt jednotlivých kmenů kandid Buchta (graf 1) [20] a Hamal [21]. Ten analyzoval 476 kandidémií s nejčastějším zastoupením C. albicans (46,8 %), C. parapsilosis (19,7 %), C. tropicalis (15,8 %), C. glabrata (5,5 %) a C. krusei (4,8 %).
Z velkých epidemiologických přehledů [8] tak vyplývá, že C. albicans je stále nejčastějším agens kandidémie [22], z kandid non-albicans jsou nejčastěji v hemokultuře v USA zachyceny kmeny C. glabrata [4], v Evropě a Kanadě C. parapsilosis a C. tropicalis [18, 23].
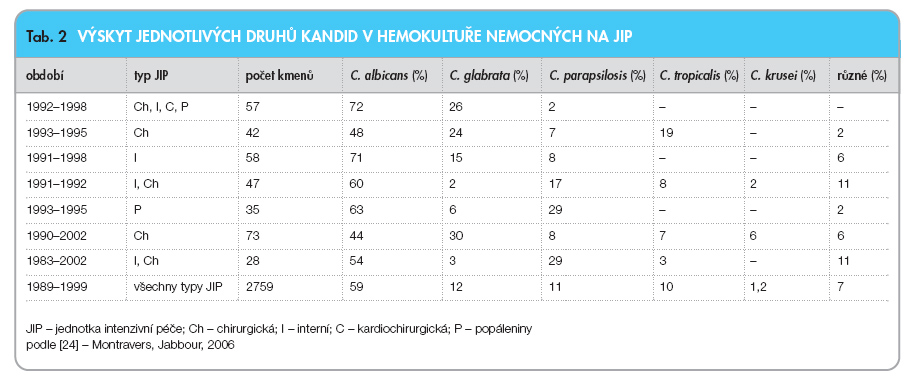
Data několika epidemiologických sledování ukazující výskyt jednotlivých druhů kandid izolovaných od nemocných na jednotkách intenzivní péče v období posledních dvou desetiletí zpracoval Montravers [24], údaje shrnuje tab. 2.
Skutečnost, že dochází postupně ke změně spektra původců kandidových infekcí, klade vyšší nároky na cílenou diagnostiku, přesné určení agens a citlivosti na antimykotika in vitro. Při volbě antimykotické terapie je vedle citlivosti vhodné vzít v úvahu i vlastnosti jednotlivých kandid. Nejčastější C. albicans je známá svou virulencí, ale současně dobrou citlivostí prakticky vůči všem antimykotikům. C. tropicalis způsobuje často invazivní infekci, je méně citlivá vůči flukonazolu a někdy i vůči amfotericinu B, takže léčba vyžaduje vyšší dávkování. C. parapsilosis je naopak méně virulentní, C. krusei je primárně rezistentní vůči flukonazolu, C. glabrata je nejčastějším agens u hematoonkologických pacientů [19, 25] a vykazuje na flukonazol získanou rezistenci od 0 % do 90 % a i zkříženou rezistenci vůči ostatním triazolům [26].
Vzhledem k možnosti infekce nejen jedním druhem kandidy [27] je nutné při volbě antimykotika zohlednit také aktuální epidemiologický stav a výskyt rezistence na příslušném pracovišti (oddělení). Důležité je zhodnocení celkového stavu nemocného (MASCC skóre) [28] a stav orgánů, a to vždy ve vztahu k farmakologickým vlastnostem použitého antimykotika [24].
Vzestup incidence kandidózy na JIP [29] spojený s vysokou mortalitou na jednotkách intenzivní péče vedl ke snahám rozpoznat kritéria a rizikové faktory [30, 31], které by umožnily včasný léčebný zákrok a současně by vyloučily paušální podávání antimykotik, která v neindikovaných případech mohou nemocného poškozovat [32, 33].
Mechanismus účinku lipidového komplexu amfotericinu B (ABLC) při infekci kandidami
Podrobné farmakologické údaje o lipidovém komplexu amfotericinu B byly publikovány dříve [34], stojí však za to připomenout, jakým způsobem amfotericin B vázaný v lipidovém komplexu působí proti invazivní kandidové infekci.
Mechanismus invaze kandid
Kandidy jsou jednobuněčné houbové mikroorganismy, které jako přirozený komenzál osídlují sliznici gastrointestinálního a urogenitálního traktu. Označují se jako dimorfní mikromycety, neboť mají schopnost vytvářet za určitých podmínek vláknitou formu a také formu pseudomycelia (pseudohyfy), což jsou sériově uspořádané protahující se spóry výrazně připomínající pravá mycelia [35]. U imunologicky oslabeného jedince se stávají potenciálním patogenem a za příznivých podmínek, kdy se vedle oslabení obranných schopností hostitele uplatňují i faktory virulence mikromycety, může dojít ke vzniku klinicky manifestní infekce. Mezi faktory virulence C. albicans patří schopnost adheze na povrchy (např. sliznice, katétry, umělé chlopně) [36–38] a změny fenotypu (switch phenotype) spojené se změnou morfologie v pseudohyfální, morfologicky odolnější a invazivnější formu (= morfogeneze) [39–41]. Tento proces je i základem tvorby tzv. kvasinkového biofilmu. Jako biofilm označujeme organizovaná společenstva mikroorganismů ve vlastní extracelulární matrix, pevně lnoucí k povrchům [42, 43]. Biofilm chrání mikromycety nejen proti pokusům hostitele o jejich likvidaci, ale zároveň omezuje průnik některých antimykotik k jednotlivým buňkám této organizované struktury [44]. Mezi další významné faktory virulence patří schopnost produkce invazivních enzymů, jednak proteináz [45, 46] a jednak fosfolipáz [47–50], které se uplatňují nejen v procesu adheze, ale jsou zásadní zejména pro penetraci do tkáně [51]. Jedním z dalších mechanismů kandidové invaze je tvorba proteinů tepelného šoku (hsp, heat shock proteins). Hsp jsou imunogenní mannoproteiny a jsou fyziologicky součástí imunitní odpovědi všech živých organismů [52]. Jsou produkovány jako reakce na změny teploty a stresové podmínky vyplývající z nepříznivého prostředí, brání buňku proti degradačním procesům provázejícím stres. Při invazivní infekci produkuje C. albicans hsp90 jako ochranu proti obranným mechanismům hostitele, přítomny jsou jednak v cytosolu buňky, ale také extracelulárně jako součást buněčné stěny [48]. Protilátky proti hsp90 jsou schopny ochránit organismus před invazivní kandidovou infekcí [53] a této skutečnosti se v současné době využívá v terapii [54]. Jako antigeny se dají detekovat [55, 56], a využít tak v diagnostice kandidové infekce.
Mechanismus dosažení vysokých tkáňových koncentrací ABLC, působení ABLC v místě infekce kandidami
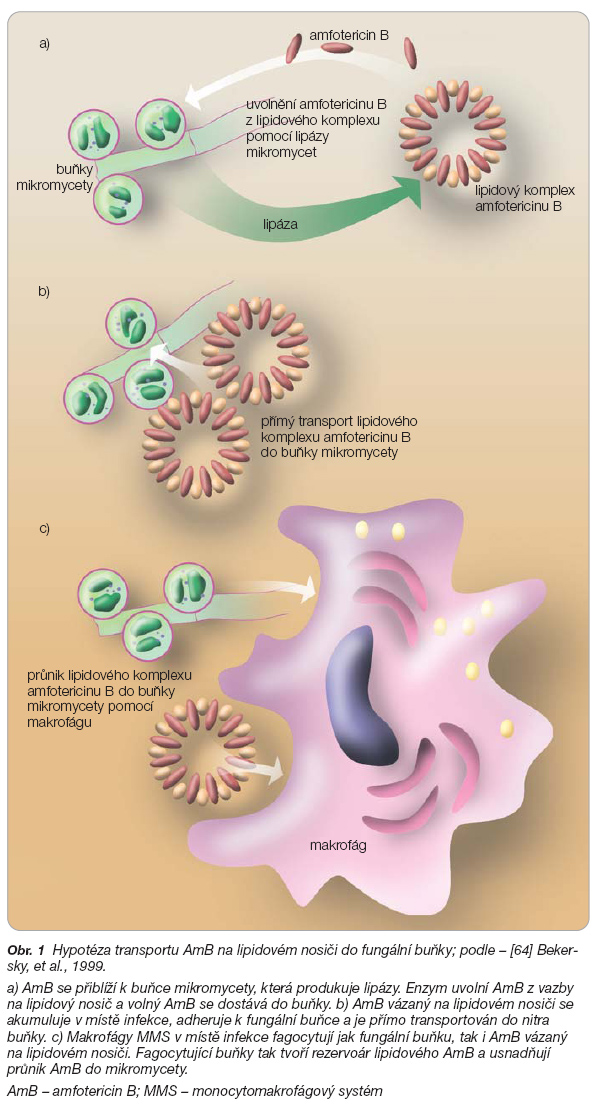
Velká molekula pentlicového tvaru (až 6000 nm, molekulová hmotnost 924 kD) fosfolipidového komplexu amfotericinu B (ABLC) je vychytávána monocytomakrofágovým systémem (MMS) – cirkulujícími makrofágy, které chemotakticky míří do místa infekce, a buňkami MMS ve slezině, v játrech a plicích [57]. V plicních alveolárních makrofázích (PAM) i v plicní tkáni dosahuje ABLC nejvyšších koncentrací ze všech forem amfotericinů [58], koncentrace je 70–375krát vyšší než koncentrace v plazmě [59]. V plicní tkáni je ABLC vychytán jednak dominantně v PAM, jednak se zachycuje mechanicky v husté kapilární síti plic, kde dlouhodobě přetrvává. Pro to svědčí skutečnost, ověřená experimentálně, že za 1 hodinu po podání zůstává v plicní tkáni 12 % podané dávky ABLC, na rozdíl od konvenčního amfotericinu B (c-AmB) a lipozomálního AmB, ze kterých je v plicích po hodině zachyceno pouze 1 % a 2 % podané dávky [58]. Z plicních kapilár se do plicní tkáně dostává ABLC fagocytován PAM. Přestup ABLC z kapilár do tkáně umožní i poškození endotelií v místě infekčního zánětu, a tak selektivně proniká do místa fungální infekce [60, 61]. Podmínkou selektivního vychytávání ABLC je jeho intaktní molekula. Experimentálně bylo prokázáno, že v plazmě se uvolní z molekuly ABLC jen zcela nevýznamné množství volného AmB a dominantní část až v infikované tkáni [61, 62]. K antifungální aktivitě je potřeba uvolnit AmB z vazby na fosfolipidový nosič. Amfotericin B je z této vazby v tkáni uvolňován fosfolipázami makrofágů, současně však „sebevražedně" fosfolipázami mikroskopických hub [61]. Fosfolipázy jsou produkovány také aktivovanými vaskulárními endoteliemi a hladkou svalovinou cév v místě lokálního zánětu a při systémovém zánětu jako součást obranné zánětlivé reakce hostitele na infekci. Kandidy tak stimulují sekreci extracelulární endoteliální fosfolipázy A2 při interakci s endoteliemi v místě invaze do cév [60]. Extracelulární sekrece fosfolipázy vaskulárními endoteliemi je kvantitativně nejvýznamnějším zdrojem fosfolipázy [63]. Z uvedeného vyplývá, že vícečetná produkce lipáz, nutná k uvolnění AmB z lipidového nosiče ABLC, zajišťuje účinnost ABLC i v případě mutant C. albicans, které ztratily schopnost extracelulární produkce fosfolipázy. V takovém případě může dojít k diskrepanci laboratorně stanovené citlivosti in vitro s průkazem aktivity in vivo [61]. Hypotézy možných mechanismů transportu AmB na lipidovém nosiči (ABLC) do fungální buňky uvádí také Bekersky (obr. 1) [64].
Výsledkem těchto procesů je vysoká koncentrace volného AmB v cílové infikované tkáni, do které se postupně uvolňuje ze svého nosiče [65]. Až následně se jen relativně nízká koncentrace volného AmB dostává do krevního oběhu, a tudíž i do ledvin, s výslednou „pouze" 20% nefrotoxicitou [66] ve srovnání s konvenčním AmB. Další významnou vlastností ABLC je schopnost penetrace a účinku na kvasinky organizované v biofilmu [67].
Možnosti léčby invazivní kandidózy a kandidémie a role ABLC
Cílem sdělení je vymezení role lipidového komplexu amfotericinu B (ABLC) v léčbě invazivní kandidózy a kandidémie. V roce 2005 byla vytvořena databáze CLEAR (The Collaborative Exchange of Antifungal Research program), která shromáždila informace o nemocných léčených pro invazivní mykózy jedním preparátem – lipidovým komplexem AmB (ABLC). Je to dosud nejširší databáze, která shrnuje data z dosavadních studií a obsahuje demografické charakteristiky, laboratorní výsledky a výsledky léčby. V současném přehledu budou údaje této databáze základem srovnání výsledků léčby invazivní kandidózy a kandidémie mezi ABLC a dalšími antimykotiky.
Účinnost ABLC u invazivní kandidózy a kandidémie v rámci databáze CLEAR [50] byla hodnocena celkem u 979 nemocných s kandidózou. Analyzováni byli nemocní s infekcí jedním druhem kandidy (C. albicans nebo C. non-albicans), dvěma druhy kandid (C. albicans + C. non-albicans) a nemocní s vícečetnou infekcí několika druhy kandid. Soubor nemocných byl dále analyzován podle základního onemocnění, kdy jednu skupinu tvořili více rizikoví pacienti (transplantace kostní dřeně, transplantace orgánů, hematologické malignity, solidní nádory, AIDS, diabetes mellitus) a druhou skupinu nemocní s nižším rizikem vzniku invazivní kandidózy (kardiovaskulární a plicní choroby, onemocnění trávicího traktu, ledvin, léčení kortikosteroidy a další). Soubor obsahuje nemocné jak s invazivní kandidózou (orgánové postižení a kandidémie), tak i s neinvazivní formou kandidózy (infekce urogenitálního traktu, sliznic orofaryngu, jícnu a distálních částí GIT, paranazálních dutin, kůže atd.). Zvlášť byly hodnoceny i skupiny nemocných podle důvodů zahájení léčby ABLC, podle počtu neutrofilů a podle předchozí či konkomitantní léčby jinými antimykotiky. Dávkování ABLC bylo ve všech skupinách o málo nižší (4,2–4,4 mg/kg/den) než doporučovaných 5 mg/kg/den.
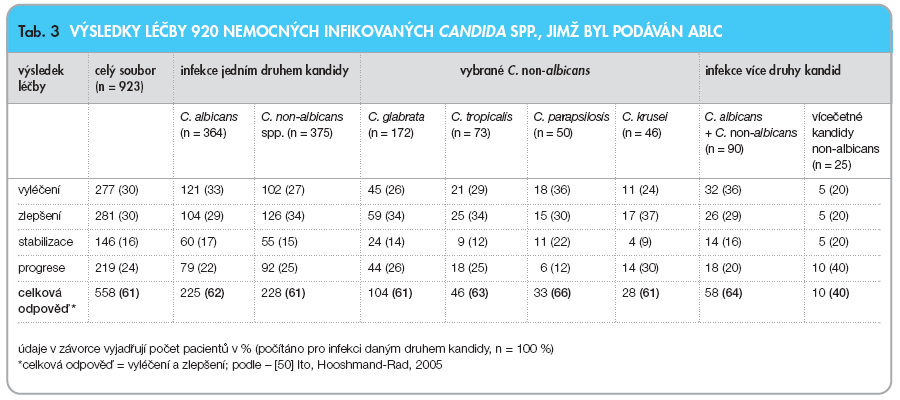
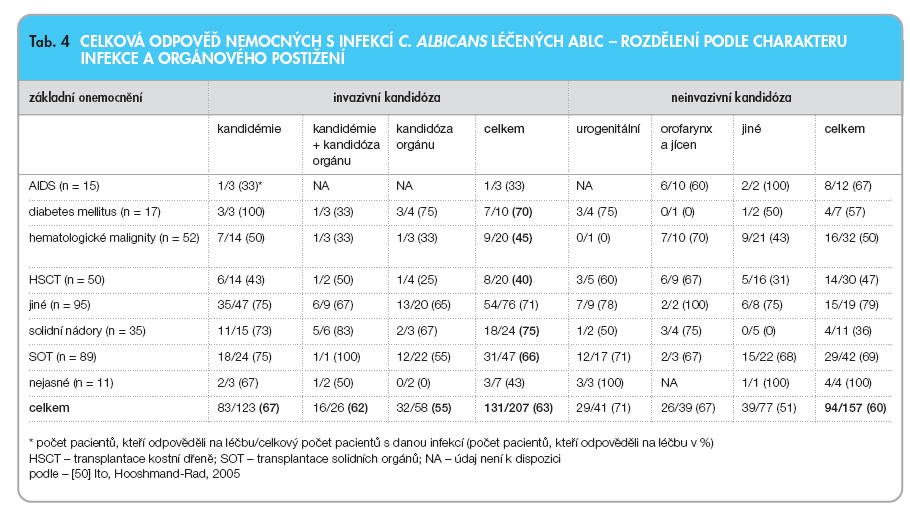
V tab. 3 jsou uvedeny celkové výsledky léčby, v tab. 4 výsledky u nemocných s izolovanou infekcí C. albicans, tab. 5 zaznamenává výsledky léčby nemocných s infekcí kandidami non-albicans, údaje jsou rozděleny podle charakteru a lokalizace infekce.
Nemocní s infekcí jednou kandidou non-albicans dosáhli celkově (vyléčení + zlepšení) stejných výsledků jako ti, u kterých byla prokázána pouze C. albicans (61 % a 62 %), u ostatních pacientů s infekcí kandidami non-albicans se úspěšnost léčby pohybovala v rozmezí 61–66 %. U vzácnějších druhů kandid non-albicans byly celkové výsledky léčby horší: v případě infekce C. lusitaniae představovala úspěšnost léčby 56 % (5/9), v případě infekce C. guilliermondii byla zaznamenána 33% úspěšnost léčby (2/6). U vícečetných infekcí kandidami non-albicans byla klinická odpověď nejnižší (40 %). Nemocní, u nichž byla zjištěna kombinovaná infekce C. albicans plus C. non-albicans, vykazovali celkovou odpověď 64 %. V případě nejčastější vícečetné infekce kandidami – C. albicans plus C. glabrata (n = 48) – bylo dosaženo celkové léčebné odpovědi u 71 % nemocných.
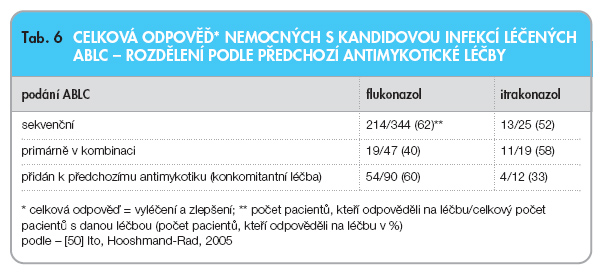
Při srovnání celkové odpovědi nemocných, kterým byl ABLC podán jako léčba 1. linie (preexistující poškození ledvin) nebo jako 2. linie (selhání nebo intolerance předchozí léčby), nebyly zjištěny zásadní rozdíly. Zajímavé je srovnání výsledků léčby nemocných, kterým byl ABLC podán buď po předchozí léčbě jiným antimykotikem (sekvenční podání) nebo byla léčba ABLC zahájena v kombinaci s jiným preparátem nebo byl ABLC přidán k antimykotiku, jehož podáváním byla léčba již dříve zahájena (konkomitantní léčba), viz tab. 6.
Celkem tak bylo zhodnoceno 851 nemocných s kandidózou, z nichž 240 bylo léčeno kombinací antimykotik (buď konkomitantně nebo primárně v kombinaci). Nejčastěji byl ABLC kombinován s flukonazolem (16 %; 137/851). Flukonazol byl podán jako 1. linie léčby invazivní mykózy u 62 % ze všech nemocných, kteří flukonazol dostávali (85/137). Následně pokračovalo v léčbě flukonazolem současně s přidáním ABLC celkem 90 nemocných a u 60 % nemocných této skupiny bylo dosaženo klinické odpovědi. Celkem 344 nemocných dostalo ABLC sekvenčně po flukonazolu s dosažením 62% klinické odpovědi. Ze 47 nemocných, kteří zahájili léčbu v kombinaci s ABLC, jich dosáhlo klinické odpovědi 40 %. Nejnižšího efektu léčby bylo dosaženo současnou léčbou itrakonazolem a ABLC, pouze 33 %.
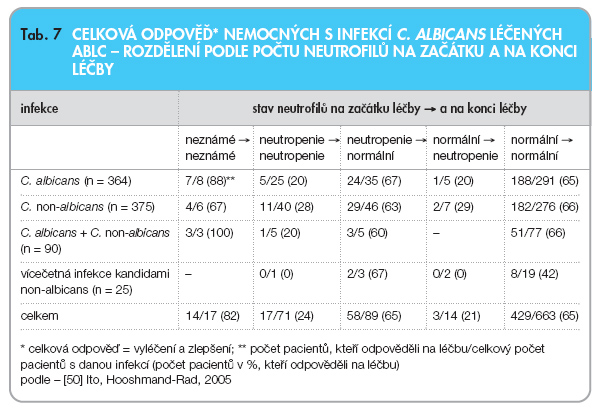
Posledním hodnotícím kritériem sledovaného souboru byla hodnota granulocytů. Celkem 65 % nemocných mělo na začátku i na konci léčby ABLC hodnoty granulocytů > 0,5 x 109/l (tab. 7) a dosáhli celkově 65% klinické odpovědi. Nejhorších výsledků (24 %) bylo podle očekávání dosaženo u nemocných, kteří po celou dobu léčby byli neutropeničtí a ani ke konci léčby nedošlo k úpravě počtu neutrofilů. Pokud se ke konci léčby počet neutrofilů upravil, pak se celkové výsledky nelišily od skupiny bez neutropenie (65 %). U nemocných s vícečetnou infekcí kandidami non-albicans byla úspěšnost léčby nižší, i přes normální počet neutrofilů na počátku i na konci léčby, celková klinická odpověď činila pouze 42 %.
Dílčí součástí studie CLEAR byla studie, kterou uskutečnil Walsh se spolupracovníky [68], hodnotící účinnost a toxicitu ABLC v souboru 556 nemocných s invazivní mykotickou infekcí. Zařazeni byli nemocní: 1. po selhání předchozí léčby (n = 292; 52,5 %; 48,5 % c-AmB, 4 % jiná antimykotika), 2. s projevy nefrotoxicity po předchozí léčbě c-AmB (n = 181; 32,6 %), 3. s výraznými projevy akutní toxicity po c-AmB (n = 30; 5 %) a 4. se snížením renálních funkcí již před zahájením antimykotické léčby (n = 50; 9 %), kteří dostali alespoň 4 dávky ABLC; ten byl podáván v obvyklé dávce 5 mg/kg/den po dobu nejméně 4 týdnů. Z celého souboru bylo 91 nemocných s invazivní kandidovou infekcí. Klinické odpovědi (úplná a částečná odpověď) bylo dosaženo u 67 % (28/42) nemocných s diseminovanou kandidózou, u 75 % (15/20) nemocných s kandidémií a u 78 % (22/29) nemocných s kandidózou jednoho orgánu. Tolerance léčby byla velmi dobrá, u 162 nemocných z celého souboru s abnormální vstupní hodnotou kreatininu došlo během léčby ABLC k signifikantnímu poklesu hladiny kreatininu (p ≤ 0,0003). Jak ze studie CLEAR, tak z Walshovy studie vyplývá, že hlavní indikací ABLC je 2. linie léčby po selhání, intoleranci nebo z důvodů toxicity předchozí léčby antimykotiky 1. linie.
Srovnání účinnosti ABLC v léčbě invazivní kandidózy a kandidémie s dalšími antimykotiky
Nabídka účinných látek pro léčbu invazivní kandidózy a kandidémie je širší než v případě invazivní aspergilózy. Patří mezi ně polyeny (amfotericin B, resp. lipidové formy), triazoly (flukonazol, itrakonazol, vorikonazol) a echinokandiny (kaspofungin, anidulafungin, micafungin).
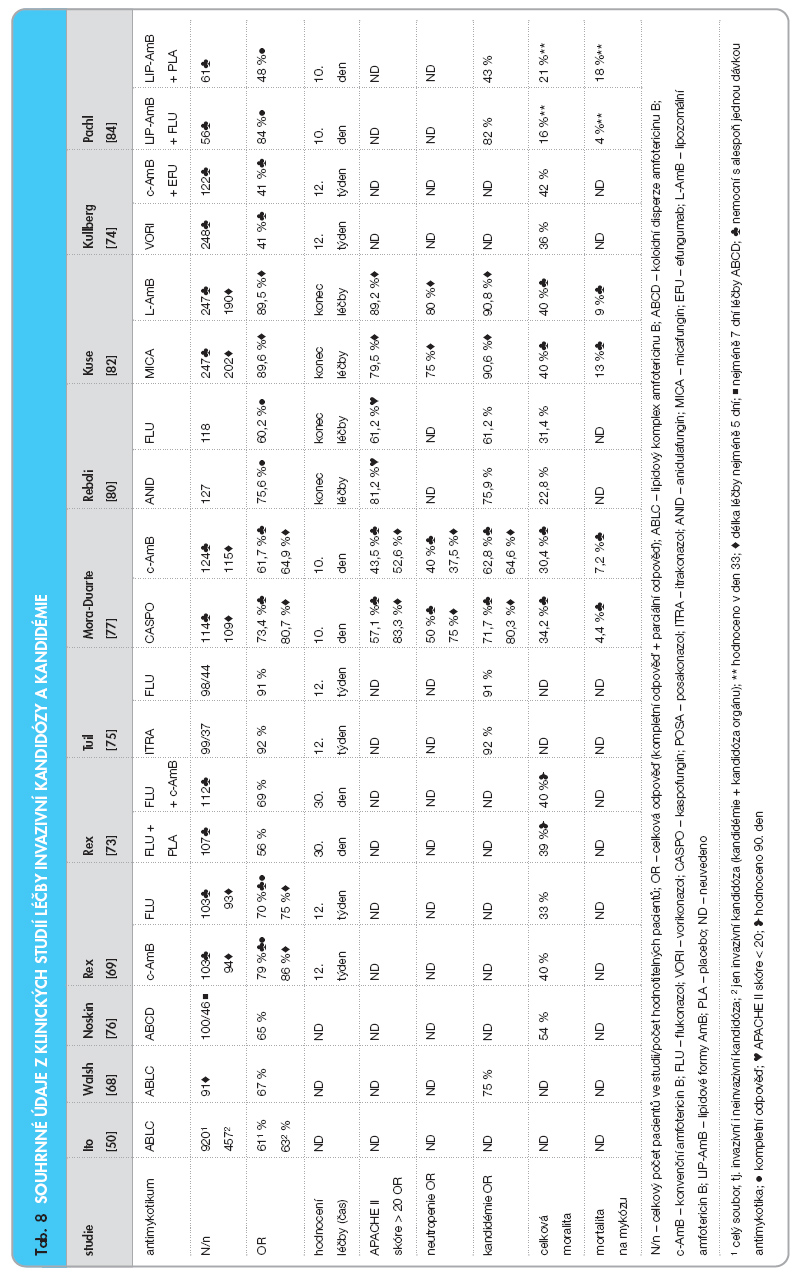
Rex [69] publikoval první srovnávací studii konvenčního amfotericinu B (c-AmB) (n = 103) vs. flukonazol (n = 103) v léčbě kandidémie u non-neutropenických nemocných. Dávky c-AmB byly 0,5–0,6 mg/kg/ den, prvních 7 dní byl c-AmB aplikován denně, poté bylo možné dávkovat ob den s udržením průměrné dávky 0,5–0,6 mg/ kg/den. Flukonazol byl podáván v dávce 400 mg/den, 7 dní nitrožilně, poté per os. Délka léčby byla nejméně 14 dní po klinické stabilizaci a vymizení původně pozitivního kultivačního nálezu. Hodnocení bylo prováděno 12. týden, měřítkem úspěšné léčby bylo úplné odeznění klinických známek infekce a negativita kultivačního nálezu, což de facto splňuje kritéria kompletní odpovědi. Soubor byl dále stratifikován podle rizikových faktorů, zejména podle APACHE II skóre, ale i dalších. Výsledky léčby (tab. 8) nebyly statisticky rozdílné (c-AmB vs. flukonazol, 79 %; 81/103 vs. 70 %; 72/103; p = 0,22). Rozdílný nebyl ani počet selhání (přetrvávající pozitivní hemokultura) – 11,6 % (12/103) vs. 14,5 % (15/103) nemocných, ani počet úmrtí (40 %; 41/103 vs. 33 %; 34/103). Jediný rozdíl byl v menší toxicitě flukonazolu (37 % vs. 2 %).
Metaanalýza šesti prospektivních studií z let 1996–1999 srovnávající konvenční amfotericin B a flukonazol [70] u celkem 826 epizod kandidémie prokazuje stejnou účinnost obou preparátů s výrazně nižší toxicitou flukonazolu.
Na základě dosavadních zkušeností s flukonazolem a c-AmB byly formulovány doporučené postupy léčby kandidémie u nemocných bez neutropenie [71]. U klinicky stabilizovaných nemocných [72] (normální TK, klinicky trend ke zlepšení, bez komplikujících komorbidit) je při infekci C. albicans lékem volby flukonazol, při neznámém agens a u nestabilních nemocných je preferován amfotericin B vzhledem k širšímu spektru účinku. Amfotericiny vázané na lipidový nosič (lipidový komplex amfotericinu B, lipozomální amfotericin B) jsou v tomto doporučení až 2. volbou a jsou indikovány jen v případě nesnášenlivosti konvenčního AmB, při renální insuficienci nebo při zhoršení renálních funkcí při léčbě c-AmB.
Randomizovaná, dvojitě slepá srovnávací studie [73], která hodnotí flukonazol (FLU) vs. konvenční amfotericin B (c-AmB), se zabývala jednak otázkou vyšších dávek flukonazolu (800 mg/den) a jednak efektem kombinace flukonazolu s amfotericinem B, který byl podáván v dávce 0,7 mg/kg/den. Do studie byli zařazeni nemocní s kandidémií bez neutropenie, byla vyloučena infekce C. krusei. Délka léčby byla nejméně 14 dní po zjištění poslední pozitivní hemokultury a po zlepšení klinického stavu pacienta. Amfotericin byl přidáván do kombinace s FLU po dobu prvních 5 dnů. V primární analýze byli zahrnuti nemocní (FLU + placebo: n = 107; FLU + c-AmB: n = 112), kteří dostali alespoň 1 den léčby (MITT– modified intent to treat analysis), hodnocena byla doba do selhání léčby, tedy časové rozpětí, během něhož nebylo nutno podat jinou antimykotickou léčbu, nebo časové rozpětí do doby úmrtí či přerušení léčby z důvodu toxicity nebo nesnášenlivosti. V sekundární analýze byla hodnocena celková úspěšnost léčby. Z hlediska doby do selhání léčby nebyl mezi oběma skupinami rozdíl, monoterapie flukonazolem však byla méně úspěšná (56 %; 60/107) než kombinace s c-AmB (69 %; 77/112; p = 0,043), viz tab. 8. Při eradikaci infekce (negativní hemokultura) flukonazol selhal v 17 %, v kombinaci s c-AmB však jen v 6 %. V závěru studie autoři uvádějí, že nezjistili antagonismus kombinace flukonazol plus amfotericin B, naopak byla tato kombinace úspěšnější jak v klinickém hodnocení léčby, tak i ve vyšším procentu odpovědi na léčbu a v dřívější eradikaci infekce.
Proti konvenčnímu léčebnému postupu c-AmB + flukonazol (c-AmB/FLU) byl v primární léčbě kandidémie u non-neutropenických pacientů srovnáván první triazol 2. generace vorikonazol (VORI) [74]. V prospektivní randomizované otevřené studii byl VORI (n = 248) podáván v dávce 6 mg/kg i.v. po 12 hodinách 1. den, poté 3 mg/kg 2krát denně. Dávkování režimu c-AmB/FLU (n = 122) bylo následující: c-AmB 0,7–1,0 mg/kg/den 3–7 dní + následně FLU per os 400 mg/den. Hodnoceni byli nemocní s alespoň jednou dávkou antimykotika. Délka léčby byla alespoň 2 týdny po zjištění poslední pozitivní hemokultury, maximálně 8 týdnů, nemocní byli sledováni celkem 12 týdnů a v této době bylo prováděno hodnocení studie. V primární analýze bylo dosaženo stejného léčebného efektu v obou skupinách, rozdíly nebyly statisticky signifikantní. Léčebná odpověď (klinická a laboratorní kompletní a parciální odpověď) po 12 týdnech byla ve skupině VORI dosažena u 41 % nemocných (101/248) a ve skupině c-AmB/FLU rovněž u 41 % nemocných (50/122), tj. vorikonazol prokázal non-inferioritu (tab. 8).
Po skončení léčby byl poměr výsledků také prakticky stejný, VORI vs. c-AmB/FLU 65,1 % (162/248) vs. 71,3 % (87/122) a celková mortalita 36 % (88/248) vs. 42 % (51/122). Oba léčebné postupy stejně rychle dosáhly i mykologické eradikace patogenu v hemokultuře. Výsledky svědčí pro stejnou účinnost VORI ve srovnání s konvenčním postupem. Vorikonazol tak rozšířil řadu léků 1. linie v léčbě invazivní kandidózy a kandidémie u nemocných bez neutropenie.
Srovnání flukonazolu a itrakonazolu v léčbě kandidémie u nemocných bez neutropenie prezentoval Tuil [75] na sympoziu intenzivistů. Itrakonazol (ITRA) byl podáván nejprve nitrožilně v dávce 200 mg 2krát denně první dva dny, dále 200 mg 1krát denně nejméně 5 dní, potom nemocní dostávali perorální soluci v dávce 200 mg 2krát denně. Flukonazol (FLU) byl zpočátku podáván také nitrožilně v dávce 400 mg po dobu 7 dní, potom byla stejná dávka podávána v perorální suspenzi. Délka léčby trvala ještě 14 dní po vymizení všech klinických i laboratorních příznaků infekce, hodnocení bylo provedeno 12. týden sledování. Výsledky hodnocení byly v obou skupinách stejné, celková odpověď ve skupině ITRA byla 92 % (34/37) a 91 % (40/44) ve skupině FLU (tab. 8).
Zkušenosti s koloidní disperzí amfotericinu B (ABCD) v léčbě invazivní mykózy jsou shrnuty v souboru s 220 nemocnými (data získána z pěti nekomparativních studií) po transplantaci kostní dřeně (167 allogenní, 53 autologní), z nichž 100 mělo kandidovou infekci [76]. ABCD byl podáván převážně ve 2. linii, po selhání předchozí léčby nebo při projevech intolerance nebo nefrotoxicity po předchozí léčbě c-AmB. Hodnoceni byli jen nemocní s prokázanou infekcí, kteří dostávali ABCD nejméně 7 dní a neměli žádná další antimykotika do kombinace. S invazivní kandidózou bylo proto hodnoceno jen 46 nemocných. Klinické odpovědi (kompletní + parciální) dosáhlo celkem 65 % (30/46) z nich, z toho 64 % (21/33) nemocných po allogenní transplantaci kostní dřeně a 69 % (9/13) po autologní transplantaci. Zemřelo 54 % (25/46) nemocných s kandidózou, autoři uvádějí vyšší procento úmrtí po allogenní transplantaci, ale bez bližšího rozdělení (tab. 8). Podobně jako při léčbě ABLC, ani v případě ABCD nedocházelo u preexistujícího renálního poškození ke vzestupu hladin kreatininu.
Významnou skupinou antimykotik jsou echinokandiny, které prokázaly velmi dobrý účinek při léčbě invazivní kandidózy. První z nich, kaspofungin, rozšířil spektrum léků 1. volby v roce 2002. Ve dvojitě slepé studii [77] invazivní kandidózy a kandidémie byl srovnáván kaspofungin (CASPO; n = 109) proti c-AmB (n = 115). Soubor nemocných byl stratifikován podle skóre APACHE II (APACHE II > 20 CASPO vs. AmB: 19,3 %; 21/109 vs. 20 %; 23/115), podle neutropenie (< 0,5 x 109/l CASPO vs. c-AmB: 12,8 %; 14/109 vs. 8,7 %;10/115), podle kandidémie (82,6 %; 90/109 vs. 79,1 %; 91/115) a dalších kritérií. Nejčastějším agens byla C. albicans – 35,6 % ve skupině CASPO a 54,1 % ve skupině c-AmB. Zastoupení dalších druhů kandid bylo podobné, C. parapsilosis 19,8 % vs. 18,3 %, C. tropicalis 19,8 % vs. 12,8 %, C. glabrata 12,8 % vs. 9,2 % a C. krusei 4,0 % vs. 0,9 %. Jen u pěti nemocných byla prokázána kombinovaná infekce kandidami. Kaspofungin byl dávkován standardně, 1. den 70 mg jako nasycovací dávka, další dny pak 50 mg denně. Amfotericin B byl podáván nemocným bez neutropenie v dávce 0,6–0,7 mg/kg/ den, neutropeničtí pacienti dostávali dávky v rozmezí 0,7–1,0 mg/kg/den. Léčba trvala ještě 14 dní po posledním pozitivním kultivačním nálezu kandidy. C-AmB byl podáván po celou dobu u neutropenických nemocných, pokud došlo k úpravě počtu leukocytů, byl po 10 dnech c-AmB nahrazen flukonazolem v dávce 400 mg/den. Hodnocení se provádělo 10. den nebo na konci infuzní léčby. V globálním hodnocení souboru s nemocnými s prokázanou infekcí a s alespoň jednou dávkou antimykotika dosáhl kaspofungin celkově podobných výsledků jako c-AmB (celková odpověď 73,4 % vs. 61,7 %). V globálním hodnocení nebyly zjištěny zásadní rozdíly ani v podskupinách podle APACHE II skóre > 20 (CASPO 57,1 %; 12/21 vs. c-AmB 43,5 %; 10/23) a podle neutropenie (CASPO vs. c-AmB 50 %; 7/14 vs. 40 %; 4/10), ani ve výsledcích léčby kandidémie (71,7 % vs. 62,8 %). Ve specifikované skupině (alespoň 5 dní léčby) byl kaspofungin statisticky významně lepší, dosáhl příznivé odpovědi u 80,7 % vs. 64,9 %, podobně v podskupině APACHE II skóre > 20 (83,3 %; 10/12 vs. 52,6 %; 10/19) i v podskupině neutropenie (75 %; 6/7 vs. 37,5 %; 3/8) i v podskupině kandidémie (80,3 % vs. 64,6 %), viz tab. 8. K selhání léčby ve specifikované skupině došlo v podskupině CASPO u 26,6 % (29/109) a v podskupině c-AmB u 38,3 % (44/115). Celková mortalita byla podobná v obou skupinách, ve skupině kaspofunginu zemřelo 34,2 % (n = 39) nemocných a ve skupině c-AmB 30,4 % (n = 38) nemocných. Stejně tak i úmrtí na kandidózu nebylo statisticky rozdílné – 4,4 % (4 nemocní) a 7,2 % (9 nemocných). Výsledky této studie zařadily kaspofungin jako další lék 1. volby pro invazivní kandidózu [78], i když odborná diskuse polemizuje s touto jednoznačnou pozicí kaspofunginu, neboť chybí srovnávací studie s flukonazolem, dalším lékem dosavadní 1. volby [79].
Vedle kaspofunginu je připraven ke klinickému použití nový echinokandin, anidulafungin. Registrace v ČR se předpokládá v roce 2008. Jeho účinnost byla ověřována v léčbě invazivní kandidózy ve dvojitě slepé, randomizované studii proti flukonazolu, ve které anidulafungin (ANID) prokázal lepší výsledky, dosáhl tak cíle studie – non-inferiority [80]. ANID byl podáván nemocným (n = 127) v dávce 200 mg i.v. první den, další dny v dávce 100 mg denně, FLU (n = 118) byl podáván první den nitrožilně v dávce 800 mg, další dny 400 mg denně, po 10 dnech bylo možné pokračovat s medikací perorálně. Délka léčby byla 14–42 dní, nejméně však 14 dní po odebrání poslední pozitivní hemokultury a po zlepšení klinického stavu pacienta. Soubor nemocných byl stratifikován podle APACHE II skóre, APACHE II ≤ 20 ANID 80 % (101/127) vs. FLU 83 % (98/118); APACHE II > 20: ANID 21 % (26/127) vs. FLU 17 % (20/118), podle absolutního počtu neutrofilů, neutrofily ≤≤ 0,5 x 109/l: ANID 3 % vs. FLU 4 %; neutrofily > 0,5 x 109/l: 98 % (124/127) vs. 97 % (114/118). Vylučovací kritéria pro zařazení do studie zahrnovala i nemocné, kteří dostávali 30 dní před zahájením studie profylakticky jakékoli azoly po dobu 7 dní, a dále nemocné s předchozí rezistentní kandidovou infekcí a s prokázanou infekcí C. krusei. Celková odpověď hodnocená na konci nitrožilní léčby byla dosažena u 75,6 % (96/127) léčených ANID a u 60,2 % ve skupině FLU (71/118; rozdíl: 15,4 %; p = 0,01), viz tab. 8. Při hodnocení na konci léčby byly výsledky obdobné, vyšší odpovědi dosáhla skupina ANID – 74 % (94/127) vs. 56,8 % (67/118), stejně tak 2 týdny po skončení léčby (64,6 % vs. 49,2 %) a 6 týdnů po skončení léčby (55,9 % vs. 44,1 %). V případě izolované kandidémie dosáhlo příznivé odpovědi 75,9 % (88/116) nemocných léčených ANID a 61,2 % (63/103) léčených FLU (p = 0,02). Ve skupině ANID zemřelo méně nemocných, celkem 22,8 % (29/127), než ve skupině léčené FLU, kde zemřelo 31,4 % (37/118) pacientů. Medián času do úmrtí byl 21 dní vs. 14 dní. Celkově jsou výsledky při podávání anidulafunginu obdobné jako ve studii srovnávající kaspofungin vs. amfotericin [77], výsledky dosažené léčbou flukonazolem jsou obdobné jako v Rexově studii [73].
Micafungin je zatím poslední z echinokandinů, jehož registraci v ČR očekáváme také v roce 2008. V nekomparativní studii [81] prokázal velmi dobrou účinnost u kandidémie jak v monoterapii, tak v kombinaci. Hodnoceno bylo celkem 126 nemocných (106 dospělých, 20 dětí, z toho 11 novorozenců), kteří byli léčeni nejméně 5 dní. Soubor byl dále rozdělen podle toho, zda byla léčba micafunginem podána v 1. linii (57,1 %) nebo byla přidána ke stávající antimykotické léčbě (42,9 %), dále podle neutropenie (23 %) a dalších rizikových faktorů včetně základního onemocnění. Micafungin (MICA) byl podáván jednou denně v jednohodinové nitrožilní infuzi po dobu nejdéle 6 týdnů. Dávka se lišila podle druhu kandidy a podle tělesné hmotnosti nemocných: při infekci C. albicans a hmotnosti vyšší než 40 kg byla podávána dávka 50 mg/den, při infekci kandidami non-albicans dávka 100 mg/den. Při hmotnosti nižší než 40 kg bylo stanoveno dávkování 1–2 mg/kg/den. Dávku bylo možné zvyšovat o 50 mg/den (1 mg/kg/den) u nemocných, kteří po 5 dnech léčby nedosáhli zlepšení. Celkový úspěch léčby (kompletní a částečná odpověď) byl zaznamenán u 83,3 % nemocných, s malými rozdíly podle vyvolávajícího agens: C. albicans 85,1 %, C. glabrata 93,8 %, C. parapsilosis 86,4 %, a C. tropicalis 83,3 %. Optimální výsledky (> 90 %) byly dosaženy v dávkovém rozmezí 75–150 mg/den. Lepší výsledky byly zaznamenány u dospělých (84,9 %; 90/106) než u dětí (75 %; 15/20).
Příznivé výsledky této studie potvrdila další dvojitě zaslepená srovnávací studie, ve které byl hodnocen micafungin vs. lipozomální amfotericin B (L-AmB; n = 190) [82] v primární léčbě kandidémie a invazivní kandidózy. MICA byl podáván v dávce 100 mg/den při tělesné hmotnosti pacienta vyšší než 40 kg a 2 mg/kg/den při nižší hmotnosti. L-AmB byl dávkován 3 mg/ kg/den. Dávku MICA bylo po 5 dnech možné zvýšit na 200 mg/den, L-AmB na 5 mg/kg/den, nebo snížit o 50 % při projevech nefrotoxicity. Medián aplikace MICA byl 15 dní (maximálně 42 dní), medián aplikace L-AmB byl 15 dní (max. 56 dní), medián denní dávky MICA byl 100 mg a L-AmB 3 mg, dávka MICA byla zvýšena u 11 % a dávka L-AmB u 9 % nemocných, pouze u 5 % bylo nutné dávku snížit. Z celého souboru s nejméně jednou dávkou léčby (MICA: n = 247, L-AmB: n = 247) byli do analýzy účinnosti zařazeni jen ti, kteří dosta-li nejméně 5 dávek léčby (MICA: n = 202; L-AmB: n = 190). Terapeutickou účinnost (úplná a částečná klinická odpověď + laboratorní eradikace patogenu) hodnotila nezávislá „zaslepená" komise na konci léčby, bez časového limitu, nemocní byli sledováni 12 týdnů. Celkový úspěch léčby se mezi oběma skupinami nelišil, MICA vs. L-AmB 89,6 % (181/202) vs. 89,5 % (170/190), a to ani v dosažení kompletní odpovědi (78,7 % vs. 77,9 %). Rozdíl nebyl ani v podskupinách podle neutropenie (< 0,5 x 109/l: 75 % vs. 80 %) nebo primární lokalizace infekce, podle agens (C. albicans vs. C. non-albicans), ani podle APACHE II skóre (APACHE II > 20: 79,5 % vs. 89,2 %) či v procentu selhání laboratorní eradikace. Ve skupině MICA celého souboru (n = 247) byl celkový počet úmrtí na konci léčebné fáze studie 18 % vs. 17 % ve skupině L-AmB (n = 247). Na konci 12týdenního sledování pak zemřelo 40 % pacientů v obou skupinách (tab. 8). MICA byl lépe tolerován s menším počtem nežádoucích účinků, léčbu přerušilo z důvodů intolerance nebo toxicity 4,9 % vs. 9,0 % nemocných. Micafungin tak dosáhl primárního cíle studie, průkazu non-inferiority.
Jako „třetí věk antimikrobiální léčby" je označována nová generace léčiv, imunopreparátů, které zahájily zcela nový přístup k léčbě kandidové infekce [83]. Jde o biologickou léčbu, která využívá humánní protilátku, resp. její část (neobsahuje Fc fragment = není imunogenní) vyrobenou genetickou rekombinantní technologií z E. coli. Protilátka je zaměřena specificky proti imunodominantnímu antigenu hsp90. Protilátka byla původně získána od nemocných s diseminovanou kandidózou, kteří se uzdravili a vytvářeli protilátky proti antigenu hsp90 [53–55].
Ve dvojitě slepé randomizované studii byla ověřována účinnost amfotericinu B vázaného na tukové vehikulum (LIP-AmB) buď lipozomálního AmB (L-AmB) nebo lipidového komplexu AmB (ABLC) s touto protilátkou, efungumabem (LIP-AmB + EFU; n = 68), proti monoterapii jedním z lipidových AmB plus placebo (LIP-AmB + PLA; n = 71) [84]. EFU byl podáván nitrožilně v dávce 1 mg/kg každých 12 hodin po dobu 5 dní, jedna skupina dostávala k této léčbě placebo, druhá buď ABLC v dávce 5 mg/kg/den nebo L-AmB v dávce 3 mg/kg/den po dobu nejméně 10 dní. Nemocní byli stratifikováni podle typu infekce (C. albicans vs. C. non-albicans), APACHE II skóre > 18 a dalších rizikových faktorů. Primárním cílem studie bylo zhodnocení celkové účinnosti (kompletní klinická a laboratorní odpověď) v den 10, tj. podle protokolu 5 dní po poslední dávce EFU a po minimálně desetidenní době léčby LIP-AmB. Sekundárním cílem bylo zhodnocení celkové odpovědi během celé doby léčby, tj. bez časového limitu hodnocení, a to jak z klinického hlediska, tak i z hlediska eradikace kultivačního nálezu. Součástí sekundární analýzy bylo i zjištění mortality na kandidózu 4 týdny po poslední dávce léčby, tj. v den 33. Na rozdíl od ostatních studií byla částečná odpověď zařazena jako „neúspěch". Analýza účinnosti léčby byla prováděna na modifikovaném souboru nemocných („efficacy population"; LIP-AmB + EFU; n = 56; LIP-AmB + PLA, n = 61), kteří měli kultivačně potvrzenou kandidovou infekci, dostali alespoň jednu dávku LIP-AmB a absolvovali kontrolu po skončení léčby. Do analýzy bezpečnosti léčby („safety population" LIP-AmB + EFU: n = 68; LIP-AmB + PLA n = 69) byli zařazeni všichni, kteří dostali alespoň jednu dávku léčby. Medián (10 dní) i průměrná doba (10,0 Î 4,4 vs. 10,5 Î 5,6 dní) léčby byly v obou skupinách obdobné. Kombinovaná léčba (LIP-AmB + EFU) dosáhla statisticky signifikantně lepších výsledků ve všech sledovaných parametrech než léčba v monoterapii (LIP-AmB + PLA), viz tab. 8. Kompletní celková (klinická + kultivační) odpověď 10. den byla 84 % (47/56) vs. 48 % (29/61), z toho kompletní klinická odpověď představovala 86 % (48/56) vs. 52 % (32/61) a kompletní laboratorní odpověď 89 % (50/56) vs. 54 % (33/61). Podobně i v podskupině kandidémie (n = 33 vs. 35) byly celkové výsledky hodnocené v den 10 statisticky významně lepší při podávání kombinace LIP-AmB + EFU (82 %; 27/33 vs. 43 %; 15/35), stejně jako klinická odpověď (82 %; 27/33 vs. 51 %; 18/35) i odpověď laboratorní (88 %; 29/33 vs. 51 %; 18/35). Mortalita na kandidózu 33. den studie byla 4 % (4/56) vs. 18 % (11/61), většina úmrtí nastala 12. den. Většina zemřelých ze skupiny LIP-AmB + EFU měla APACHE II skóre ≥ 25, na rozdíl od skupiny LIP-AmB + PLA, ve které většina úmrtí nastala při APACHE II skóre ≤ 25. Příčinou úmrtí první skupiny byla převážně bakteriální sepse a progrese malignity. Rozdíl v celkové mortalitě však nedosáhl statistické významnosti (16 % vs. 21 %). Při kombinované léčbě bylo významně rychleji, více než dvojnásobně, dosaženo eradikace kandid, a to i v podskupině kandidémie. Nežádoucí účinky léčby se v mírně vyšším procentu (10 % vs. 7 %) objevily ve skupině kombinované léčby.
Diskuse
Volba léku 1. volby invazivní kandidózy a kandidémie [85] vychází z kritérií hodnotících výsledky srovnávacích studií [86]. Ani tak nelze určit jediný lék 1. volby, neboť soubory nemocných, u nichž byly relevantní studie prováděny, se liší nejen stupněm rizika podle základního onemocnění (hematologické malignity, transplantace, solidní nádory atd.) a následných komplikací léčby (hemodynamická nestabilita, neutropenie, nitrožilní katétry, pobyt na JIP apod.), ale i formou kandidózy (orgánová kandidóza, kandidémie) a i rozdílným agens vyvolávajícím infekci (C. albicans vs. C. non-albicans). Navíc ani časová kritéria a kritéria hodnotící výsledky jednotlivých studií nejsou jednotná.
Z moderních účinných látek je jako lék 1. volby diskutován kaspofungin. Ten sice dosáhl statisticky stejných výsledků v hodnocení celého souboru (nejméně jeden den léčby) jako c-AmB, avšak ve skupině, která dostávala léčbu nejméně 5 dní, prokázal vyšší účinnost než c-AmB [77]. S některými kritickými názory na tuto studii se lze ztotožnit jen zčásti. Jeden z nich je, že kaspofungin dosáhl lepších výsledků zejména proto, že větší počet nemocných ve srovnávané skupině léčené amfotericinem přerušil léčbu v důsledku vyšší toxicity c-AmB [87]. Avšak to samé by platilo i pro lék 1. volby invazivní aspergilózy vorikonazol, jenž ve srovnání s c-AmB také profitoval z nižší toxicity vorikonazolu [88]. Námitku by bylo možné plně akceptovat v případě, že stejné charakteristiky by se týkaly i srovnávacích studií kaspofunginu s dalšími antimykotiky, např. lipidovými formami AmB, s flukonazolem nebo vorikonazolem. Mora-Duarte a kol. [77] zahrnuli do své studie i nemocné s neutropenií, avšak jejich počet je velmi malý (14/109 vs. 10/115), a je tedy obtížné studii hodnotit jako úspěšnou i u neutropenických nemocných. Z hlediska výsledku celého souboru se v zásadě neliší od studie, kterou uskutečnil Kullberg se spolupracovníky [74]: vorikonazol zde dosáhl proti c-AmB stejných výsledků u nemocných bez neutropenie. Srovnání těchto studií je obtížné, v první z nich byla hodnocena účinnost léčby 10. den, ve druhé až 12. týden, nejspíše proto je významný rozdíl v celkovém hodnocení úspěšnosti (tab. 8).
V rozhodování o indikaci jednoho či druhého preparátu je objektivně nutné vycházet z výsledku vlastní studie a ze srovnání s kontrolním antimykotikem. Zcela aktuálně byla publikována srovnávací studie nového echinokandinu anidulafunginu s flukonazolem [80]. Výsledky této studie jsou obdobné jako s kaspofunginem, takže nabídka pro 1. volbu je již širší. Preparát však ještě není v ČR registrován. Srovnatelné velmi dobré výsledky byly dosaženy s dalším echinokandinem micafunginem [82], který proti L-AmB dosáhl non-inferiority u invazivní kandidózy a kandidémie. Pro budoucí pozici echokandinů je nesporné, že v léčbě invazivní kandidózy mají prvořadou roli, zejména u kriticky nemocných, s neutropenií, hemodynamicky nestabilních, kteří navíc dostávali v předchozí době triazoly. Zdá se, že mezi jednotlivými echinokandiny však není zásadní rozdíl, a to ani z hlediska farmakologických vlastností [87].
Z triazolů je stále „ve hře" flukonazol. Zejména pro své vynikající farmakokinetické vlastnosti, které se uplatní zejména při kandidové meningitidě, endoftalmitidě a kandidurii [87]. Jeho indikace 1. volby jsou sice omezené (klinicky stabilní pacient, bez neutropenie, infekce C. albicans), včetně užšího spektra účinku (primárně rezistentní C. krusei, variabilně rezistentní C. glabrata), ale bezpečnost jeho podání je neporovnatelně vyšší. Zanedbatelná není ani jeho cena, zejména nyní, když jsou k dispozici jeho generické formy. V malé srovnávací studii proti itrakonazolu byly dosaženy stejné výsledky léčebné odpovědi [75]. Vorikonazol navázal na pozici flukonazolu, u nemocných bez neutropenie prokázal stejnou účinnost jako c-AmB, avšak s vyšší bezpečností podání. Jeho výhodou jako dalšího možného léku 1. volby u nemocných bez neutropenie je, stejně jako u flukonazolu, možnost dlouhodobé léčby perorální lékovou formou. Posakonazol, nový triazol 2. generace, který prokázal velmi dobrou účinnost v profylaxi [89–91] i v léčbě invazivní aspergilózy 2. linie [92], zatím do invazivní kandidózy „nezasáhl".
Historicky si první pozici dlouhá léta držel konvenční amfotericin B, zejména u nejrizikovějších, hemodynamicky nestabilních pacientů s infekcí převážně kandidami non-albicans. Proti flukonazolu má přednost širšího spektra účinku, echinokandiny i vorikonazol však tuto přednost eliminovaly. Konvenční amfotericin B z hlediska klinické praxe v této indikaci ztrácí svoji pozici, a to zejména pro nutnost častějšího přerušení léčby z důvodů toxicity. Lipidové formy amfotericinu B prokázaly stejnou účinnost a příčinou jejich dosavadního zařazení na 2. pozici je zejména vysoká cena, která převážila nad významným přínosem ve snížení nefrotoxicity a dobrých farmakologických vlastností. Cena se ani dnes zásadně nemění, je však srovnatelná s novými antimykotiky, jako je vorikonazol i kaspofungin. Z hlediska medicíny založené na důkazech (evidence based medicine) však lipidové formy amfotericinu B nemají v této situaci stále plně ověřenou pozici, chybí srovnávací studie proti ostatním antimykotikům. Výsledky studie CLEAR potvrzují dobrou účinnost i toleranci ABLC srovnatelnou s ostatními preparáty, pro přesnější zhodnocení ABCD chybí kvalitní dostatečně početná studie.
Závěrem lze konstatovat, že nelze určit jeden lék 1. volby, nabídka je širší a indikace pro každé z „úspěšných" antimykotik lze objektivně dokumentovat. Léčivo tedy volíme podle stavu pacienta a dalších kritérií, která byla zmíněna výše. Širší nabídka antimykotik také umožňuje využít sekvenční léčbu, kdy po neúspěchu jedné skupiny antimykotik lze pokračovat v léčbě skupinou jinou. Stejně tak se významně prosazuje kombinovaná léčba, která se, ač dražší, ukazuje jako perspektivní s vyšší nadějí na léčebný úspěch. Velmi perspektivní se zdá kombinovaná léčba s monoklonálními protilátkami (efungumab), výsledky studie, kterou uskutečnili Pachl a kol. [84], vyzněly velmi přesvědčivě ve všech sledovaných parametrech.
Seznam použité literatury
- [1] Wisplinghoff H, Bischoff T, Tallent SM, et al. Nosocomial Bloodstream Infections in US Hospitals: Analysis of 24,179 Cases from a Prospective Nationwide Surveillance Study. Clin Infect Dis 2004; 39: 309–317.
- [2] Beck-Sagué C, Jarvis WR. Secular Trends in the Epidemiology of Nosocomial Fungal Infections in the United States, 1980–1990. National Infections Surveillance system. J Infect Dis 1993; 167: 1247–1251.
- [3] Pfaller M, Wenzel R. Impact of the changing epidemiology of fungal infections in the 90“s. Eur J Clin Microbiol Infect Dis 1992; 11: 287–291.
- [4] Trick WE, Fridkin SK, Edwards JR, et al, and National Nosocomial Infections Surveillance System Hospitals. Secular trend of hospital-acquired candidemia among intensive care unit patients in the United States during 1989–1999. Clin Infect Dis 2002; 35: 627–630.
- [5] McNeil MM, Nash SL, Hajjeh RA, et al. Trends in Mortality Due to Invasive Mycotic Diseases in the United States, 1980 1997. Clin Infect Dis 2001; 33: 641–647.
- [6] Diekema DJ, Messer SA, Brueggemann AB, et al. Epidemiology of candidemia: 3-year results from the Emerging Infections and the Epidemiology of Iowa Organisms study. J Clin Microbiol 2002; 40: 1298 –1302.
- [7] Hajjeh RA, Sofair AN, Harrison LH, et al. Incidence of bloodstream infections due to Candida species and in vitro susceptibilities of isolates collected from 1998 to 2000 in a population-based active surveillance program. J Clin Microbiol 2004; 42:1519–1527.
- [8] Almirante A, Rodríguez D, Park BJ, et al. Epidemiology and Predictors of Mortality in Cases of Candida Bloodstream Infection: Results from Population-Based Surveillance, Barcelona, Spain, from 2002 to 2003. J Clin Microbiol 2005; 43: 1829–1835.
- [9] Asmundsdottir LR, Erlendsdottir H, Gottfredsson M. Increasing incidence of candidemia: results from a 20-year nationwide study in Iceland. J Clin Microbiol 2002; 40: 3489–3492.
- [10] Poikonen E, Lyytikäinen O, Anttila VJ, Ruutu P. Candidemia in Finland, 1995–1999. Emerg Infect Dis 2003; 9: 985–990.
- [11] Sandven PL, Bevanger A, Digranes P, et al. Constant low rate of fungemia in Norway, 1991 to 1996. J Clin Microbiol 1998; 36: 3455–3459.
- [12] Richet H, Roux P, Des Champs C, et al., and French Candidemia Study Group. Candidemia in French hospitals: incidence rates and characteristics. Clin Microbiol Infect 2002; 8:405–412.
- [13] Rodriguez D, Almirante B, Park B, et al. Candidemia in Neonatal Intensive Care Units: Barcelona, Spain Pediatric Inf Dis J 2006; 25: 224–229.
- [14] Kao AS, Brandt ME, Pruitt WR, et al. The epidemiology of candidemia in two United States cities: results of a population-based active surveillance. Clin Infect Dis 1999; 29: 1164–1170.
- [15] Marr KA, Seidel K, White TC, Bowden RA. Candidemia in allogeneic blood and marrow transplant recipients: evolution of risk factors after the administration of prophylactic fluconazole. J Infect Dis 2000; 181: 309–316.
- [16] Gudlaugsson O, Gillespie S, Lee K, et al. Attributable mortality of nosocomial candidemia, revisited. Clin Infect Dis 2003; 37: 1172–1177.
- [17] Pemán J, Cantón E, Gobernado M and the Spanish ECMM Working Group on Candidaemia. Eur J Clin Microbiol Infect Dis 2005; 24: 23–30.
- [18] Marchetti O, Bille J, Fluckiger U, et al. Epidemiology of candidemia in Swiss tertiary care hospitals: secular trends, 1991–2000. Clin Infect Dis 2004; 38:311–320.
- [19] Martin D, Persat F, Piens MA, Picot S. Candida species distribution in bloodstream cultures in Lyon, France, 1998–2001. Eur J Clin Microbiol Infect Dis 2005; 24: 329–333.
- [20] Buchta V, Kolář M, Bergerová T, et al. Výskyt potenciálně patogenních kvasinek v krvi a moči pacientů ve velkých nemocnicích v České republice. Klin Mikrobiol Inf Lék 1998; 4: 10–17.
- [21] Hamal P, Dobiášová S, Kocmanová I, et al. Candidemia in large Czech hospitals, 2000–2002: An epidemiological study. 15th Congress of the International Society for Human and Animal Mycology. San Antonio 2003, p. 463.
- [22] Pfaller MA. Diekema DJ. Role of sentinel surveillance of candidemia: trends in species distribution and antifungal susceptibility. J Clin Microbiol 2002; 40: 3551–3557.
- [23] Pfaller MA. Diekema DJ, Jones RN, et al. and SENTRY Participant Group. International surveillance of bloodstream infections due to Candida species: frequency of occurrence and in vitro susceptibilities to fluconazole, ravuconazole, and voriconazole of isolates collected from 1997 through 1999 in the SENTRY Antimicrobial Surveillance Program. J Clin Microbiol 2001; 39: 3254–3259.
- [24] Montravers P, Jabbour K. Clinical consequences of resistant Candida infections in intensive care. Int J Antimicrob Agents 2006; 27:1–6.
- [25] Bodey GP, Mardani M, Hanna HA, et al. The epidemiology of Candida glabrata and Candida albicans fungemia in immunocompromised patients with cancer. Am J Med 2002; 112: 380–385.
- [26] Panackal AA, Gribskov JL, Staab JF, et al. Clinical Significance of Azole Antifungal Drug Cross-Resistance in Candida glabrata. J Clin Microb 2006; 44: 1740–1743.
- [27] Boktour MR, Kontoyiannis DP, Hanna HA, et al. Multiple-species candidemia in patients with cancer. Cancer 2004; 101: 1860–1865.
- [28] Klastersky J, Paesmans M, Rubenstein EB, et al. The multinational association for supportive care in cancer risk index: a multinational scoring system for identify low-risk febrile neutropenic cancer patients. J Clin Oncol 2000; 18: 3038–3051.
- [29] Ostrosky-Zeichner L, Pappas PG. Invasive candidiasis in the intensive care unit. Crit Care Med 2006; 34: 857–863.
- [30] Anaissie EA, Rex JH, Uzun O, Vartivarian S. Predictors of Adverse Outcome in Cancer Patients with Candidemia. Am J Med 1998; 104: 238–245.
- [31] Blumberg HM, Jarvis WR, Soucie JM, et al. Risk Factors for Candidal Bloodstream Infections in Surgical Intensive Care Unit Patients: The NEMIS Prospective Multicenter Study. Clin Infect Dis 2001; 33: 177–186.
- [32] Leon C, Ruiz-Santana S, Saavedra P, et al. and EPCAN Study Group. A bedside scoring system ("Candida score") for early antifungal treatment in nonneutropenic critically ill patients with Candida colonization. Crit Care Med 2006; 34: 730–737.
- [33] Ostrosky-Zeichner L, Sable C, Sobel J, et al. Multicenter retrospective development and validation of a clinical prediction rule for nosocomial invasive candidiasis in the intensive care setting. Eur J Clin Microbiol Infect Dis 2007; 26: 271–276.
- [34] Haber J. Lipidový komplex amfotericinu B. Remedia 2001; 5: 298–307.
- [35] Kurtzman CP, Fell JW. The Yeast: a taxonomic study. Amsterdam: Elsevier 1998.
- [36] Bendel CM, Hostetter MK. Distinct mechanisms of epithelial adhesion for Candida albicans and Candida tropicalis. Identification of the participating ligands and development of inhibitory peptides. J Clin Invest 1993; 92: 1840–1849.
- [37] Calderone R, Braun P. Adherence and receptor relationships of Candida albicans. Microbiol Rev 1991; 55:1–20.
- [38] Klotz S. Fungal adherence to the vascular compartment: a critical step in the pathogenesis of disseminated candidiasis. Clin Infect Dis 1992; 14: 340–347.
- [39] Soll DR. High-frequency switching in Candida albicans. Clin Microbiol Rev 1992; 5: 183–203.
- [40] Soll DR. Gene regulation during high-frequency switching in Candida albicans. Microbiol 1997; 143: 279–288.
- [41] Vargas K, Wertz PW, Drake D, et al. Differences in adhesion of Candida albicans 3153A cells exhibiting switch phenotypes to buccal epithelium and stratum corneum. Infect Immun 1994; 62: 1328–1335.
- [42] Douglas LJ. Candida biofilms and their role in infection. Trends Microbiol 2003; 11: 30–36.
- [43] Růžička F, Holá V, Votava M, Tejkalová R. Detekce a význam tvorby biofilmu u kvasinek izolovaných z hemokultur. Klin Mikrobiol Inf Lék 2006; 12: 150–153.
- [44] Al-Fattani MA, Douglas LJ. Penetration of Candida biofilms by antifungal agents. Antimicrob Agents Chemother 2004; 48: 3291–3297.
- [45] Howlett JA, Squier CA. Candida albicans ultrastructure: colonization and invasion of oral epithelium. Infect Immun 1980; 29: 252–260.
- [46] Hube B. Candida albicans secreted aspartyl proteinases. Curr Top Med Mycol 1996; 7: 55–69.
- [47] Ghannoum MA. Potential Role of Phospholipases in Virulence and Fungal Pathogenesis. Clin Microbiol Rev 2000; 13: 122–143.
- [48] Chaffin WL, López-Ribot JL, Casanova M, et al. Cell Wall and Secreted Proteins of Candida albicans: Identification, Function, and Expression. Microbiol Mol Biol Rev 1998; 62: 130–180.
- [49] Ibrahim AS, Mirbod F, Filler SG, et al. Evidence implicating phospholipase as a virulence factor of Candida albicans. Infect Immun 1995; 63: 1993–1998.
- [50] Ito IJ, Hooshmand-Rad R. Treatment of Candida Infections with Amphotericin B Lipid Complex. Clin Infect Dis 2005; 40: S384–S391.
- [51] Barrett-Bee K, Hayes Y, Wilson RG, Ryley JF. A comparison of phospholipase activity, cellular adherence and pathogenicity of yeasts. J Gen Microbiol 1985; 131: 1217–1221.
- [52] Swoboda RK, Bertram G, Budge S, et al. Structure and regulation of the HSP90 gene from the pathogenic fungus Candida albicans. Infect Immun 1995; 63: 4506–4514.
- [53] Matthews RC, Burnie JP, Howat D, et al. Autoantibody to heat-shock protein 90 can mediate protection against systemic candidosis. Immunol 1991; 74: 20–24.
- [54] Matthews RC, Burnie JP. Recombinant antibodies: a natural partner in combinatorial antifungal therapy. Vaccine 2004; 22: 865–871.
- [55] Matthews RC, Burnie JP, Tabaqchali S. Isolation of immunodominant antigens from sera of patients with systemic candidiasis and characterization of serological response to Candida albicans. J Clin Microbiol 1987; 25: 230–237.
- [56] Matthews RC, Burnie JP. Diagnosis of systemic candidiasis by an enzyme-linked dot immunobinding assay for a circulating immunodominant 47-kilodalton antigen. J Clin Microbiol 1988; 26: 459–463.
- [57] Fromtling RA. Experimental and clinical pharmacokinetics of amphotericin B lipid complex. Drugs Today 1996; 32 (Suppl.G): 9–17.
- [58] Matot I, Pizov R. Pulmonary extraction and accumulation of lipid formulations of amphotericin B. Crit Care Med 2000; 28: 2528–2532.
- [59] Groll AH, Lyman CA, Petraitis V, et al. Compartmentalized Intrapulmonary Pharmacokinetics of Amphotericin B and Its Lipid Formulations. Antimicrob Agents Chemother 2006; 50: 3418–3423.
- [60] Calderone R, Diamond R, Senet JM, et al. Host cell-fungal cell interactions. J Med Vet Mycol 1994; 32 (Suppl. 1): 151–168.
- [61] Swenson CE, Perkins WR, Roberts P, et al. In vitro and in vivo antifungal activity of amphotericin B lipid complex: are phospholipases important? Antimicrob Agents Chemother 1998; 42: 767–771.
- [62] Bhamra R, Sa“ad A, Bolcsak LE, et al. Behavior of amphotericin B lipid complex in plasma in vitro and in the circulation of rats. Antimicrob Agents Chemother 1997; 41: 886–892.
- [63] Vadas P, Browning J, Edelson J, Pruzanski W. Extracellular phospholipase A2 expression and inflammation: the relationship with associated disease states. J. Lipid Mediators 1993; 8:1–30.
- [64] Bekersky I, Fielding RM, Buell D, Laerence I. Lipid-based amphotericin B formulations: from animals to man. Pharm Sci Technolo Today 1999; 2: 230–236.
- [65] Adedoyin A, Swenson CE, Bolcsak LE, et al. A Pharmacokinetic Study of Amphotericin B Lipid Complex Injection (Abelcet) in Patients with Definite or Probable Systemic Fungal Infections. Antimicrob Agents Chemother 2000; 44: 2900–2902.
- [66] Luke RG, Boyle JA. Renal effects of amphotericin B lipid complex. Am J Kidney Dis 1998; 31: 780–785.
- [67] Kuhn DM, George T, Chandra J, et al. Antifungal susceptibility of Candida biofilms: unique efficacy of amphotericin B lipid formulations and echinocandins. Antimicrob Agents Chemother 2002; 46: 1773–1780.
- [68] Walsh TJ, Hiemenz JW, Seibel NL, et al. Amphotericin B lipid complex for invasive fungal infections: analysis of safety and efficacy in 556 cases. Clin Infect Dis 1998; 26: 1383–1396.
- [69] Rex JH, Bennett JE, Sugar AM, et al. A randomized trial comparing fluconazole with amphotericin B for the treatment of candidemia in patients without neutropenia. N Engl J Med 1994; 331: 1325–1330.
- [70] Kontoyiannis DP, Bodey GP, Mantzoros CS. Fluconazole vs. amphotericin B for the management of candidaemia in adults: a meta-analysis. Mycoses 2001; 44: 125–135.
- [71] Rex JH, Walsh TJ, Sobel JD, et al. Practice guidelines for the treatment of candidiasis. Clin Infect Dis 2000; 30: 662–678.
- [72] Edwards JE Jr, Bodey GP, Bowden RA, et al. International conference for the development of a consensus on the management and prevention of severe candidal infections. Clin Infect Dis 1997; 25: 43–59.
- [73] Rex JH, Pappas PG, Karchmer AW, et al. A randomized and blinded multicenter trial of high-dose fluconazole plus placebo versus fluconazole plus amphotericin B as therapy for candidemia and its consequences in nonneutropenic subjects. Clin Infect Dis 2003; 36: 1221–1228.
- [74] Kullberg BJ, Sobel JD, Ruhnke M, et al. Voriconazole versus a regimen of amphotericin B followed by fluconazole for candidaemia in non-neutropenic patients: a randomised non-inferiority trial. The Lancet 2005; 366: 1435–1442.
- [75] Tuil O, Cohen Y. Itraconazole IV solution in the treatment of candidemia in non-neutropenic patients. 23rd Internat Symposion Intensive Care and Emergency Medicine. Critical Care 2003; 7: (Suppl. 2): P131–P132.
- [76] Noskin G, Pietrelli L, Gurwith M, Bowden R. Treatment of invasive fungal infections with amphotericin B colloidal dispersion in bone marrow transplant recipients. Bone Marrow Transplant 1999; 23: 697–703.
- [77] Mora-Duarte J, Betts R, Rotstein C, et al. Comparison of caspofungin and amphotericin B for invasive candidiasis. N Engl J Med 2002; 347: 2020–2029.
- [78] Walsh TJ. Echinocandins an advance in the primary treatment of invasive candidiasis. N Engl J Med 2002, 347: 2001–2003.
- [79] Brown AL, Greig JR. Caspofungin versus Amphotericin B for Invasive Candidiasis. N Engl J Med 2003; 348: 1287–1288.
- [80] Reboli AC, Rotstein C, Pappas PG, et al. Anidulafungin versus fluconazole for invasive candidiasis. N Engl J Med 2007; 356: 2472–2482.
- [81] Ostrosky-Zeichner L, Kontoyiannis D, Raffalli J, et al. International, open-label, noncomparative, clinical trial of micafungin alone and in combination for treatment of newly diagnosed and refractory candidemia. Eur J Clin Microbiol Infect Dis 2005; 24: 654–661.
- [82] Kuse E, Chetchotisakd P, da Cunha P, et al. Micafungin versus liposomal amphotericin B for candidaemia and invasive candidosis: a phase III randomised double-blind trial. The Lancet 2007; 369: 1519–1527.
- [83] Casadevall A. The Third Age of Antimicrobial Therapy. Clin Infect Dis 2006; 42: 1414–1416.
- [84] Pachl J, Svoboda P, Jacobs F, et al. A Randomized, Blinded, Multicenter Trial of Lipid-Associated Amphotericin B Alone versus in Combination with an Antibody-Based Inhibitor of Heat Shock Protein 90 in Patients with Invasive Candidiasis. Clin Infect Dis 2006; 42: 1404–1413.
- [85] Slavin MA, Szer J, Grigg AP, et al. Guidelines for the use of antifungal agents in the treatment of invasive Candida and mould infections. Internal Medicine Journal 2004; 34: 192–200.
- [86] Kish MA. Guide to Development of Practice Guidelines. Clin Infect Dis 2001; 32: 851–854.
- [87] Sobel JD, Revankar SG. Echinocandins – First-Choice or First-Line Therapy for Invasive Candidiasis? Editorial. N Engl J Med 2007; 356: 2525–2526.
- [88] Herbrecht R, Denning DW, Patterson TF, et al. Voriconazole versus amphotericin B for primary therapy of invasive aspergillosis. N Engl J Med 2002; 347: 408–415.
- [89] Cornely OA, Maertens J, Winston DJ, et al. Posaconazole vs. fluconazole or itraconazole prophylaxis in patients with neutropenia. N Engl J Med 2007; 356; 348–359.
- [90] Maertens J. Evaluating prophylaxis of invasive fungal infections in patients with haematologic malignancies. Eur J Haematol 2007; 78: 275–282.
- [91] Ullmann AJ, Lipton JH, Vesole DH, et al. Posaconazole or fluconazole for prophylaxis in patients with neutropenia. N Engl J Med 2007; 356: 335–347.
- [92] Walsh TJ, Raad I, Pattersn TF, et al. Treatment of invasive aspergillosis with posaconazole. Clin Infect Dis 2007; 44: 2–12.