Liraglutid
Na patogenezi onemocnění diabetes mellitus (DM) 2. typu se podílí snížený inkretinový efekt, za který jsou zodpovědné inkretinové hormony a peptidy, zejména glukagon-like peptid 1 (GLP-1). Na základě nutričního stimulu v gastrointestinálním traktu dochází k uvolnění inkretinů ze střevní sliznice. Hlavním cílem jejich působení je pankreas, kde stimulují glukózo-dependentní inzulinovou sekreci a napomáhají tak dosažení glukózové homeostázy. Humánní GLP-1 má krátký biologický poločas, proto není vhodný k dlouhodobému léčebnému užití. Z tohoto důvodu byla vyvinuta analoga GLP-1, která jsou rezistentní vůči časné enzymatické degradaci. V současnosti je pro použití v terapii DM 2. typu k dispozici exenatid, nově přichází do klinické praxe liraglutid, jehož podávání je spojeno s nadějnými výsledky.
Úvod – inkretiny a liraglutid, mechanismus účinku
![Graf 1 Porovnání plazmatických hladin inzulinu po intravenózním a perorálním podání glukózy u zdravých osob a u pacientů s diabetem 2. typu; podle [2] – Nauck M, et al., 1986.](https://www.remedia.cz/photo-a-27379---.jpg) Díky dominantnímu efektu inzulinu v udržení glukózové homeostázy se většina studií zabývajících se patogenezí diabetu mellitu 2. typu soustředila právě na definování poruchy inzulinové sekrece. U DM 2. typu bývá vyjádřena současně jak kvalitativní, tak kvantitativní porucha inzulinové sekrece. Inzulinová rezistence, která je v počátcích onemocnění kompenzována hyperinzulinémií, se s postupem vývoje diabetu prohlubuje, současně klesá endogenní inzulinová produkce a dochází k nezbytnému zahájení inzulinoterapie. V současné době je popsán další fenomén ovlivňující průběh DM. Jedná se o tzv. inkretinový efekt, který je dán působením inkretinů. Inkretinový efekt udává následující fakt: při podání identického množství glukózy perorálně a intravenózně dojde k významnější produkci inzulinu po podání perorálním [1]. Tento inkretinový efekt je oslabený u DM 2. typu (graf 1) a představuje důležitou komponentu v patogenezi DM 2. typu. U osob s normální glukózovou tolerancí je inkretinový efekt zodpovědný až za dvě třetiny inzulinové odpovědi po stimulu potravou. U diabetiků bývá snížen až pod 20 % [2]. Z toho vyplývá, že porušená inkretinová odpověď povede k zásadnímu prohloubení postprandiální hyperglykémie. Vše je důsledkem snížení hladin inkretinů u diabetiků, a to zejména glukagon-like peptidu 1 (GLP-1) [3]. Inkretiny jsou střevní hormony secernované jako odpověď na příjem potravy a jejich produkce vede ke stimulaci glukózo-dependentní inzulinové sekrece. Na úrovni slinivky břišní působí inkretiny také ve smyslu snížení
Díky dominantnímu efektu inzulinu v udržení glukózové homeostázy se většina studií zabývajících se patogenezí diabetu mellitu 2. typu soustředila právě na definování poruchy inzulinové sekrece. U DM 2. typu bývá vyjádřena současně jak kvalitativní, tak kvantitativní porucha inzulinové sekrece. Inzulinová rezistence, která je v počátcích onemocnění kompenzována hyperinzulinémií, se s postupem vývoje diabetu prohlubuje, současně klesá endogenní inzulinová produkce a dochází k nezbytnému zahájení inzulinoterapie. V současné době je popsán další fenomén ovlivňující průběh DM. Jedná se o tzv. inkretinový efekt, který je dán působením inkretinů. Inkretinový efekt udává následující fakt: při podání identického množství glukózy perorálně a intravenózně dojde k významnější produkci inzulinu po podání perorálním [1]. Tento inkretinový efekt je oslabený u DM 2. typu (graf 1) a představuje důležitou komponentu v patogenezi DM 2. typu. U osob s normální glukózovou tolerancí je inkretinový efekt zodpovědný až za dvě třetiny inzulinové odpovědi po stimulu potravou. U diabetiků bývá snížen až pod 20 % [2]. Z toho vyplývá, že porušená inkretinová odpověď povede k zásadnímu prohloubení postprandiální hyperglykémie. Vše je důsledkem snížení hladin inkretinů u diabetiků, a to zejména glukagon-like peptidu 1 (GLP-1) [3]. Inkretiny jsou střevní hormony secernované jako odpověď na příjem potravy a jejich produkce vede ke stimulaci glukózo-dependentní inzulinové sekrece. Na úrovni slinivky břišní působí inkretiny také ve smyslu snížení 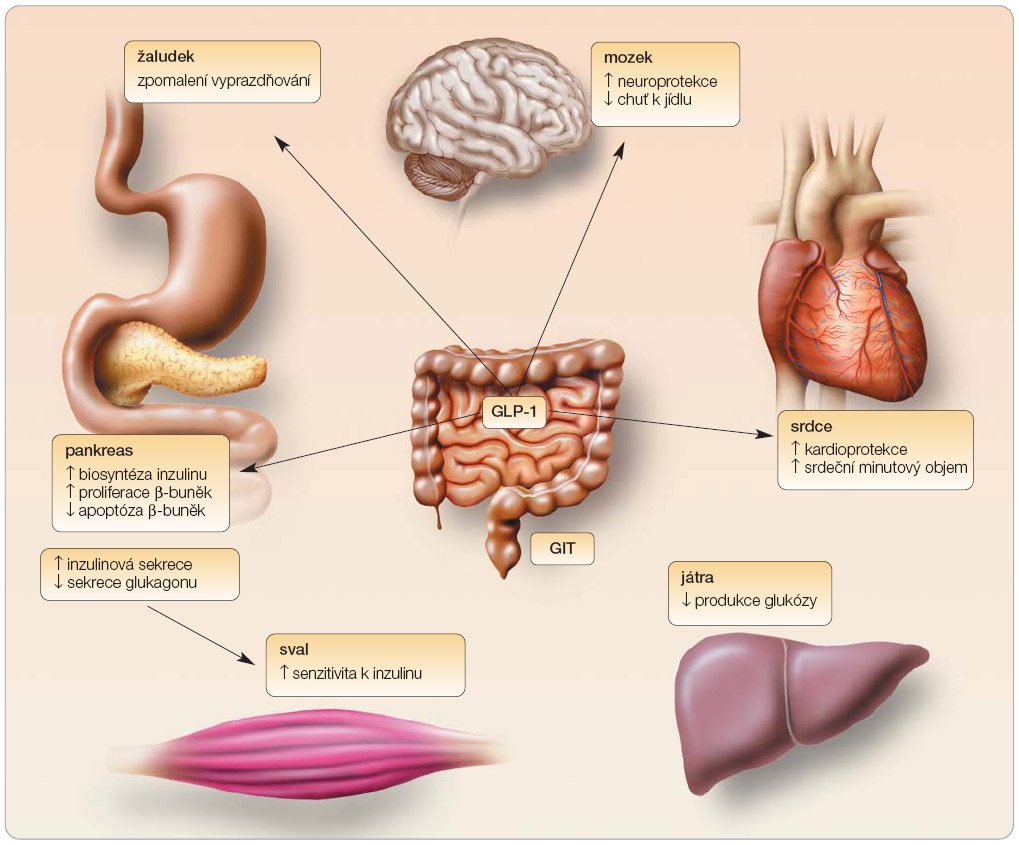 apoptózy β-buněk, zvyšují jejich proliferaci. Za hlavní část inkretinového efektu je zodpovědný právě GLP-1, který má široké spektrum působnosti. Mimo pankreas byly receptory pro GLP-1 popsány na srdci, v játrech, ve svalu a v žaludku (obr. 1). GLP-1 je produkován endokrinními L-buňkami distálního střeva, má velice krátký poločas (cca 2 min.), neboť dochází záhy k jeho degradaci enzymem DPP-4 (dipeptidyl peptidáza 4). Infuzní podání GLP-1 zlepšuje glykémii, nicméně intravenózní podání není řešením pro běžné užití z dlouhodobého hlediska [4]. Možnosti, jak zasáhnout do inkretinové osy, přinesli agonisté receptoru GLP-1 rezistentní vůči degradaci DPP-4. První léčivá látka – exenatid – je již na trhu a její verze s dlouhodobým uvolňováním (exenatid LAR) je ve stadiu klinického zkoušení fáze III. Dalším zástupcem je liraglutid.
apoptózy β-buněk, zvyšují jejich proliferaci. Za hlavní část inkretinového efektu je zodpovědný právě GLP-1, který má široké spektrum působnosti. Mimo pankreas byly receptory pro GLP-1 popsány na srdci, v játrech, ve svalu a v žaludku (obr. 1). GLP-1 je produkován endokrinními L-buňkami distálního střeva, má velice krátký poločas (cca 2 min.), neboť dochází záhy k jeho degradaci enzymem DPP-4 (dipeptidyl peptidáza 4). Infuzní podání GLP-1 zlepšuje glykémii, nicméně intravenózní podání není řešením pro běžné užití z dlouhodobého hlediska [4]. Možnosti, jak zasáhnout do inkretinové osy, přinesli agonisté receptoru GLP-1 rezistentní vůči degradaci DPP-4. První léčivá látka – exenatid – je již na trhu a její verze s dlouhodobým uvolňováním (exenatid LAR) je ve stadiu klinického zkoušení fáze III. Dalším zástupcem je liraglutid.
Farmakologické vlastnosti
![Obr. 2 Porovnání molekuly lidského GLP-1 a molekuly liraglutidu (GLP-1 analoga); podle [9, 21] – Degn, et al., 2004; Knudsen, et al., 2000.](https://www.remedia.cz/photo-a-27381---.jpg) Liraglutid, chemicky Arg 34, Lys 26-(N-eta-(gama-Glu-(N-α-hexadecynoyl)))-GLP-1 (7-37), je GLP-1 analog vznikající modifikací molekuly humánního GLP-1 a vyznačující se 97% strukturální shodou s humánním GLP-1. Modifikace zahrnuje substituci lysinu v pozici 34 za arginin a dále pak navázání C16 řetězce na lysin v pozici 26. Schéma porovnání molekuly liraglutidu a molekuly humánního GLP-1 je znázorněno na obr. 2. Modifikace molekuly GLP-1 způsobuje asociaci do heptamerů v podkoží a dále vazbu na sérový albumin, čímž je zpomalena absorpce a degradace liraglutidu ve srovnání s nativním GLP-1. Biologický poločas eliminace liraglutidu po subkutánním podání se pohybuje mezi 10 a 15 hodinami [5]. Díky tomu lze liraglutid podávat 1krát denně, na rozdíl od molekuly exenatidu, který kvůli krátkodobému působení vyžaduje dávkování 2krát denně. Farmakokinetické vlastnosti nejsou ovlivněny pohlavím. Liraglutid byl podáván diabetikům 2. typu s renální a jaterní insuficiencí, čímž se neprokázalo negativní působení liraglutidu na tyto komorbidity, nebylo proto nutné upravovat dávkování [6, 7].
Liraglutid, chemicky Arg 34, Lys 26-(N-eta-(gama-Glu-(N-α-hexadecynoyl)))-GLP-1 (7-37), je GLP-1 analog vznikající modifikací molekuly humánního GLP-1 a vyznačující se 97% strukturální shodou s humánním GLP-1. Modifikace zahrnuje substituci lysinu v pozici 34 za arginin a dále pak navázání C16 řetězce na lysin v pozici 26. Schéma porovnání molekuly liraglutidu a molekuly humánního GLP-1 je znázorněno na obr. 2. Modifikace molekuly GLP-1 způsobuje asociaci do heptamerů v podkoží a dále vazbu na sérový albumin, čímž je zpomalena absorpce a degradace liraglutidu ve srovnání s nativním GLP-1. Biologický poločas eliminace liraglutidu po subkutánním podání se pohybuje mezi 10 a 15 hodinami [5]. Díky tomu lze liraglutid podávat 1krát denně, na rozdíl od molekuly exenatidu, který kvůli krátkodobému působení vyžaduje dávkování 2krát denně. Farmakokinetické vlastnosti nejsou ovlivněny pohlavím. Liraglutid byl podáván diabetikům 2. typu s renální a jaterní insuficiencí, čímž se neprokázalo negativní působení liraglutidu na tyto komorbidity, nebylo proto nutné upravovat dávkování [6, 7].
Glykémie nalačno (FPG)
U zdravých jedinců došlo po podání liraglutidu ke snížení FPG ve srovnání s placebem [8]. Studie fáze III ukázaly, že liraglutid snižuje FPG jak v monoteapii, tak i v kombinaci s glimepiridem, s metforminem či při podání s oběma preparáty, stejně tak v kombinaci s rosiglitazonem a metforminem (viz níže).
Postprandiální glykémie (PPG)
Liraglutid signifikantně snižuje PPG u zdravých osob [5]. K významnému snížení PPG (o 20 %) během 24hodinového hodnocení AUC (area under curve – plocha pod křivkou) po podání liraglutidu dochází i u pacientů s DM 2. typu. Míra snížení glykémie je závislá na podané dávce léčivé látky [9].
Vyprazdňování žaludku
U zdravých dobrovolníků bylo signifikantně opožděno vyprazdňování žaludku, měřeno jako AUC 3-o-methylglukózy (3-omg) během prandiální fáze. Vrchol 3-omg byl o 15 minut opožděn po podání liraglutidu v dávce 10 µg/kg [8]. Tento jev se však nepotvrdil při sledování pacientů s diabetem 2. typu, u nichž nebyl pozorován vliv liraglutidu na vyprazdňování žaludku [9].
Redukce příjmu potravy
Na zvířecích modelech byl zaznamenán účinek liraglutidu na snížení příjmu potravy, nikoli však u pacientů s DM 2. typu, kde tyto výsledky nebyly potvrzeny [10].
Inzulinémie a funkce β-buněk
Liraglutid zvyšuje glukózo-dependentní sekreci inzulinu. U pacientů s DM 2. typu liraglutid zvýšil až o 70 % inzulinovou produkci. Toto zvýšení bylo srovnatelné se sekrecí ve skupině zdravých kontrolních osob a v placebové skupině [11]. Liraglutid v dávkách 0,65 mg, 0,75 mg, 1,25 mg a 1,9 mg zlepšil funkci β-buněk hodnocenou indexem HOMA (Homeostasis model assessment – index vyjadřující míru inzulinové rezistence). 14týdenní léčba liraglutidem zvýšila inzulinovou sekreci u pacientů s DM 2. typu jak v časné, tak v pozdní fázi [12]. Důležitou oblastí zájmu je hodnocení efektu léčby liraglutidem na masu β-buněk. Studie ukazují, že liraglutid vede ke zvýšení masy β-buněk, inhibuje jejich apoptózu, a to v závislosti na dávce [13].
Hladiny glukagonu
Dosažené hladiny glukagonu po podání liraglutidu se v dostupných pracích liší. U pacientů s DM 2. typu, jimž byl podáván liraglutid v dávce 7,5 µg/kg, byly hladiny jen hraničně sníženy ve srovnání s placebem [14]. Další ze studií ukázala, že pacienti s DM 2. typu léčení liraglutidem v dávce 6 µg/kg měli shodnou lačnou glukagonémii při srovnání s placebem, avšak postprandiálně došlo k významné redukci [9].
Klinické zkušenosti
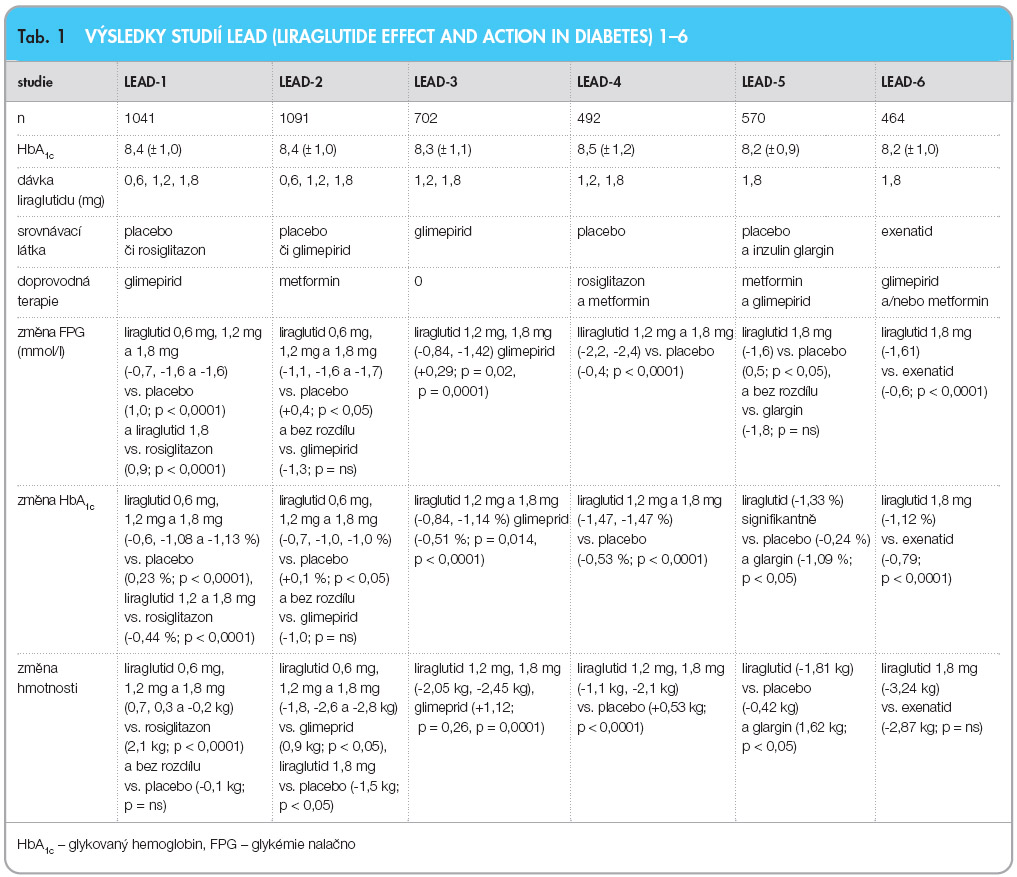 Ve všech studiích byl liraglutid dávkován jedenkrát denně. Po podání liraglutidu došlo ke zlepšení metabolické kompenzace, ke snížení tělesné hmotnosti, ke zlepšení funkce β-buněk a ke snížení systolického krevního tlaku. Současně bylo jeho podávání spojeno s minimem nežádoucích účinků, zejména s hypoglykémií a gastrointestinální symptomatologií (nauzea, zvracení, zácpa, průjem). K dnešnímu dni bylo provedeno 8 studií fáze III. Nejdůležitější výsledky projektu LEAD 1–6 (Liraglutide Effect and Action in Diabetes) jsou shrnuty v tab. 1.
Ve všech studiích byl liraglutid dávkován jedenkrát denně. Po podání liraglutidu došlo ke zlepšení metabolické kompenzace, ke snížení tělesné hmotnosti, ke zlepšení funkce β-buněk a ke snížení systolického krevního tlaku. Současně bylo jeho podávání spojeno s minimem nežádoucích účinků, zejména s hypoglykémií a gastrointestinální symptomatologií (nauzea, zvracení, zácpa, průjem). K dnešnímu dni bylo provedeno 8 studií fáze III. Nejdůležitější výsledky projektu LEAD 1–6 (Liraglutide Effect and Action in Diabetes) jsou shrnuty v tab. 1.
Liraglutid byl podáván v následujících léčebných kombinacích:
Liraglutid + glimepirid
- LEAD-1 – srovnání liraglutidu přidaného ke glimepiridu s kombinační terapií glimepirid + rosiglitazon vs. placebo [15].
- LEAD-3 – srovnání liraglutidu v monoterapii s glimepiridem v monoterapii [16].
Liraglutid + metformin
- LEAD-2 – srovnání účinnosti a bezpečnosti liraglutidu, glimepiridu a placeba, vše v kombinaci s metforminem [17].
Liraglutid + metformin + rosiglitazon
- LEAD-4 – srovnání účinků různých dávek liraglutidu v kombinační terapii s metforminem a s rosiglitazonem vs. kombinační terapie rosiglitazon + metformin [18].
Liraglutid + metformin + glimepirid
- LEAD-5 – srovnání kombinační terapie liraglutid + metformin + glimepirid versus inzulin glargin + metformin + glimeprid [19].
- LEAD-6 – srovnání kombinační terapie liraglutid + metformin a/nebo glimepirid versus exenatid se zmíněnou kombinací PAD (perorální antidiabetika) [20].
Výsledky z projektů LEAD 1–6 jsou uvedeny v tab. 1.
Dávkování, bezpečnost podávání a nežádoucí účinky
Ve studiích bylo používáno dávkování 0,6 mg, 1,2 mg a 1,8 mg.
Nejčastěji byly ve studiích zaznamenány gastrointestinální nežádoucí účinky, avšak pouze výjimečně vedly k vyřazení pacientů z projektu (LEAD-1–6). Při podávání nejvyšší dávky, tj. 1,8 mg liraglutidu, se vyskytovala nauzea u 6,8–40 % pacientů. Při podávání kombinace liraglutid + metformin se projevila nauzea v 17,7 % případů (LEAD-2). U mnoha pacientů se však jednalo o nezávažnou a přechodnou komplikaci. Zvracení, průjem a zácpa se objevovaly méně často. Obdobně cefalea a závratě se vyskytovaly zřídka.
Zvláštní pozornost si zaslouží hypoglykemické epizody, které se při podávání liraglutidu vyskytovaly méně často. V monoterapii nebyla zaznamenána žádná závažná epizoda, v kombinační terapii se objevilo několik stavů lehké hypoglykémie (obzvláště v kombinaci s deriváty sulfonylurey). Např. ve studii LEAD-2 bylo procento pacientů s lehkými hypoglykémiemi následující: při podávání liraglutidu v dávce 0,6 mg 6,2 %, při dávce 1,2 mg 3,3 % a při podávání dávky 1,8 mg byly lehké hypoglykémie zaznamenány u 6,6 % pacientů ve srovnání s glimepridem, kde mělo tuto komplikaci 26,9 % pacientů, v placebové skupině pak 5,8 %.
Ve studii LEAD-5 byl porovnáván účinek liraglutidu a inzulinu glarginu při použití ve formě doplňkové léčby u pacientů s nedostatečnou kompenzací dvěma nejrozšířenějšími perorálními antidiabetiky – metforminem a glimepiridem. V porovnání s placebovou skupinou, ve které se vyskytla hypoglykémie u 16,7 % případů, byl výskyt hypoglykémií ve větvi s dávkou 1,8 mg liraglutidu 27,4 % a v glarginové větvi 28,9 %.
Podávání liraglutidu těhotným a kojícím ženám nebylo prozatím zkoumáno.
Zařazení do současné palety léčiv
Liraglutid se nabízí jako nová možnost terapie u pacientů s diabetem 2. typu. Svým působením respektuje patofyziologický aspekt DM 2. typu – zasahuje do inkretinové poruchy. Jedním z přínosů léčby založené na tomto principu je stimulace glukózo-dependentní inzulinové sekrece, která eliminuje počet hypoglykémií. V současné době se na podkladě výsledků nových studií (např. studie ACCORD) ubírá pozornost diabetologie k intenzivní a těsné kompenzaci diabetu, ale vše za podmínek bezpečné medikace s minimem hypoglykémií. Proto právě analog GLP-1 představuje atraktivní volbu pro pacienty s DM 2. typu. Neméně významný je úbytek tělesné hmotnosti dosažený při užití této léčby. Liraglutid bude výhodným preparátem do kombinační terapie s metforminem, a to zejména u pacientů obézních, právě díky svému pozitivnímu efektu na redukci hmotnosti.
Liraglutid by mohl být užitečným lékem ve fázi časného DM a prediabetu s cílem oddálit progresivní selhání β-buněk.
Seznam použité literatury
- [1] Elrick H, Stimmler L, Hlad CJ, et al. Plasma insulin response to oral and intravenous glucose administration. J Clin Endocrinol Metab 1964; 24: 1076–1082.
- [2] Nauck M, Stockmann F, Ebert R, et al. Reduced incretin effect in type 2 (non-insulin-dependent) diabetes. Diabetologia 1986; 29: 46–52.
- [3] Toft-Nielsen MB, Damholt MB, Madsbad S, et al. Determinants of the impaired secretion of glucagon-like peptide-1 in type 2 diabetic patients. J Clin Endocrinol Metab 2001; 86: 3717–3723.
- [4] Nauck MA, Kleine N, Orskov C, et al. Normalization of fasting hyperglycaemia by exogenous glucagon-like peptide-1 (7-36 amide) in type 2 (non-insulin-dependent) diabetic patients. Diabetologia 1993; 36: 741–744.
- [5] Agerso H, Jensen LB, Elbrond B, et al. The pharmacokinetics, pharmacodynamics, safety and tolerability of NN2211, a new long-acting GLP-1 derivate, in healthy men. Diabetologia 2002; 45: 195–202.
- [6] Lisbeth V, Jacobsen C. Pharmacokinetics of the long-acting human GLP-1 analogue liraglutide in subject with renal impairment. Diabetes (Suppl.) 2007; abstract 0513P.
- [7] Fint A, Nazzal K, Jagielski P, et al. Influence of hepatic impairment on pharmacokinetics of the long-acting human GLP-1 analogue liraglutide. Diabetes (Suppl.) 2007; abstract 0545P.
- [8] Juhl CB, Hollingdal M, Sturis J, et al. Bedtime administration of NN2211, a long-acting GLP-1 derivative, substantially reduces fasting and postprandial glycemia in type 2 diabetes. Diabetes 2002; 51: 424–429.
- [9] Degn KB, Juhl CB, Sturis J, et al. One week's treatment with the long-acting glucagon-like peptide 1 derivate liraglutide (NN2211) markedly improves 24-h glycemia and alpha-and beta-cell function and reduces endogenous glucose release in patients with type 2 diabetes. Diabetes 2004; 53: 1187–1194.
- [10] Harder H, Nelson L, Tu DT, et al. The effect of liraglutide, a long-acting glucagon-like peptide 1 derivate, on glycemic control, body composition, and 24-h energy expenditure in patients with type 2 diabetes. Diabetes Care 2004; 27: 1915–1921.
- [11] Mari A, Degn K, Brock B, et al. Effects of the long-acting human glucagon-like peptide-1 analog liraglutide on beta-cell function in normal living conditions. Diabetes Care 2007; 30: 2032–2033.
- [12] Vilsboll T, Brock B, Perrild H, et al. Liraglutide, a once-daily human GLP-1 analogue, improves pancreatic B-cell function and arginine-stimulated insulin secretion during hyperglycaemia in patients with Type 2 diabetes mellitus. Diabet Med 2008; 25: 152–156.
- [13] Sturis J, Gotfredsen CF, Romer J, et al. GLP-1 derivative liraglutide in rats with b-cell deficiencies: influence of metabolic state on beta-cell mass dynamics. Br J Pharmacol 2003; 140: 123–132.
- [14] Chang AM, Jakobsen G, Sturis J, et al. The GLP-1 derivative NN2211 restores beta-cell sensitivity to glucose in type 2 diabetic patients after a single dose. Diabetes 2003; 52: 1786–1791.
- [15] Marre M, Shaw J, Brandle M, et al. Liraglutid, a once-daily human GLP-1 analogue, added to a sulphonylurea over 26 weeks produces greater improvements in glycaemic and weight control compared with adding rosiglitazone or placebo in subjects with type 2 diabetes (LEAD-1 SU). Diabetic Medicine 2009; Accepted Article, doi: 10.1111/j.1464-5491.2009.02666.x
- [16] Garber A, Henry R, Ratner R, et al. Liraglutide versus glimepiride monotherapy for type 2 diabetes (LEAD-3 Mono): a randomised, 52-week, phase III, double-blind, parallel-treatment trial. Lancet 2008; 373: 473–481.
- [17] Nauck M, Frid A, Hermansen K, et al. Efficacy and safety comparison of liraglutide, glimepiride, and placebo, all in combination with metformin, in type 2 diabetes mellitus: the LEAD (liraglutide effect and action in diabetes)-2 study. Diabetes Care 2009; 32: 84–90.
- [18] Zinman B, Gerich J, Buse J, et al. Effect of the GLP-1 analogue liraglutide on glycaemic control and weight reduction in patients on metformin and rosiglitazone: a randomised double-blind placebo-controlled trial (LEAD-4). Diabetologia 2008; 51 (Suppl. 1): S359.
- [19] Russell-Jones D, Vaag A, Schmitz O, et al. Significantly better glycemic control and weight reduction with liraglutide, a once-daily human GLP-1 analog, compared with insulin glargine: all as add-on to metformin and a sulfonylurea in type 2 diabetes (LEAD-5). Diabetologia 2008; 51 (Suppl. 1): S68.
- [20] Blonde L, Rosenstock J, Sesti G. Liraglutide: superior glycaemic control versus exenatide when added to metformin and/or sulphonylurea in type 2 diabetes (LEAD-6). Diabetologia 2008; 32 (Suppl.): A107.
- [21] Knudsen LB, Nielsen PF, Huusfeldt PO, et al. Potent derivatives of glucagon-like peptide-1 with pharmacokinetic properties suitable for once daily administration. J Med Chem 2000; 43: 1664–1669.