Liraglutid v léčbě obezity
Souhrn:
Liraglutid je dlouhodobě působící analog glukagonu podobného peptidu 1 (glucagon like peptide 1, GLP–1) používaný doposud v léčbě diabetu 2. typu v denní dávce 1,2 mg nebo 1,8 mg. Nedávno byl schválen v Evropské unii a ve Spojených státech amerických v denní dávce 3,0 mg podávané subkutánně jako doplněk nízkoenergetické diety a zvýšené fyzické aktivity k dlouhodobé léčbě obézních jedinců (index tělesné hmotnosti, body mass index, BMI ≥ 30 kg/m2) nebo u pacientů s nadváhou s výchozím BMI ≥ 27 kg/m2 v přítomnosti aspoň jedné komorbidity související se zvýšenou hmotností. Liraglutid omezuje energetický příjem jednak tím, že snižuje chuť k jídlu v mozkovém kmeni a v hypothalamu, a jednak tím, že ovlivňuje jídelní chování v mozkových centrech odměňování („reward centers“). Randomizované klinické studie s liraglutidem byly provedeny u více než 5 000 pacientů trpících nadváhou nebo obezitou. Do studií byli zahrnuti jedinci bez diabetu, s prediabetem, s diabetem a se syndromem obstrukční spánkové apnoe. Ve všech studiích došlo k signifikantně větší redukci hmotnosti a obvodu pasu u skupiny léčené liraglutidem než ve skupině, které bylo podáváno placebo. Průměrný pokles hmotnosti o 7,4 %, jehož bylo docíleno v odpovědi na podávání 3,0 mg liraglutidu v prvním roce, přetrvával po dvou letech léčby. Dlouhodobý pokles hmotnosti po třech letech podávání liraglutidu byl významně ovlivněn mírou snížení hmotnosti v časné fázi léčby. Snížení hmotnosti u respondérů (úbytek hmotnosti ≥ 4 % v 16. týdnu) dosáhlo 8,2 % (8,7 kg), zatímco u non respondérů pouze 1,4 % (1,5 kg). Vedle hmotnostního poklesu navozuje liraglutid významné zlepšení glykemického a lipidového profilu, hodnot krevního tlaku, ukazatelů chronického zánětu a syndromu obstrukční spánkové apnoe. Brání rovněž rozvoji diabetu a přispívá k normalizaci glykemického profilu u pacientů s prediabetem. Díky 97% podobnosti s endogenním hormonem GLP–1 je liraglutid dobře tolerován a nežádoucí účinky jsou vzácné. Nejčastěji se vyskytují transitorní gastrointestinální nežádoucí účinky, které ustupují během čtyř týdnů léčby. Možné negativní působení mírného vzestupu tepové frekvence je tlumeno významným poklesem krevního tlaku. V závěru přehledového sdělení jsou zmíněna potenciální nevelká rizika s ohledem na bezpečnost léčby liraglutidem a perspektivy léčby obezity novými antiobezitiky.vedeny u více než 5 000 pacientů trpících nadváhou nebo obezitou. Do studií byli zahrnuti jedinci bez diabetu, s prediabetem, s diabetem a se syndromem obstrukční spánkové apnoe. Ve všech studiích došlo k signifikantně větší redukci hmotnosti a obvodu pasu u skupiny léčené liraglutidem než ve skupině, které bylo podáváno placebo. Průměrný pokles hmotnosti o 7,4 %, jehož bylo docíleno v odpovědi na podávání 3,0 mg liraglutidu v prvním roce, přetrvával po dvou letech léčby. Dlouhodobý pokles hmotnosti po třech letech podávání liraglutidu byl významně ovlivněn mírou snížení hmotnosti v časné fázi léčby. Snížení hmotnosti u respondérů (úbytek hmotnosti ≥ 4 % v 16. týdnu) dosáhlo 8,2 % (8,7 kg), zatímco u non respondérů pouze 1,4 % (1,5 kg). Vedle hmotnostního poklesu navozuje liraglutid významné zlepšení glykemického a lipidového profilu, hodnot krevního tlaku, ukazatelů chronického zánětu a syndromu obstrukční spánkové apnoe. Brání rovněž rozvoji diabetu a přispívá k normalizaci glykemického profilu u pacientů s prediabetem. Díky 97% podobnosti s endogenním hormonem GLP–1 je liraglutid dobře tolerován a nežádoucí účinky jsou vzácné. Nejčastěji se vyskytují transitorní gastrointestinální nežádoucí účinky, které ustupují během čtyř týdnů léčby. Možné negativní působení mírného vzestupu tepové frekvence je tlumeno významným poklesem krevního tlaku. V závěru přehledového sdělení jsou zmíněna potenciální nevelká rizika s ohledem na bezpečnost léčby liraglutidem a perspektivy léčby obezity novými antiobezitiky.
Key words: liraglutide – GLP-1 – obesity management – weight loss – cardiometabolic risks.
Summary:
Liraglutide is a long acting analog of human glucagon like peptide 1 (GLP-1) used for the treatment of type 2 diabetes in a daily dose 1.2 mg or 1.8 mg. It has recently been approved in the European Union and the USA in a daily dose of 3.0 mg subcutaneously as an adjunct to a reduced energy diet and increased physical activity for chronic weight management in obese (body mass index [BMI] ≥ 30 kg/m2) or overweight patients with an initial BMI > 27 kg/m2 and with at least one of obesity related co morbidity. Liraglutide decreases energy intake by reducing appetite in the brainstem and hypothalamus as well as by affecting food reward behaviors in the brain reward centers. Randomized clinical trials with liraglutide conducted in more than 5,000 overweight/obese patients without type 2 diabetes, with prediabetes, type 2 diabetes, and obstructive sleep apnea syndrome revealed significantly greater reductions in weight and waist circumference in the liraglutide treated than in placebo treated groups. The mean weight loss of 7.4% achieved at 1 year in response to a 3 mg daily dose sustained at 2 years. The long term weight loss after 3 years of liraglutide treatment was significantly determined by early weight loss. Weight loss in early responders (≥ 4% weight loss at 16 weeks) reached 8.2% (–8.7 kg), while in non responders it was only 1.4% (–1.5 kg). In addition to weight loss, liraglutide induces significant improvements in glycemic and lipid profile, blood pressure, markers of chronic inflammation, and obstructive sleep apnea syndrome. It also prevents the development of type 2 diabetes and contributes to normalization of glycemic profile in patients with prediabetes. Due to a 97% homology to human GLP–1, liraglutide is well tolerated and adverse effects are rare. Most common adverse events are gastrointestinal and transient, usually disappearing during the 4 weeks of treatment. A small increase in pulse rate after liraglutide is opposed by significant reductions in blood pressure. Finally, the review paper focuses on modest safety concerns associated with liraglutide treatment and the perspectives in obesity management with novel anti obesity drugs.
Liraglutid – nově indikován jako antiobezitikum
Liraglutid je zařazen do skupiny Jiná antidiabetika, kromě inzulinů, ATC kód A10BX07. V doporučené denní dávce 3 mg je distribuován pod názvem Saxenda (6 mg/ml inj. sol.) jako doplňková léčba obezity, resp. nadváhy [1]. Řadíme jej tudíž do skupiny léků k léčbě obezity, tzv. antiobezitik. Tyto přípravky však nejsou doposud v seznamu léků samostatnou kategorií. Je třeba zdůraznit, že léčba antiobezitiky by měla byt integrální součástí komplexního léčebného programu obezity, který zahrnuje nízkoenergetickou dietu, zvýšenou pohybovou aktivitu a kognitivně behaviorální terapii [2–4]. Podávání antiobezitik, včetně liraglutidu, indikujeme u obézních pacientů charakterizovaných indexem tělesné hmotnosti (body mass index, BMI) ≥ 30 kg/m2 a u jedinců s nadváhou s BMI 27–30 kg/m2 v přítomnosti komplikací obezity, jako jsou např. diabetes mellitus 2. typu, prediabetes, hypertenze, dyslipidemie či obstrukční spánková apnoe (OSA) [1]. Podle evropských i amerických klinických doporučení pro léčbu obezity je za účinné považováno snížení hmotnosti o 5–10 %, neboť je provázeno významným snížením kardiometabolických rizik [2–4].
V minulosti byla mnohá antiobezitika stažena z trhu vzhledem k výskytu závažných nežádoucích účinků (kardiovaskulárních, plicní hypertenze, chlopenních vad, deprese, návykovosti atd.). Navíc bylo přerušeno klinické zkoušení několika dalších antiobezitik buď pro malou účinnost, či vzhledem k výskytu nežádoucích účinků [5]. K dlouhodobé léčbě obezity zůstal na trhu po řadu let pouze orlistat. Tato situace navodila mezi kliniky skepsi ohledně úlohy farmakoterapie v léčbě obezity. Avšak s postupným uvedením nových antiobezitik na trh (lorcaserinu a kombinace fenterminu s topiramatem v USA, liraglutidu a kombinace naltrexonu s bupropionem jak v USA, tak v Evropské unii, cetilistatu v Japonsku a v Indii) v letech 2012–2015 je opět věnována zvýšená pozornost roli těchto léků v komplexní dlouhodobé léčbě obezity [6].
Farmakologické charakteristiky
Podávání analog gastrointestinálních hormonů představuje specifický přístup k léčbě obezity, který využívá fyziologického působení těchto hormonů na regulaci příjmu potravy a homeostázy glukózy. Liraglutid je dlouhodobě účinkující analog lidského glukagonu podobného peptidu 1 (glucagon‑like peptide‑1, GLP‑1). Jeho molekula se z 97 % podobá lidskému GLP‑1. Významná podobnost je příčinou nízkého výskytu nežádoucích účinků včetně tvorby protilátek proti tomuto inkretinu. Po subkutánní aplikaci se liraglutid pomalu vstřebává a maximální plazmatické koncentrace dosahuje za 11,7 hodiny po podání, přičemž expozice liraglutidu se zvyšuje úměrně dávce [1,7]. Absolutní biologická dostupnost po subkutánním podání je přibližně 55 %. Liraglutid se v plazmě vyskytuje převážně vázaný na bílkoviny (> 98 %) a je podobně jako GLP‑1 metabolizován enzymy dipeptidylpeptidázou IV a neutrální endopeptidázou [7]. Degradace liraglutidu však probíhá pomaleji, což umožňuje jeho dlouhodobé působení. Biologický poločas eliminace liraglutidu je 15,6 hodiny, zatímco u nativního GLP‑1 je pouze 1–2 minuty.
Fyziologické působení GLP‑1
Glukagonu podobný peptid 1 je hormon produkovaný L‑buňkami tenkého střeva [8]; GLP‑1 vzniká v L‑buňkách prekursoru proglukagonu, který je kódován genem proglukagonu [9]. Sekrece GLP‑1 se zvyšuje postprandiálně. Postprandiální mechanismy stimulace signalizace a sekrece GLP‑1 se liší u jednotlivých makronutrientů [10]. Navíc bylo prokázáno, že sacharidy a tuky stimulují sekreci GLP‑1 více než bílkoviny [11]. Nejenom nutrienty stimulují sekreci GLP‑1, ale ke stimulaci jeho sekrece dochází též vlivem enterálního progesteronu a žlučových kyselin [10].
Významnou úlohu sehrává tento hormon jak při regulaci glukózové homeostázy, tak při regulaci příjmu potravy. Glukagonu podobný peptid 1 zvyšuje glukózo‑dependentní inzulinovou sekreci, potlačuje sekreci glukagonu a zpomaluje vyprazdňování žaludku; GLP‑1 aktivuje v β‑buňkách pankreatu adenylátcyklázu, což vede ke zvýšení koncentrace cyklického adenosinmonofosfátu (cAMP) a sekrece inzulinu po požití glukózy [8]. Toto příznivé působení na glykoregulaci lze prokázat i u pacientů s diabetes mellitus 2. typu. Působení GLP‑1 na sekreci inzulinu je závislé na aktuální glykemii. To zabraňuje vzniku hypoglykemických stavů [8]. Sekreci glukagonu neovlivňuje GLP‑1 přímo, ale prostřednictvím stimulace sekrece somatostatinu v δ‑buňkách, který pak parakrinním působením inhibuje uvolňování glukagonu z přilehlých α‑buněk pankreatu [12]. Chuť k jídlu a příjem potravy ovlivňuje GLP‑1 prostřednictvím vagových nervových vláken [13]. Ta zprostředkují anorexigenní signalizaci neurony v nucleus tractus solitarii, které se dále projikují do hypothalamických jader – nucleus arcuatus a nucleus paraventricularis. Vedle regulace příjmu potravy se GLP‑1 uplatňuje v jídelním chování a v systému odměňování („reward“) a přání, který je lokalizován v mesolimbickém systému, a to především ve ventrální tegmentální oblasti a v nucleus accumbens [14,15]. GLP‑1 vykazuje supresivní působení na tento systém, který úzce souvisí s dopaminergními neuropřenašeči ovlivňujícími pocit libosti a návykovost. Duální centrální ovlivnění příjmu potravy liraglutidem příznivě ovlivňuje prognózu redukčního režimu v klinické praxi.
Experimentální studie prokázaly po aplikaci liraglutidu zlepšení paměti spolu s pozitivními morfologickými změnami v mozku (redukce plaků a beta‑amyloidu a vzestup počtu progenitorových buněk) [16]. Pokud bude toto příznivé působení inkretinů ověřeno v klinických randomizovaných studiích, lze v budoucnu očekávat jejich využití jak v terapii Alzheimerovy choroby, tak v prevenci a v léčbě cévních mozkových příhod.
Liraglutid jako agonista GLP‑1 rovněž zvyšuje obsah minerálních látek v kosti a zabraňuje depleci kostní hmoty po redukční dietě [17]. Aktivace receptorů GLP‑1 potlačuje agregaci trombocytů a zabraňuje tvorbě trombu [18].
Liraglutid v léčbě diabetes mellitus 2. typu
Pro své antidiabetogenní působení byl liraglutid schválen k léčbě pacientů s diabetes mellitus 2. typu lékovými agenturami v Evropě a v USA již v roce 2009, resp. 2010. Od té doby se liraglutid stal integrální součástí léčby diabetu 2. typu [19]. Podáváme jej v denní dávce 1,2 mg nebo 1,8 mg v případech, kdy samotná léčba perorálními antidiabetiky a/nebo inzulinem spolu s dietou a fyzickou aktivitou nevede k adekvátní kontrole glykemie. Přehledné referáty uveřejněné v minulých letech v tomto časopise poukázaly jak na strukturu, farmakodynamiku, absorpci, distribuci, metabolismus a na eliminaci liraglutidu z organismu, tak na jeho využití v léčbě diabetu 2. typu [20,21]. Autorky v nich shrnuly hlavní výsledky šesti studií LEAD, které prokázaly účinnost a bezpečnost podávání liraglutidu v jednorázové denní dávce 1,2 mg a 1,8 mg v léčbě diabetiků. Vedle příznivého ovlivnění glukózové homeostázy bylo ve všech studiích LEAD prokázáno nevelké (o 2–3 kg), ale významné snížení tělesné hmotnosti [20,21].
Liraglutid jako antiobezitikum – iniciální klinické studie
Cílem klinických studií v obezitologii je obvykle hodnocení účinnosti redukčního režimu s ohledem jak na snížení hmotnosti, tak na zmenšení obvodu pasu jako ukazatele abdominální obezity. Dalším cílem je obvykle hodnocení ústupu ukazatelů kardiometabolického rizika, které zahrnují parametry glukózové homeostázy, lipidový profil, krevní tlak, markery chronického zánětu atd. Často se hodnotí též změna prevalence metabolického syndromu a prediabetu.
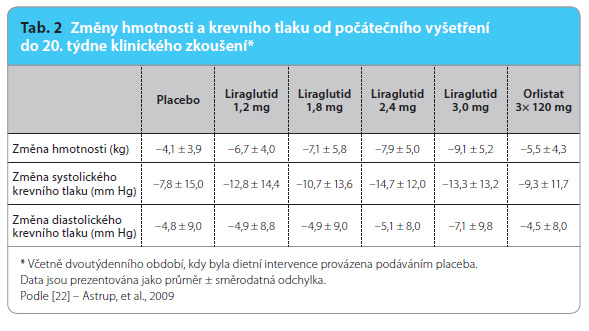
Evropské randomizované dvojitě zaslepené a placebem kontrolované studie Astrupa a kol. [22] se účastnilo 564 obézních jedinců ve věku 18–65 let, kterým byl po dobu 20 týdnů jednou denně večer podkožně aplikován buď liraglutid (v dávce 1,2 mg, 1,8 mg, 2,4 mg nebo 3,0 mg), nebo placebo. Šestá skupina pacientů užívala perorálně orlistat v  dávce 3× denně 120 mg s hlavními jídly. V průběhu studie byla pacientům doporučena dieta o energetickém deficitu 500 kcal a zvýšení pohybové aktivity, které bylo monitorováno pedometry. Pacienti, jimž byl aplikován liraglutid, docílili signifikantně výraznějšího snížení hmotnosti nežli ti, kteří užívali placebo nebo orlistat. Průměrný pokles hmotnosti po podávání liraglutidu v dávkách 1,2–3,0 mg byl 4,8 kg, 5,5 kg, 6,3 kg a 7,2 kg, zatímco v placebové skupině dosahoval pouze 2,8 kg a při užívání orlistatu 4,1 kg. Současně došlo k významnému zmenšení obvodu pasu jako ukazatele abdominální obezity, a to jak u mužů, tak u žen (tab. 1). Více než 5% snížení hmotnosti docílilo 76,1 % pacientů, jimž byl podáván liraglutid v dávce 3,0 mg, 44 % pacientů léčených orlistatem a 29,6 % pacientů, kteří užívali placebo. Více než 10% poklesu hmotnosti dosáhlo 28,3 % pacientů z těch, kteří užívali liraglutid v dávce 3,0 mg, 9,5 % pacientů z těch, kterým byl podáván orlistat, a pouze 2,0 % pacientů ve sk
dávce 3× denně 120 mg s hlavními jídly. V průběhu studie byla pacientům doporučena dieta o energetickém deficitu 500 kcal a zvýšení pohybové aktivity, které bylo monitorováno pedometry. Pacienti, jimž byl aplikován liraglutid, docílili signifikantně výraznějšího snížení hmotnosti nežli ti, kteří užívali placebo nebo orlistat. Průměrný pokles hmotnosti po podávání liraglutidu v dávkách 1,2–3,0 mg byl 4,8 kg, 5,5 kg, 6,3 kg a 7,2 kg, zatímco v placebové skupině dosahoval pouze 2,8 kg a při užívání orlistatu 4,1 kg. Současně došlo k významnému zmenšení obvodu pasu jako ukazatele abdominální obezity, a to jak u mužů, tak u žen (tab. 1). Více než 5% snížení hmotnosti docílilo 76,1 % pacientů, jimž byl podáván liraglutid v dávce 3,0 mg, 44 % pacientů léčených orlistatem a 29,6 % pacientů, kteří užívali placebo. Více než 10% poklesu hmotnosti dosáhlo 28,3 % pacientů z těch, kteří užívali liraglutid v dávce 3,0 mg, 9,5 % pacientů z těch, kterým byl podáván orlistat, a pouze 2,0 % pacientů ve sk
upině s placebem. Tabulka 2 ukazuje snížení hmotnosti, systolického a diastolického tlaku po podávání placeba, liraglutidu v dávce 1,2–3,0 mg a orlistatu ve srovnání s iniciálními hodnotami před dvoutýdenním obdobím, ve kterém byla podávána pouze nízkoenergetická dieta s placebem. Ukázala se závislost hmotnostního poklesu na podané dávce liraglutidu. Hmotnostní pokles během 20 týdnů byl reprezentován převážně úbytkem tukové hmoty (15,4 %), a ne snížením objemu beztukové hmoty (2,0 %) [23]. Podávání liraglutidu podle očekávání příznivě ovlivnilo glykemii a inzulinemii nalačno a koncentraci glykovaného hemoglobinu (HbA1c). Po 20 týdnech léčby se počet pacientů s metabolickým syndromem snížil ve skupině léčené liraglutidem v dávce 2,4 mg a 3,0 mg o více než 60 %, zatímco ve skupině léčené orlistatem o 38 % a při podávání placeba o 13 %. Prevalence prediabetu se po 20 týdnech podávání liraglutidu v dávce 1,8 mg, 2,4 mg a 3,0 mg signifikantně snížila, a to o 84–96 %, přičemž po podávání placeba a orlistatu k významné změně v prevalenci prediabetu nedošlo.
Dvacetitýdenní studie byla prodloužena na dva roky a závěrečné fáze se účastnilo celkem 268 pacientů [23]. Po roce bylo snížení hmotnosti po liraglutidu podávaném v denní dávce 3,0 mg o 5,8 kg větší než po placebu a o 3,8 kg větší než po léčbě orlistatem. Po dvou letech si pacienti léčení liraglutidem v dávce 2,4 mg nebo 3,0 mg udrželi hmotnostní pokles dosahující 7,8 kg. Po dvou letech došlo po podávání liraglutidu oproti orlistatu k signifikantnímu vzestupu hodnoty HDL (high density lipoproteins, lipoproteiny o vysoké hustotě) cholesterolu a k poklesu krevního tlaku, hodnoty triglyceridů, glykemie nalačno a ke snížení hodnoty HbA1c. Při léčbě liraglutidem po dobu dvou let se snížila prevalence jak prediabetu (o 52 %), tak metabolického syndromu (o 59 %).
Klinické studie SCALE
Účinnost a bezpečnost liraglutidu v léčbě obezity a jejích komplikací potvrdily čtyři doposud publikované studie SCALE [24,25,27,28]. Studie Waddena a kol. [24] se zabývala úlohou liraglutidu při udržení, resp. zvýšení míry hmotnostního poklesu navozeného nízkoenergetickou dietou. Byl sledován soubor 422 pacientů s obezitou a s nadváhou, kteří všichni v úvodní fázi snížili svou tělesnou hmotnost po léčbě nízkoenergetickou dietou o 6,3 kg. Následné podávání liraglutidu v denní dávce 3,0 mg po dobu 56 týdnů navodilo další pokles hmotnosti (–6,0 kg), zatímco při podávání placeba se hmotnost signifikantně nezměnila (–0,1 kg), viz tab. 1. Snížení hmotnosti o více než 5 % si udrželo 81,4 % pacientů ze skupiny s léčbou liraglutidem, zatímco u pacientů, kteří užívali placebo, to bylo 48,9 %. Na konci redukčního režimu vykazovali pacienti léčení liraglutidem oproti placebové skupině signifikantně vyšší pokles glykemie a inzulinemie nalačno, pokles koncentrací triglyceridů a hypersenzitivního C‑reaktivního proteinu (hs‑CRP) a rovněž systolického krevního tlaku [24].
The SCALE Obesity and Prediabetes Trial představuje nejrozsáhlejší klinickou studii s liraglutidem, do níž bylo zahrnuto 2 487 pacientů, jimž byl podáván liraglutid (3 mg/den), a 1 244 pacientů, kteří užívali placebo po dobu 56 týdnů [25]. V obou skupinách byla aplikována intervence dodržování zdravé životosprávy. V tab. 1 je patrno, že po podávání liraglutidu bylo docíleno signifikantně vyššího poklesu hmotnosti než po aplikaci placeba (–8,4 kg vs. –2,8 kg). Podíl jedinců s redukcí hmotnosti o více než 5 % byl po léčbě liraglutidem více než dvojnásobný oproti placebu a při snížení hmotnosti o více než 10 % byl tento podíl dokonce více než trojnásobný. V tab. 3 jsou porovnávány změny v BMI a ve vybraných kardiometabolických rizicích mezi skupinou pacientů, kterým byl podáván liraglutid, a skupinou, ve které bylo aplikováno placebo. V obvodu pasu, v ukazatelích glukózové homeostázy, v hodnotách krevního tlaku a v lipidovém profilu bylo prokázáno významně větší zlepšení po podávání liraglutidu ve srovnání s placebem (tab. 3). Liraglutid normalizuje glukózovou homeostázu u prediabetiků a brání rozvoji diabetu 2. typu. Podíl pacientů s iniciálně diagnostikovaným prediabetem se po roce snížil po léčbě liraglutidem na 30,8 %, zatímco v placebové skupině pouze na 67,3 %. V průběhu 56 týdnů sledování byl diagnostikován diabetes 2. typu u 14 pacientů ze skupiny placeba a pouze u čtyř pacientů ze skupiny s léčbou liraglutidem. V dubnu 2016 byly na 98th Annual Meeting of The Endocrine Society prezentovány výsledky SCALE Obesity and Prediabetes Trial po tříletém sledování [26]. Snížení hmotnosti u časných respondérů (definovaných poklesem hmotnosti > 4 % v 16. týdnu) dosahovalo 8,7 kg (8,2 %), zatímco u časných non‑respondérů (definovaných poklesem hmotnosti < 4 % v 16. týdnu) dosahovalo pouze 1,5 kg (1,4 %). U 0,5 % respondérů došlo během tří let k rozvoji diabetu 2. typu, zatímco u non‑respondérů se diabetes 2. typu za tu dobu objevil ve 4,6 %. Adekvátní snížení tělesné hmotnosti v 16. týdnu příznivě ovlivnilo též normalizaci glykemie u prediabetiků.
signifikantně vyššího poklesu hmotnosti než po aplikaci placeba (–8,4 kg vs. –2,8 kg). Podíl jedinců s redukcí hmotnosti o více než 5 % byl po léčbě liraglutidem více než dvojnásobný oproti placebu a při snížení hmotnosti o více než 10 % byl tento podíl dokonce více než trojnásobný. V tab. 3 jsou porovnávány změny v BMI a ve vybraných kardiometabolických rizicích mezi skupinou pacientů, kterým byl podáván liraglutid, a skupinou, ve které bylo aplikováno placebo. V obvodu pasu, v ukazatelích glukózové homeostázy, v hodnotách krevního tlaku a v lipidovém profilu bylo prokázáno významně větší zlepšení po podávání liraglutidu ve srovnání s placebem (tab. 3). Liraglutid normalizuje glukózovou homeostázu u prediabetiků a brání rozvoji diabetu 2. typu. Podíl pacientů s iniciálně diagnostikovaným prediabetem se po roce snížil po léčbě liraglutidem na 30,8 %, zatímco v placebové skupině pouze na 67,3 %. V průběhu 56 týdnů sledování byl diagnostikován diabetes 2. typu u 14 pacientů ze skupiny placeba a pouze u čtyř pacientů ze skupiny s léčbou liraglutidem. V dubnu 2016 byly na 98th Annual Meeting of The Endocrine Society prezentovány výsledky SCALE Obesity and Prediabetes Trial po tříletém sledování [26]. Snížení hmotnosti u časných respondérů (definovaných poklesem hmotnosti > 4 % v 16. týdnu) dosahovalo 8,7 kg (8,2 %), zatímco u časných non‑respondérů (definovaných poklesem hmotnosti < 4 % v 16. týdnu) dosahovalo pouze 1,5 kg (1,4 %). U 0,5 % respondérů došlo během tří let k rozvoji diabetu 2. typu, zatímco u non‑respondérů se diabetes 2. typu za tu dobu objevil ve 4,6 %. Adekvátní snížení tělesné hmotnosti v 16. týdnu příznivě ovlivnilo též normalizaci glykemie u prediabetiků.
Dále byla publikována randomizovaná studie SCALE Diabetes věnovaná hmotnostnímu poklesu u diabetiků s nadváhou či s obezitou [27]. Liraglutid nebo placebo byly podávány po dobu 56 týdnů. Podobně jako v ostatních studiích bylo i v této studii demonstrováno signifikantně výraznější snížení hmotnosti v obou skupinách léčených liraglutidem v dávce 1,8 mg a 3,0 mg oproti skupině, které bylo podáváno placebo (tab. 1). Průměrný hmotnostní pokles po roční léčbě liraglutidem (3 mg/den) byl v této studii s diabetiky nižší než ve studii Pi‑Sunyera a kol. [25], do níž nebyli diabetici začleněni (6 % vs. 8 %). To je v souladu se zkušenostmi s jinými antiobezitiky, jejichž podávání u diabetiků je spojeno s méně významným snížením hmotnosti než u nediabetiků. Proto se u diabetiků po tříměsíční léčbě antiobezitiky považuje za adekvátní hmotnostní pokles 3 % a více, zatímco u nediabetiků je to 5 % a více [3]. Podávání liraglutidu signifikantně zlepšilo glukózovou homeostázu posuzovanou podle změn hodnot HbA1c, podle glykemie nalačno i postprandiálně, koncentrace glukagonu nalačno, koncentrace proinzulinu, poměru proinzulin/inzulin a podle indexu inzulinové rezistence (HOMA‑IR) [27]. Navíc léčba liraglutidem (v dávce 3,0 mg/den nebo 1,8 mg/den) na rozdíl od placeba umožnila snížení dávky podávaných antidiabetik. Po léčbě liraglutidem došlo rovněž ke zlepšení lipidového profilu a k signifikantnímu poklesu hodnoty hs‑CRP a hodnoty inhibitoru aktivátoru plasminogenu 1 (plasminogen activator inhibitor‑1, PAI‑1), koncentrace fibrinogenu a poměru albuminu a kreatininu v moči.
Poslední ze studií, která byla nedávno publikována, SCALE Sleep Apnoea, se zabývala vlivem léčby liraglutidem (3 mg/den) po dobu 32 týdnů na ukazatele obstrukční spánkové apnoe u obézních nediabetiků [28]. Tíže obstrukční spánkové apnoe byla klasifikována podle indexu apnoe‑hypopnoe. Při užívání liraglutidu došlo oproti placebu k významně většímu poklesu tohoto indexu (–12,6 vs. –6,1 příhody během hodiny). Zlepšení ukazatelů OSA úzce souviselo s mírou snížení tělesné hmotnosti. Vedle signifikantního rozdílu hmotnostního úbytku (–5,7 % vs. –1,6 %) bylo po léčbě liraglutidem oproti placebu pozorováno signifikantní snížení systolického krevního tlaku a hodnot HbA1c.
Za zmínku stojí i fakt, že nedávno bylo rovněž prokázáno, že krátkodobé podávání liraglutidu obézním diabetikům po dobu tří měsíců významně sníží excesivní spavost přes den [29]. Ta bývá podobně jako obstrukční spánková apnoe spojována s inzulinovou rezistencí a s viscerální obezitou [30]. Spolu se snížením excesivní spavosti byla ve studii zaznamenána redukce hmotnosti, obvodu pasu a krku a bylo pozorováno zlepšení glykemického i lipidového profilu pacientů.
Recentní metaanalýza zahrnující více než 5 000 pacientů z pěti klinických studií prokázala při léčbě liraglutidem u různých ras jak stejnou účinnost s ohledem na snížení hmotnosti a omezení kardiometabolických rizik, tak obdobný výskyt nežádoucích účinků [31].
Nežádoucí účinky
Ve všech stěžejních studiích s podáváním liraglutidu v léčbě obezity převažovala mezi nežádoucími účinky gastrointestinální symptomatologie: nauzea, průjmy, zácpa, zvracení, dyspepsie a bolesti břicha [22–25,27,28]. Většina nežádoucích účinků byla klasifikována jako mírného nebo středně závažného charakteru a během 4–8 týdnů obvykle ustoupila. Jedinci, kteří udávali přechodnou nauzeu a zvracení v prvních týdnech podávání liraglutidu v denní dávce 3 mg, docílili během jednoho roku většího průměrného hmotnostního poklesu než jedinci, kteří tyto nežádoucí účinky neudávali (9,2 kg vs. 6,3 kg) [32]. Nauzea a zvracení neovlivnily zlepšení kvality života, která byla hodnocena dotazníkem Impact of Weight on Quality of Life (IWQoL‑Lite).
Závažnější nežádoucí účinky se objevily častěji po podávání liraglutidu (v 6,2 %) než po podávání placeba (v 5 %) [25,33]. Patřily mezi ně zejména cholelitiáza, cholecystitida a akutní pankreatitida. Ve SCALE Obesity and Prediabetes Clinical Trial byl po podávání liraglutidu ve srovnání s placebem častější výskyt cholecystopatií (2,5 % vs. 1,0 %) a akutních pankreatitid (0,2 % vs. 0,0 %) [25]. Všechny čtyři případy akutní pankreatitidy byly klasifikovány jako mírné podle revidované Atlantské klasifikace akutních pankreatitid. Dva případy pankreatitidy byly spojeny s cholelitiázou. Větší výskyt cholecystopatií po liraglutidu může souviset s výraznějším snížením hmotnosti, které je provázeno větší exkrecí cholesterolu do žluče a stoupáním litogenního indexu. Dalším vysvětlením může být významné snížení cholecystokininem navozeného vyprazdňování žlučníku, které bylo popsáno u zdravých osob, jimž byl aplikován agonista GLP‑1 exenatid [34]. Za zmínku stojí, že rozsáhlá studie, která dlouhodobě sledovala 20 748 diabetiků léčených inkretiny a 51 712 diabetiků léčených deriváty sulfonylurey, nezjistila rozdíl ve výskytu akutní pankreatitidy mezi oběma skupinami [35]. Ve třech studiích nebyl v souvislosti s podáváním liraglutidu v léčbě obezity pozorován vznik akutní pankreatitidy [22,24,27]. Jeden úspěšně zaléčený případ akutní pankreatitidy u pacienta s cholelitiázou popsal po 299 dnech léčby liraglutidem Astrup a kol. [23].
Na riziko vzniku pankreatitidy při léčbě diabetu 2. typu inkretiny upozornila v roce 2013 studie, která zjistila častější hospitalizace pro akutní pankreatitidu u diabetiků léčených sitagliptinem nebo exenatidem [36]. Nicméně vyhodnocení rozsáhlých experimentálních a klinických studií provedené následně společně americkým Úřadem pro kontrolu potravin a léčiv (Food and Drug Administration, FDA) a Evropskou lékovou agenturou (European Medicines Agency, EMA) došlo k závěru, že neexistují přesvědčivé důkazy o souvislosti mezi podáváním inkretinových mimetik a výskytem akutní pankreatitidy a karcinomu pankreatu [37].
V souvislosti s podáváním liraglutidu se upozorňuje na možnost výskytu nádorů štítné žlázy, zejména medulárního karcinomu [1]. Ve stěžejních studiích však nebyl při podávání liraglutidu v léčbě obezity pozorován výskyt medulárního karcinomu štítné žlázy a plazmatické koncentrace kalcitoninu byly v normě [22–25,27]. Nicméně se doporučuje používat liraglutid v léčbě pacientů trpících onemocněním štítné žlázy s opatrností [1].
U obézních pacientů léčených liraglutidem se ve srovnání s placebem poněkud častěji vyskytovala hypoglykemie [23–25]. V rozsáhlé studii SCALE Obesity and Prediabetes byla popsána spontánní hypoglykemie u 1,3 % pacientů léčených liragutidem a u 1,0 % pacientů, kteří užívali placebo [25]. Častěji se však hypoglykemie, zejména ta závažnější, objevovala u diabetiků, kteří užívali sulfonylureová antidiabetika [27].
Dehydratace nebyla ve studiích s použitím liraglutidu jako antiobezitika popisována. Nicméně v případě větší ztráty tekutin při zvracení či při průjmech je třeba dbát na adekvátní rehydrataci. Právě v souvislosti s dehydratací byly po podávání agonistů receptorů GLP‑1 popsány ojedinělé případy poruchy funkce ledvin a akutního selhání ledvin [38,39]. I když liraglutid na rozdíl od exenatidu není vylučován ledvinami, mělo by být jeho podávání zvažováno u pacientů s porušenou funkcí ledvin.
Ve studiích s liraglutidem došlo ke zlepšení ukazatelů kvality života jak z hlediska fyzického, tak mentálního zdraví. V nejrozsáhlejší studii SCALE byl podáván liraglutid v dávce 3,0 mg 2 481 pacientům s cílem snížit tělesnou hmotnost. Během jednoho roku léčby liraglutidem nebyl u pacientů zjištěn častější výskyt psychických poruch včetně depresí a suicidiálního chování [25].
Zatímco expozice větším dávkám liraglutidu je spojena s větším úbytkem hmotnosti, nežádoucí účinky, s výjimkou gastrointestinálních, nesouvisejí s aplikovanou dávkou farmaka [40].
Liraglutid a kardiovaskulární systém
Po léčbě liraglutidem je oproti placebu pozorováno nevelké, ale významné zvýšení tepové frekvence (cca o 2 tepy/min). Ve studii Pi‑Sunyera a kol. [25] nebyl pozorován rozdíl ve výskytu srdečních arytmií mezi oběma skupinami. Ve výskytu závažných kardiovaskulárních příhod (nefatální infarkty myokardu, nefatální cévní mozkové příhody a úmrtí z kardiovaskulárních příčin) se obě skupiny rovněž nelišily. Monami a kol. provedli metaanalýzu studií, které srovnávaly kardiovaskulární rizika u diabetiků léčených agonisty GLP‑1, s diabetiky, kteří agonisty GLP‑1 neužívali [41]. Výskyt závažných kardiovaskulárních příhod byl významně nižší při léčbě agonisty GLP‑1 než při podávání placeba či pioglitazonu. Nicméně aplikace agonistů GLP‑1 signifikantně neovlivnila mortalitu.
Mírné zvýšení tepové frekvence v souvislosti s podáváním agonistů GLP‑1 je antagonizováno jejich příznivým působením na krevní tlak, kdy ve všech studiích došlo k signifikantnímu poklesu jak systolického, tak diastolického krevního tlaku. Navíc se zvažuje přímé kardioprotektivní působení inkretinů [42].
Kontraindikace
Při přecitlivělosti na liraglutid nebo na některou z pomocných látek je kontraindikováno jeho užívání. Indikační omezení je v přehledu shrnuto v tab. 4.
Lékové interakce
Liraglutid má in vitro velmi nízký potenciál pro farmakokinetické interakce s léčivými látkami ovlivňujícími cytochrom P450. Ovlivnění vstřebávání perorálních léčivých přípravků v důsledku zpomaleného vyprazdňování žaludku působením liraglutidu není klinicky významné. Po zahájení léčby liraglutidem u pacientů léčených warfarinem se doporučuje častější monitorování hodnoty mezinárodního normalizovaného poměru (international normalised ratio, INR).
Podávání liraglutidu nevyžaduje úpravu dávkování paracetamolu, atorvastatinu, griseofulvinu, digoxinu, lisinoprilu a perorálních antikoncepčních prostředků.
Dávkování
Liraglutid se podává jedenkrát denně, pokud možno vždy ve stejnou dobu, jako podkožní injekce do břicha, stehna nebo do horní části paže. Léčba se zahajuje denní dávkou 0,6 mg v prvním týdnu. V dalších týdnech se zvyšuje vždy o 0,6 mg, tudíž v pátém týdnu je dosaženo cílové denní dávky 3,0 mg. Ta by se neměla překračovat. Postupné zvyšování dávky zlepšuje gastrointestinální snášenlivost. Pokud není zvyšování dávky během dvou po sobě následujících týdnů dobře snášeno, doporučuje se zvážit ukončení léčby. Ukončení léčby doporučujeme u obézních pacientů bez diabetu 2. typu, jestliže nedocílí během tří měsíců snížení hmotnosti o 5 % a více, a u diabetiků, nedojde‑li u nich během tří měsíců ke snížení hmotnosti o 3 % a více.
Perspektivy léčby antiobezitiky
Předpokladem účinné léčby obezity je bezpochyby nutnost, aby obezita začala být vnímána jak zdravotníky, tak veřejností jako komplexní onemocnění s významnou hereditární složkou, a nikoliv pouze jako „onemocnění životního stylu“ (lifestyle disease). I když úprava životního stylu zůstává pilířem léčby obezity, dá se předpokládat, že u řady pacientů bude nutné dlouhodobé, mnohdy celoživotní podávání antiobezitik s cílem upravit metabolickou či regulační poruchu, která se uplatňuje v patogenezi obezity. Redukční režim včetně farmakoterapie by měl zohledňovat věk, pohlaví, stupeň obezity, individuální zdravotní rizika, metabolické a psychobehaviorální charakteristiky obézního jedince, jakož i úspěšnost předchozích pokusů o zhubnutí [43]. Dlouhodobé studie provedené u adekvátních cílových populací by měly ověřit účinnost antiobezitik s ohledem na morbiditu a mortalitu. Zároveň je třeba mít na mysli, že farmakoterapie obezity by měla být směrována spíše na obézní jedince mladšího a středního věku s cílem předcházet závažným kardiometabolickým rizikům než na starší pacienty s již existujícími závažnými kardiovaskulárními chorobami.
Je si třeba uvědomit, že žádný zdravotní systém není schopen poskytnout péči všem pacientům s obezitou. Systém multidisciplinární diferencované komplexní péče o obézní pacienty by měl zahrnovat síť center pro diagnostiku a léčbu obezity, center bariatrické a metabolické chirurgie, obezitology, ostatní specialisty (jak lékaře, tak nutriční terapeuty/dietology, fyzioterapeuty a psychology), praktické lékaře, redukční kluby a rovněž sofistikovaná interaktivní školení prostřednictvím internetu [2,43]. Tento systém by měl zajistit i to, aby se antiobezitika dostala jen do rukou vyškolených lékařů, kteří budou zodpovídat za adekvátní preskripci u indikovaných pacientů [5,44].
Podpořeno projektem (Ministerstva zdravotnictví ČR) koncepčního rozvoje výzkumné organizace 00023761 (Endokrinologický ústav, Praha).
Seznam použité literatury
- [1] EPAR aj. Saxenda (23. 3. 2015) http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR__Product_Information/human/003780/WC500185786.pdf.
- [2] Tsigos C, Hainer V, Basdevant A, et al. Obesity Management Task Force of the European Association for the Study of Obesity. Management of obesity in adults: European clinical practice guidelines. Obes Facts 2008; 1: 106–116.
- [3] Yumuk V, Fruhbeck G, Oppert JM, et al. An EASO position statement on multidisciplinary obesity management in adults. Obes Facts 2014; 7: 96–101.
- [4] Jensen MD, Ryan DH, Donato KA, et al. 2013 AHA/ACC/TOS guideline for the management of Overweight and obesity in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the Obesity Society. Obesity (Silver Spring) 2014; 22 (Suppl. 2): S5–S39.
- [5] Hainer V, Aldhoon Hainerová I. Do we need antiobesity drugs? Diabetes Metab Res Rev 2012; 28 (Suppl 2): 8–20.
- [6] Hainer V. Overview of new antiobesity drugs. Expert Opin Pharmacother 2014; 15: 1975–1978.
- [7] Malm Erjefält M, Bjornsdottir I, Vanggaard J, et al. Metabolism and excretion of the once daily human glucagon like peptide 1 analog liraglutide in healthy male subjects and its in vitro degradation by dipeptidyl peptidase IV and neutral endopeptidase. Drug Metab Dispos 2010; 38: 1944–1953.
- [8] Parker HE, Gribble FM, Reimann F. The role of gut endocrine cells in control of metabolism and appetite. Exp Physiol 2014; 99: 116–1120.
- [9] Cho YM, Fujita Y, Kieffer TJ. Glucagon like peptide 1: glucose homeostasis and beyond. Annu Rev Physiol 2014; 76: 535–559.
- [10] Ezcurra M, Reimann F, Gribble FM, Emery E. Molecular mechanisms of incretin hormone secretion. Curr Opin Pharmacol 2013; 13: 922–927.
- [11] Ohlsson L, Alsalim W, Carr RD, et al. Glucose lowering effect of the DPP 4 inhibitor sitagliptin after glucose and non glucose macronutrient ingestion in non diabetic subjects. Diabetes Obes Metab 2013; 15: 531–537.
- [12] de Heer J, Rasmussen C, Coy DH, Holst JJ. Glucagon like peptide 1, but not glucose dependent insulinotropic peptide, inhibits glucagon secretion via somatostatin (receptor subtype 2) in the perfused rat pancreas. Diabetologia 2008; 51: 2263–2270.
- [13] Abbott CR, Monteiro M, Small CJ, et al. The inhibitory effects of peripheral administration of peptide YY3 36 and glucagon like peptide 1 on food intake are attenuated by ablation of the vagal brainstem hypothalamic pathway. Brain Res 2005; 1044: 127–131.
- [14] Dickson SL, Shirazi RH, Hansson C, et al. The glucagon like peptide 1 (GLP 1) analogue, exendine 4, decreases the rewarding value of food: A new role for mesolimbic GLP 1 receptors. J Neuroscience 2012; 32: 4812–4820.
- [15] Reddy IA, Stanwood G, Galli A. Moving beyond energy homeostasis: New roles for glucagon like peptide 1 in food and drug reward. Neurochem Int 2014; 73: 49–55.
- [16] Groeneveld ON, Kappelle LJ, Biessels GJ. Potentials of incretin based therapies in dementia and stroke in type 2 diabetes mellitus. J Diabetes Investig 2016; 7: 5–16.
- [17] Iepsen EW, Lundgren JR, Hartmann B, et al. GLP 1 receptor agonist treatment increases bone formation and prevents bone loss in weight reduced obese women. J Clin Endocrinol Metab 2015; 100: 2909–2917.
- [18] Cameron Vendrig A, Reheman A, Siraj MA. Glucagon like peptide 1 receptor activation attenuates platelet aggregation and thrombosis. Diabetes 2016 Mar 2 [Epub ahead of print].
- [19] Haluzík M. Praktická léčba diabetu pro internisty. Praha: Mladá fronta/Edice Aeskulap, 2. rozšířené vydání, 2015; 152 s.
- [20] Janíčková Žďárská D. Liraglutid. Remedia 2009; 19: 116–120.
- [21] Pelikánová T. Liraglutid. Remedia 2011; 21: 290–296.
- [22] Astrup A, Rossner S, Van Gaal L, et al. Effects of liraglutide in the treatment of obesity: a randomised, double blind, placebo controlled study. Lancet 2009; 374: 1606–1616.
- [23] Astrup A, Carraro R, Finer N, et al. Safety, tolerability and sustained weight loss over 2 years with the once daily human GLP 1 analog, liraglutide. Int J Obes (Lond) 2012; 36: 843–854.
- [24] Wadden TA, Hollander P, Klein S, et al. Weight maintenance and additional weight los with liraglutide after low calorie diet induced weight loss: The SCALE Maintenance randomized study. Int J Obes (Lond) 2013; 37: 1443–1451.
- [25] Pi Sunyer X, Astrup A, Fujioka K, et al. A randomized, controlled trial of 3.0 mg of liraglutide in weight management. N Engl J Med 2015; 373: 11–22.
- [26] Fujioka K, Greenway FL III, Lau DC, et al. Early weight loss responders to liraglutide 3.0 mg achieved greater weight loss and regression to normoglycemia, and reduced development of T2D, at 3 years versus early non responders in the Scale Obesity and Prediabetes Trial. The 98th Annual Meeting of The Endocrine Society, Boston, April 2, 2016: Abstract No. PP19–24.
- [27] Davies MJ, Bergenstal R, Bode B, et al. Efficacy of liraglutide for weight loss among patients with type 2 diabetes. The SCALE diabetes randomized clinical trial. JAMA 2015; 314: 687–699.
- [28] Blackman A, Foster GD, Zammit G, et al. Effect of liraglutide 3.0 mg in individuals with obesity and moderate or severe obstructive sleep apnea: The SCALE Sleep Apnea randomized clinical trial. Int J Obes (Lond) 2016; Mar 23 [Epub ahead of print].
- [29] Gomez Peralta F, Abreu C, Castro JC, et al. An association between liraglutide treatment and reduction in excessive daytime sleepiness in obese subjects with type 2 diabetes. BMC Endocr Disord 2015; 15: 78.
- [30] Vgontzas AN, Papanicolaou DA, Bixler EO, et al. Sleep apnea and daytime sleepiness and fatigue: relation to visceral obesity, insulin resistance, and hypercytokinemia. J Clin Endocrinol Metab 2000; 85: 1151–1158.
- [31] Ard J, Cannon A, Lewis CE, et al. Efficacy and safety of liraglutide 3.0 mg for weight management are similar across races: subgroup analysis across the SCALE and phase II randomized trials. Diabetes Obes Metab 2016; 18: 430–435.
- [32] Lean ME, Carraro R, Finer N, et al. Tolerability of nausea and vomiting and associations with weight loss in a randomized trial of liraglutide in obese, non diabetic adults. Int J Obes (Lond) 2014; 38: 689–697.
- [33] Pi Sunyer X; SCALE Obesity and Prediabetes Investigators. Liraglutide in weight management. N Engl J Med 2015; 373: 1781–1782.
- [34] Keller J, Trautmann ME, Haber H, et al. Effect of exenatide on cholecystokinin induced gallbladder emptying in fasting healthy subjects. Regul Pept 2012; 179: 77–83.
- [35] Faillie JL, Azoulay L, Patenaude V, et al. Incretin based drugs and risk of acute pancreatitis in patients with type 2 diabetes: cohort study. BMJ 2014; 348: g2780.
- [36] Singh S, Chang HY, Richards TM, et al. Glucagon like peptide 1 based therapies and risk of hospitalization for acute pancreatitis in type 2 diabetes mellitus: a population based matched case control study. JAMA Intern Med 2013; 173: 534–539.
- [37] Egan AG, Blind E, Dunder K, et al. Pancreatic safety of incretin based drugs – FDA and EMA assessment. N Engl J Med 2014; 370: 794–797.
- [38] Scheen AJ. Pharmacokinetics and clinical use of incretin based therapies in patients with chronic kidney disease and type 2 diabetes. Clin Pharmacokinet 2015; 54: 1–21.
- [39] Kaakeh Y, Kanjee S, Boone K, Sutton J. Liraglutide induced acute kidney injury. Pharmacotherapy 2012; 32: e7–11.
- [40] Wilding JP, Overgaard RV, Jacobsen LV, et al. Exposure response analyses of liraglutide 3.0 mg for weight management. Diabetes Obes Metab 2016; Feb 2 [Epub ahead of print].
- [41] Monami M, Dicembrini I, Nardini C, et al. Effects of glucagon like peptide 1 receptor agonists on cardiovascular risk: a meta analysis of randomized clinical trials. Diabetes Obes Metab 2014; 16: 38–47.
- [42] Petrie JR. The cardiovascular safety of incretin based therapies: a review of the evidence. Cardiovasc Diabetol 2013; 12: 130.
- [43] Hainer V, Toplak H, Mitrakou A. Treatment modalities of obesity. What fits whom? Diabetes Care 2008; 31(Suppl 2): S269–S277.
- [44] Dvorak RV, Sharma AM, Astrup A. Antiobesity drugs: to be or not to be? Obes Rev 2010; 11: 833–834.