Lonoctocog alfa (Afstyla) ‒ nový lék pro substituci FVIII u nemocných s hemofilií A
Souhrn:
Kvasnička J. Lonoctocog alfa (Afstyla) ‒ nový lék pro substituci FVIII u nemocných s hemofilií A. Remedia 2019; 29: 386–392.
Lonoctocog alfa (rVIII‑SingleChain; Afstyla) je nová molekula rekombinantního koagulačního faktoru VIII (rFVIII) vykazující v klinické studii programu AFFINITY vynikající hemostatickou účinnost a příznivý bezpečnostní profil u dětí mladších 12 let a u dospělých trpících těžkou hemofilií A. V neklinických modelech měla jednořetězcová molekula lonoctocogu alfa vyšší afinitu k von Willebrandovu faktoru než rFVIII s plnou délkou a vykazovala také další příznivé farmakokinetické/farmakodynamické vlastnosti.
Summary:
Kvasnicka J. Lonoctocog alpha (Afstyla) ‒ new drug for substitution FVIII in patients with haemophilia A. Remedia 2019; 29: 386–392.
Lonoctocog alfa (rVIII‑SingleChain; Afstyla) is a novel rFVIII molecule showing excellent hemostatic efficacy and a favorable safety profile in a clinical study of the AFFINITY programme in children <12 years of age and in adults with severe haemophilia A. Recombinant FVIII‑SingleChain molecule (lonoctocog alpha) had a higher affinity for von Willebrand factor than full‑length recombinant FVIII and displayed other favourable pharmacokinetic/pharmacodynamic properties in non‑clinical models, too.
Key words: lonoctocog alfa, Afstyla, haemophilia A, prophylaxis, perioperative care
Farmaceutický výrobce CSL Behring
GmbH (Marburg, Německo) uvádí nyní další inovativní přípravek
pro léčbu hemofilie A. Je to první jednořetězcový
(single chain, SC) rekombinantní koagulační faktor VIII
(rFVIII; CSL627), který má proti dosud používanému
rekombinantnímu přípravku FVIII octocog alfa výhodnější
farmakokinetický profil (delší eliminační poločas, nižší
clearance a větší plochu pod křivkou [AUC]) [1]. Tato
jedinečná SC molekula rFVIII má totiž vyšší afinitu k von
Willebrandovu faktoru, který je plazmatickým nosičem FVIII.
V krevním oběhu je tím dosaženo vyšší stability
lonoctocogu alfa [2]. O von Willebrandově faktoru je také
známo, že při své vazbě s FVIII snižuje jeho imunogenicitu
[3] a chrání FVIII před endocytózou dendritickými buňkami,
které patří mezi hlavní antigen prezentující buňky imunitního
systému [4,5]. To by pak při léčbě přípravkem Afstyla mohlo
teoreticky snížit i tvorbu protilátek proti FVIII, což by
při dlouhodobé léčbě nemocných s hemofilií A znamenalo
značnou výhodu [6], včetně možnosti prodloužení intervalů
intravenózní terapie při profylaxi krvácení [7].
Afstyla patří do farmakoterapeutické skupiny antihemoragika ‒ Koagulační faktor VIII. ATC kód: B02BD02 [8]. Obsahuje rekombinantní jednořetězcový lidský koagulační faktor VIII (rFVIII SC) produkovaný v buňkách vaječníků čínského křečka. Při jeho výrobě byla odstraněna podstatná část B domény, vyskytující se v přirozeném FVIII s úplnou délkou, a navíc i čtyři aminokyseliny sousedící kyselé domény a3 (aminokyseliny od 765 do 1 652 plné délky FVIII). Nově vytvořená vazba těžkého a lehkého řetězce FVIII pak představuje nové N glykosylační místo. Vzhledem k tomu, že místo štěpení furinem přítomné v přirozeném FVIII mezi B doménou a doménou a3 bylo odstraněno, je přípravek Afstyla prezentován jako molekula FVIII s jedním řetězcem. Účinnost se určuje pomocí chromogenní metody Evropského lékopisu. Specifická aktivita přípravku Afstyla je 7 400‒16 000 IU/mg/protein.
Léková forma přípravku Afstyla
Přípravek Afstyla je jako prášek a rozpouštědlo pro injekční roztok registrován v sedmi léčebných silách: AFSTYLA 250 IU, 500 IU, 1 000 IU, 1 500 IU, 2 000 IU, 2 500 IU, 3 000 IU prášek a rozpouštědlo pro injekční roztok. Na našem trhu nemusejí být všechny uvedené koncentrace k dispozici [8].
Terapeutické indikace přípravku
Astyla
Léčba a profylaxe krvácení u pacientů s hemofilií A (vrozený nedostatek FVIII).
Přípravek Afstyla je zde indikován k léčbě všech věkových skupin.
Dávkování a způsob podání
přípravku Afstyla
Léčba musí být pod dohledem lékaře, který má zkušenosti s léčbou hemofilie.
Monitorování léčby
Během léčby se doporučuje provádět příslušné stanovení koncentrací FVIII, aby se určila velikost dávky, která se má podat, a frekvence podávání opakovaných injekcí. Odpověď jednotlivých pacientů na podání FVIII se může lišit, což se projeví různými biologickými poločasy a recovery. U pacientů s nízkou hmotností nebo u pacientů s nadváhou je třeba dávku odvodit dle jejich tělesné hmotnosti.
V případě velkých chirurgických zákroků je nezbytné laboratorní sledování pomocí koagulačního testu, kdy se stanovuje aktivita FVIII v krevní plazmě léčeného pacienta.
U nemocných léčených přípravkem Afstyla se má aktivita FVIII v krevní plazmě sledovat pomocí chromogenního testu nebo jednostupňového testu srážení. Výsledky pak slouží ke stanovení podávaných dávek a frekvence opakovaných injekcí. Při vyšetření má přednost provádění testů s chromogenním substrátem [8‒10]. Provedení jednostupňového testu totiž aktivitu FVIII ve srovnání s výsledkem chromogenního testu snižuje přibližně o 45 %. Při použití jednostupňového testu ke stanovení aktivity FVIII je proto třeba výsledek vynásobit konverzním faktorem 2.
Upozornění: Při použití jednostupňového testu in vitro stanovení aktivity FVIII, který vychází z aktivovaného tromboplastinového času (aPTT), mohou být výsledky aktivity FVIII v plazmě významně ovlivněny i typem činidla aPTT a referenčním standardem použitým v testu. K tomu může dojít zejména tehdy, pokud se změní laboratoř, která test provádí, nebo při změně činidel použitých v testu.
Dávkování přípravku Afstyla
Dávka a délka substituční léčby závisí na závažnosti nedostatku FVIII, na místě a rozsahu krvácení a na klinickém stavu pacienta.
Počet jednotek podávaného FVIII se vyjadřuje v mezinárodních jednotkách (IU), které odpovídají aktuálnímu standardu Světové zdravotnické organizace (World Health Organization, WHO) pro přípravky obsahující FVIII. Aktivita FVIII v plazmě se vyjadřuje v procentech (v poměru k normální lidské plazmě) nebo přednostně v mezinárodních jednotkách (v poměru k mezinárodnímu standardu pro FVIII v plazmě). Jedna IU aktivity FVIII pak odpovídá množství FVIII v jednom mililitru normální lidské plazmy. Účinnost se zde stanoví chromogenním substrátovým testem.
Koncentrace FVIII v plazmě pacienta lze pak sledovat pomocí chromogenního substrátového testu nebo jednostupňového testu srážení (uvedeno výše) [8].
Léčba podle potřeby (tzv. on demand)
Výpočet požadované dávky FVIII vychází z empirického zjištění, že 1 IU FVIII na kg tělesné hmotnosti zvýší aktivitu FVIII v plazmě o 2 IU/dl.
Požadovaná dávka se stanoví pomocí následujícího vzorce: Dávka (IU) = tělesná hmotnost (kg) × požadované zvýšení FVIII (IU/dl nebo % normálu) × 0,5 (IU/kg na IU/dl)
Množství přípravku, které se má podat, a četnost podávání je pak v jednotlivých případech třeba určit vždy podle jeho klinické účinnosti.
V případě krvácivých příhod
by však aktivita FVIII neměla v daném období klesnout pod
určenou hodnotu plazmatické aktivity (v % normálu nebo
IU/dl). Jako návod na dávkování při epizodách krvácení
nebo při chirurgickém zákroku lze použít tabulku 1.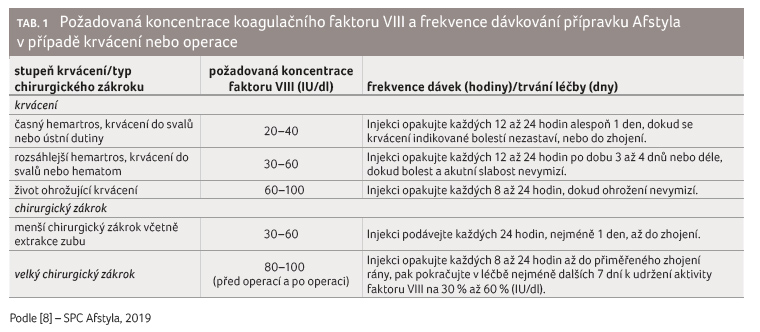
Profylaxe krvácení
Doporučený počáteční režim dávkování přípravku Afstyla je 20‒50 IU/kg podávaných dvakrát až třikrát týdně. Dávkování se může upravit na základě odpovědi pacienta.
Pediatrická
populace
Doporučený počáteční režim dávkování přípravku Afstyla u dětí (ve věku 0 až < 12 let) je 30‒50 IU/kg podávaných dvakrát až třikrát týdně. U dětí mladších 12 let se mohou požadovat častější nebo vyšší dávky zohledňující vyšší clearance v této věkové skupině. Pro dospívající ve věku 12 let a starší je doporučené dávkování stejné jako pro dospělé.
Starší pacienti
Klinické studie přípravku Afstyla nezahrnují pacienty starší než 65 let.
Poznámka: Bezpečnost a účinnost přípravku Afstyla nebyla také stanovena u dosud neléčených pacientů. Nejsou k dispozici žádné údaje.
Způsob podání přípravku Afstyla
Přípravek je určen pro intravenózní podání. Rekonstituovaný přípravek se má podávat pomalou injekcí rychlostí, která vyhovuje pacientovi, avšak maximálně v dávce 10 ml/min.
Farmakologické vlastnosti přípravku
Afstyla
Farmakodynamické vlastnosti
Komplex FVIII/von Willebrandova faktoru se skládá ze dvou molekul s různými fyziologickými funkcemi. Při podávání infuzí pacientovi s hemofilií se FVIII váže na von Willebrandův faktor v pacientově krevním oběhu. Aktivovaný FVIII působí jako kofaktor pro aktivovaný FIX urychlující konverzi FX na aktivovaný FX. Aktivovaný FX přeměňuje protrombin na trombin. Trombin pak přeměňuje fibrinogen na fibrin a může se vytvořit krevní sraženina (obr. 1).
Hemofilie A je dědičná porucha srážení krve vázaná na chromozom X. Je způsobena sníženými koncentracemi FVIII a má za následek velmi hojné krvácení do kloubů, svalů nebo vnitřních orgánů, které vzniká buď spontánně, nebo jako důsledek úrazu nebo chirurgického zákroku. Substituční léčbou se zvýší koncentrace FVIII v plazmě, čímž se dočasně upraví deficit faktoru a sklon ke krvácení.
Klinická účinnost a bezpečnost přípravku Afstyla
a) Dospělí a dospívající ve věku 12‒65 let
Studie CSR 1001 určovala účinnost a bezpečnost v prevenci krvácivých příhod, v profylaxi, v hemostatické účinnosti při kontrole krvácivých příhod a během perioperačního řízení. Do studie bylo zařazeno 175 dříve léčených pacientů (ve věku 12‒65 let) s těžkou hemofilií A (1 pacient starší než 60 let byl přijat), kteří byli účinku jednořetězcového rVIII vystaveni celkem 14 306 dnů. U žádného pacienta se nevytvořil inhibitor ani se nevyskytla anafylaktická reakce.
Profylaxe: 146 pacientů bylo zařazeno do skupiny podstupující profylaktické léčebné režimy (medián průměrné celkové roční míry krvácení [ABR] 1,14 [mezikvartilový rozsah 0,0‒4,2]), 79 pacientů (54 %) bylo zařazeno do skupiny s léčebným režimem třikrát týdně a 47 pacientů (32 %) do skupiny s léčebným režimem dvakrát týdně. Nemocní ve skupině s profylaxí dvakrát a třikrát týdně měli určenou střední dávku 35 IU/kg a 30 IU/kg na injekci, resp. průměrná roční spotřeba ve všech režimech profylaxe byla 4 283 IU/kg za rok.
Léčba krvácení: z 848 událostí krvácení pozorovaných ve studii 1001 bylo 93,5 % léčeno podáním dvou nebo méně injekcí. Střední hodnota dávky pro léčbu epizody krvácení byla 34,7 IU/kg.
Perioperační léčba (chirurgická profylaxe): ve studii 1001 se celkově provedlo a vyhodnotilo 16 velkých chirurgických zákroků u 13 osob. Hemostatická účinnost jednořetězcového rVIII v chirurgické profylaxi byla hodnocena jako vynikající nebo dobrá u všech chirurgických zákroků. Žádní pediatričtí pacienti mladší 18 let nebyli zahrnuti do chirurgické profylaxe.
b) Pediatrická populace ve věku vyšším než 12 let
Do studie CSR 3002 bylo zařazeno celkem 84 dříve léčených pacientů mladších 12 let (35 mladších 6 let a 49 pacientů ve věku 6 až < 12 let). Účastníci studie byli účinku jednořetězcového rVIII vystavováni celkem 5 239 dní. U žádného z pacientů nebyla pozorována tvorba inhibitorů ani se nevyskytla anafylaktická reakce.
Individualizovaná profylaxe: z 81 pacientů ve skupině s profylaxí (medián ABR 3,69 [mezikvartilový rozsah 0,00‒7,20]) mělo 43 pacientů (53 %) určený léčebný režim dvakrát týdně a 25 pacientů (31 %) léčebný režim třikrát týdně. Nemocným s profylaxí dvakrát a třikrát týdně byly přiřazeny dávky s mediánem 35 IU/kg a 32 IU/kg v jedné injekci, resp. s průměrnou roční spotřebou v rámci všech režimů profylaxe 4 109 IU/kg za rok.
Léčba krvácení: z 347 událostí krvácení pozorovaných ve studii 3002 bylo 95,7 % léčeno podáním jednořetězcového rVIII přípravku Afstyla dvěma nebo méně injekcemi. Střední hodnota celkové dávky pro léčbu události krvácení byla 27,6 IU/kg.
Poznámka k pediatrické populaci: Evropská léková agentura (EMA) udělila výjimku z povinnosti předložit výsledky studií s přípravkem Afstyla u dříve neléčených pediatrických pacientů v léčbě dědičného deficitu FVIII.
Farmakokinetické vlastnosti
a) Dospělí
Farmakokinetika jednořetězcového rVIII přípravku Afstyla byla hodnocena u 81 dříve léčených dospělých pacientů ve věku 18‒60 let s diagnostikovanou těžkou hemofilií A s méně než 1 % FVIII po intravenózní injekci 50 IU/kg.
Farmakokinetické parametry byly založeny na aktivitě FVIII v plazmě měřené chromogenním substrátovým testem. Farmakokinetický profil získaný 3‒6 měsíců po počátečním hodnocení farmakokinetiky byl srovnatelný s farmakokinetickým profilem získaným po první dávce.
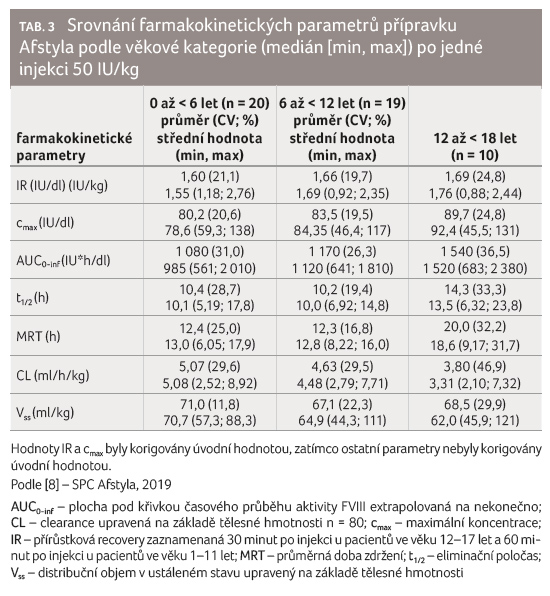
Farmakokinetické parametry po jedné
injekci 50 IU/kg přípravku Afstyla ‒ chromogenní substrátový
test ‒ jsou uvedeny v tabulce 2.
b) Pediatrická populace
Farmakokinetika jednořetězcového rVIII přípravku Afstyla byla hodnocena u 10 dříve léčených dospívajících pacientů (ve věku 12 až < 18 let) a u 39 dříve léčených dětí (ve věku 0 až < 12 let) po intravenózní injekci jedné dávky 50 IU/kg. Všichni pacienti měli diagnostikovánu závažnou hemofilii A s méně než 1 % FVIII.
Farmakokinetické parametry byly opět založeny na aktivitě FVIII v plazmě měřené chromogenním substrátovým testem. Porovnání farmakokinetických parametrů podle věkové kategorie po jedné injekci 50 IU/kg přípravku Afstyla ‒ chromogenní substrátový test ‒ jsou uvedeny v tabulce 3 [8,11–13].
Kontraindikace přípravku Afstyla
Hypersenzitivita na léčivou látku nebo na kteroukoliv pomocnou látku v přípravku nebo známá alergická reakce na proteiny křečka.
Zvláštní upozornění a opatření pro obecné použití přípravku Afstyla
a) Hypersenzitivita
U přípravku Afstyla se může vyskytnout hypersenzitivita alergického typu. Přípravek obsahuje stopy proteinů křečka. Pacienti musejí být poučeni, aby v případě výskytu příznaků hypersenzitivity okamžitě přestali používat tento přípravek a kontaktovali svého lékaře. Pacienti by měli být informováni o počátečních projevech reakcí včetně kopřivky, generalizované kopřivky, pocitu tísně na hrudi, sípání, hypotenze a anafylaxe.
U pacientů s předchozími hypersenzitivními reakcemi je třeba zvážit premedikaci. V případě šoku je třeba dodržovat standardní lékařskou léčbu šoku.
b) Inhibitory FVIII
Tvorba neutralizujících protilátek (inhibitorů) FVIII je známou komplikací léčby jedinců s hemofilií A. Tyto inhibitory jsou obvykle imunoglobuliny IgG zaměřené proti prokoagulační aktivitě FVIII, které jsou kvantifikovány v Bethesda jednotkách (Bethesda units, BU) na mililitr plazmy pomocí modifikovaného testu. Riziko vzniku inhibitorů souvisí se závažností onemocnění i s expozicí FVIII, přičemž toto riziko je nejvyšší během prvních 20 dnů expozice. Vzácně mohou inhibitory vzniknout po prvních 100 dnech expozice.
Po převedení dříve léčených pacientů s více než 100 dny expozice a vznikem inhibitorů v předchozí anamnéze z jednoho přípravku FVIII na jiný byly zaznamenány případy rekurence inhibitorů (nízkého titru). Proto se po záměně jakéhokoliv přípravku doporučuje u těchto pacientů sledovat, zda se u nich inhibitory znovu neobjeví.
Klinický význam vzniku inhibitorů pak bude záviset na titru inhibitoru, přičemž inhibitory nízkého titru, které jsou krátkodobě přítomny nebo zůstávají trvale na nízkém titru, představují menší riziko nedostatečné klinické odpovědi než inhibitory vysokého titru.
Obecně platí, že všichni pacienti léčení přípravky s FVIII musejí být s ohledem na vznik inhibitorů pečlivě klinicky i laboratorně monitorováni. Pokud není dosaženo očekávaných hodnot aktivity FVIII v plazmě nebo pokud není krvácení patřičnou dávkou zvládnuto, je třeba provést test na přítomnost inhibitoru FVIII. U pacientů s vysokými hodnotami inhibitoru nemusí být terapie FVIII účinná a je třeba zvážit jiné možnosti léčby. Terapie takových pacientů má být vedena lékaři se zkušenostmi v péči o nemocné s hemofilií a s inhibitory FVIII.
c) Kardiovaskulární příhody
U pacientů s existujícími kardiovaskulárními rizikovými faktory může substituční léčba FVIII zvyšovat kardiovaskulární riziko.
d) Komplikace související s katétrem
Pokud je vyžadováno zařízení pro centrální žilní přístup (central venous access device, CVAD), musí se zvážit riziko komplikací souvisejících se CVAD včetně lokálních infekcí, bakteriemie a trombózy v místě zavedení katétru.
e) Obsah sodíku
Tento přípravek obsahuje až 7 mg (0,3 mmol) sodíku na mililitr po rekonstituci. To je nutné vzít v úvahu u pacientů s dietou s kontrolovaným příjmem sodíku.
f) Záznam o použití
Při každé aplikaci přípravku Afstyla pacientovi se důrazně doporučuje zaznamenat název a číslo šarže přípravku, aby se udržovaly záznamy o propojení mezi nemocným a šarží přípravku.
g) Pediatrická populace
Uvedená upozornění a opatření se vztahují na dospělé i děti.
Fertilita, těhotenství a kojení
Vzhledem ke vzácnému výskytu hemofilie A u žen nejsou k dispozici zkušenosti s podáváním FVIII během těhotenství a kojení. Z toho důvodu se má FVIII používat během těhotenství a kojení pouze v tom případě, je li to jasně indikováno.
Nežádoucí účinky přípravku
Afstyla
Při používání přípravků s obsahem FVIII byly vzácně pozorovány hypersenzitivní reakce nebo alergické reakce (zahrnující angioedém, pálení a píchání v místě vpichu, zimnici, návaly horka, generalizovanou kopřivku, bolest hlavy, vyrážku, hypotenzi, letargii, nauzeu, neklid, tachykardii, pocit tísně na hrudi, parestezie, zvracení, sípot), jež v některých případech mohou vést k závažné anafylaxi (včetně šoku).
K rozvoji neutralizujících protilátek (inhibitorů) může dojít u pacientů s hemofilií A, kteří jsou léčeni FVIII, včetně přípravku Afstyla. Pokud se takové inhibitory objeví, projeví se tento stav jako nedostatečná klinická odpověď. V těchto případech se doporučuje kontaktovat specializované hemofilické centrum.
Seznam nežádoucích účinků je
uveden v tabulce 4.
Frekvence vychází ze studií se všemi přípravky s faktorem
VIII, které zahrnovaly pacienty se závažnou hemofilií A.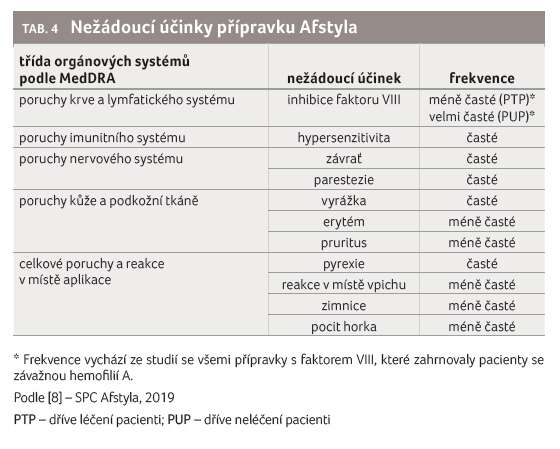
Inkompatibility
Studie kompatibility nejsou k dispozici, a proto nesmí být tento léčivý přípravek mísen s jinými léčivými přípravky nebo roztoky.
Závěr
Afstyla je účinným lékem, který je možný s úspěchem podávat u dětí, adolescentů i u dospělých pacientů s těžkou formou hemofilie A jak k léčbě krvácivých stavů, tak k účinné profylaxi krvácivých příhod. Teoretické předpoklady, že lze přípravek Afstyla při profylaxi podávat méně často nebo že jeho podávání bude provázeno nižším výskytem protilátek pro FVIII, budou nyní ověřovány v dalších kontrolovaných studiích [14].
Podpořeno grantem Institucionální podpora MZ ČR RVO – VFN 64165.
Seznam použité literatury
- [1] Klamroth R, Simpson M, von Depka‑Prondzinski M, et al. Comparative pharmacokinetics of rVIII‑SingleChain and octocog alfa (Advate®) in patients with severe haemophilia A. Haemophilia 2016; 22: 730‒738.
- [2] Pabinger‑Fasching I. The story of a unique molecule in hemophilia A: recombinant single‑chain factor VIII. Thromb Res 2016; 141(Suppl 3): S2‒4.
- [3] Hartholt RB, van Velzen AS, Peyron I, et al. To serve and protect: The modulatory role of von Willebrand factor on factor VIII immunogenicity. Blood Rev 2017; 31: 339‒347.
- [4] Kaveri SV, Dasgupta S, Andre S, et al. Factor VIII inhibitors: role of von Willebrand factor on the uptake of factor VIII by dendritic cells. Haemophilia 2007; 13(Suppl 5): 61‒64.
- [5] Dasgupta S, Repessé Y, Bayry J, et al. VWF protects FVIII from endocytosis by dendritic cells and subsequent presentation to immune effectors. Blood 2007; 109: 610‒612.
- [6] Lacroix‑Desmazes S, Repessé Y, Kaveri SV, Dasgupta S. The role of VWF in the immunogenicity of FVIII. Thromb Res 2008; 122(Suppl 2): S3‒6.
- [7] Raso S, Hermans C. Lonoctocog alfa (rVIII‑SingleChain) for the treatment of haemophilia A. Expert Opin Biol Ther 2018; 18: 87‒94.
- [8] SPC European Medicines Agency. AFSTYLA: EU assessment report, 2019. Dostupné na: http://www.ema.europa.eu/
- [9] St Ledger K, Feussner A, Kalina U, et al. International comparative field study evaluating the assay performance of AFSTYLA in plasma samples at clinical hemostasis laboratories. J Thromb Haemost 2018; 16: 555‒564.
- [10] Peyvandi F, Oldenburg J, Friedman KD, et al. A critical appraisal of one‑stage and chromogenic assays of factor VIII activity. J Thromb Haemost 2016; 14: 248‒261.
- [11] Stasyshyn O, Djambas Khayat C, Iosava G, et al. Safety, efficacy and pharmacokinetics of rVIII‑SingleChain in children with severe hemophilia A: results of a multicenter clinical trial. J Thromb Haemost 2017; 15: 636‒644.
- [12] AFFINITY CSL627_3002. Dostupné na: http://ClinicalTrials.gov
- [13] Mahlangu J, Kuliczkowski K, Karim FA, et al. Efficacy and safety of rVIII‑SingleChain: results of a phase 1/3 multicenter clinical trial in severe hemophilia A. Blood 2016; 128: 630–637.
- [14] Al‑Salama ZT, Scott LJ. Lonoctocog alfa: a review in haemophilia A. Drugs 2017; 77: 1677‒1686.