Metabolické účinky telmisartanu
Telmisartan patří do skupiny nekompetitivních reverzibilních antagonistů receptorů AT1 pro angiotenzin II, jež jsou používány jako metabolicky neutrální antihypertenziva. Podle nedávno publikovaných preklinických i klinických studií se nicméně zdá, že telmisartan v koncentracích dosahovaných při podávání běžných dávek v rámci léčby hypertenze vykazuje pozitivní metabolické účinky, které jsou zprostředkovány částečným selektivním agonistickým působením na PPAR- receptory (Peroxisome Proliferator-Activated Receptor-) [1]. Profil telmisartanu a detailní popis jeho farmakokinetických i farmakodynamických vlastností byl publikován před několika lety, cílem tohoto článku je shrnout nové poznatky o metabolických účincích léčiva.
PPAR -g a metabolický syndrom
PPAR-g je nukleární receptor, jemuž se přisuzuje klíčová role při regulaci metabolismu lipidů a cukrů, ale podílí se také na regulaci jiných fyziologických i patologických procesů v organismu, zejména na podkladě buněčné proliferace a zánětu [2]. Aktivace PPAR-g vede ke zvýšení transkripční aktivity regulovaných cílových genů, jejichž produkty jsou vlastními řídícími proteiny vyvolávajícími metabolické změny. Aktivátory PPAR-g jsou kromě hormonů, lipidů a vitaminů také xenobiotika nebo některá léčiva.
Základní metabolické důsledky aktivace PPAR-g se projevují diferenciací adipocytů, vychytáváním mastných kyselin a jejich oxidací adipocyty, retencí tekutin. Společně se tyto účinky projevují mimo jiné také vzestupem tělesné hmotnosti. Aktivace PPAR-g zvyšuje senzitivitu periferních tkání k inzulinu a také snižuje expresi genů mediátorů zánětu a vyvolává obecně antiproliferační účinky, což vede k protektivnímu efektu z hlediska aterogeneze a kancerogeneze. Růst některých nádorů s mutacemi v APC genu je ovšem paradoxně aktivací PPAR-g stimulován.
Význam PPAR-g pro udržování homeostázy glukózy a lipidů potvrzují rovněž genetické studie popisující vznik těžké hyperinzulinémie a metabolického syndromu v přítomnosti funkčně deficitních mutací nebo polymorfismů v tomto genu.
Dva selektivní aktivátory PPAR-g pioglitazon a rosiglitazon prokázaly v klinických studiích účinnost při zvyšování senzitivity k inzulinu a redukci hladiny mastných kyselin a triglyceridů v krvi za současného vzestupu hladiny HDL cholesterolu. Obě látky jsou v současné době používány při terapii diabetu 2. typu. Nevýhodou uvedených léčiv je, že thiazolidindionové přípravky mají jen omezený vliv na krevní tlak, a navíc mohou způsobovat nepříznivé nežádoucí účinky léčby v podobě vzestupu hmotnosti, otoků nebo projevů srdečního selhání. Tyto vedlejší účinky proto významně omezují možnosti jejich používání u pacientů s narušenou glukózovou tolerancí a u diabetiků s hypertenzí.
Telmisartan, aktivátor PPAR- g – preklinické zkušenosti
Telmisartan, antagonista angiotenzinu II s dobře dokumentovanou klinickou účinností při léčbě hypertenze, vykazuje podle nedávno publikovaných prací některé strukturní charakteristiky nezbytné pro aktivaci PPAR-g, díky nimž je také částečně homogenní se selektivními aktivátory PPAR-g pioglitazonem a rosiglitazonem. Počítačové simulace interakce telmisartanu s PPAR-g ukazují, že telmisartan je schopen interagovat s částí PPAR-g v oblasti domény vázající ligandy, a iniciovat tak aktivaci PPAR-g způsobem podobným jako u ostatních parciálních agonistů PPAR-g [3].
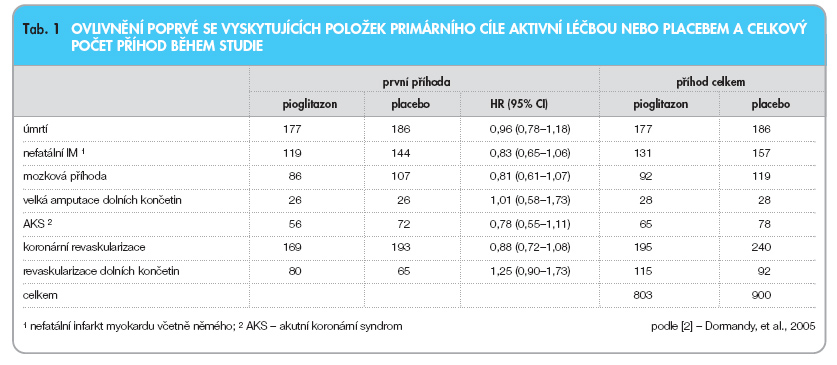
Výsledky studií in vitro tato modelová data podporují; telmisartan, na rozdíl od ostatních antagonistů angiotenzinu II, představuje látku s významným a pozorovatelným aktivačním účinkem PPAR-g [3, 4]. Mimo strukturní odlišnosti má telmisartan v porovnání s ostatními antagonisty angiotenzinu II podstatně větší zdánlivý distribuční objem, což ilustruje nejen extenzivní extravaskulární distribuci látky, ale může rovněž teoreticky znamenat lepší průnik této látky k jaderným receptorům PPAR-g. Rozdílná účinnost telmisartanu a ostatních antagonistů angiotenzinu II na PPAR-g tedy nemusí být způsobena jen strukturními odlišnostmi. Při koncentracích, které jsou běžné u pacientů během podávání telmisartanu v rámci terapie hypertenze, byla popsána aktivce PPAR-g, aniž by zároveň telmisartan aktivoval receptory PPAR-a nebo PPAR-d. Telmisartan byl proto klasifikován jako středně účinný selektivní aktivátor PPAR-g, přičemž ve srovnání s čistými agonisty PPAR-g thiazolidindionového typu dosahovala míra aktivace PPAR-g přibližně 25–30 % maximálního účinku pioglitazonu a rosiglitazonu [5]. Koncentrace, při kterých telmisartan dosahuje poloviny maximálního možného aktivačního účinku na PPAR-g, jsou přibližně 1,5 mmol/l a jsou přibližně trojnásobné oproti pioglitazonu. Pouze částečná aktivace PPAR-g a současné antagonistické působení na angiotenzin II může potenciálně vést k příznivějším klinickým účinkům telmisartanu v porovnání s čistými agonisty PPAR-g (tab. 1).
Antidiabetické účinky telmisartanu zprostředkované aktivací PPAR-g vedou u potkanů krmených stravou s vysokým obsahem tuků a uhlovodíků ke statisticky významnému poklesu glykémie, triglyceridémie, inzulinémie a tělesné hmotnosti ve srovnání se zvířaty kontrolní skupiny[1]. Podávání losartanu sice také vedlo k poklesu tělesné hmotnosti srovnatelnému s telmisartanem, ale sérové koncentrace glukózy, triglyceridů nebo inzulinu losartan neovlivňoval.
Telmisartan, aktivátor PPAR- g – klinické zkušenosti
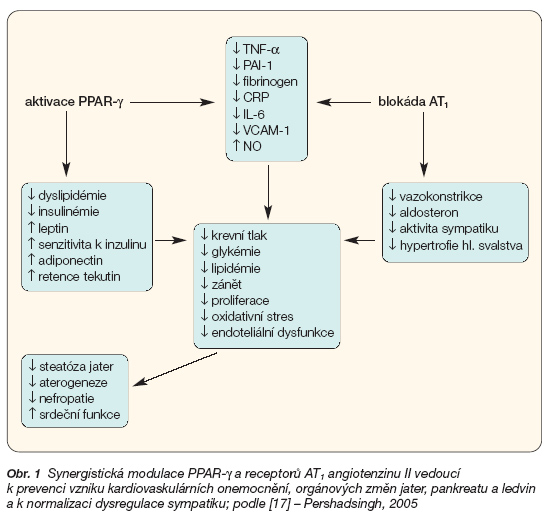
Klinických průkazů pozitivních metabolických účinků telmisartanu zprostředkovaných aktivací PPAR-g stále přibývá. Dosud publikované práce potvrzují preklinická data s ohledem na vliv telmisartanu na metabolismus glukózy a lipidů (obr. 1).
Klinické důkazy doposud sestávají z malého množství klinických studií a kazuistiky 52letého muže s metabolickým syndromem, u kterého po 8 týdnech podávání 80 mg telmisartanu denně klesly hladiny lipidů a glukózy na normální rozmezí [6]. Pacient byl poté převeden na léčbu valsartanem v dávce 160 mg denně. Při této terapii došlo po 6 týdnech k vzestupu glykémie a inzulinémie s opětovným návratem do normálního rozmezí po opětném převedení na léčbu telmisartanem 80 mg/den. Tento jednotlivý případ ilustruje pozitivní účinky telmisartanu u pacienta s metabolickým syndromem a ilustruje také absenci porovnatelného metabolického účinku valsartanu.
Postmarketingová observační studie zahrnující 3643 pacientů s diabetem 2. typu potvrdila příznivé metabolické účinky telmisartanu v dávkování 40–80 mg jedenkrát denně [7]. Průměrný pokles glykémie byl o 0,72 mmol/l a triglycidémie o 0,26 mmol/l po šesti měsících léčby ve srovnání s výchozími hodnotami.
Metabolické účinky telmisartanu dále potvrzují také dvě randomizované dvojitě zaslepené studie srovnávající účinky léčiva s eprosartanem a losartanem [5, 8]. V první studii byl 119 pacientům s diabetem 2. typu a hypertenzí podáván telmisartan v dávce 40 mg/den, nebo eprosartan 600 mg /den, nebo placebo. Po 12 měsících léčby byl ve skupině léčené telmisartanem pozorován pokles hladiny triglyceridů přibližně o 25–30 % ve srovnání s výchozí hodnotou, zatímco v eprosartanové a placebové skupině nedošlo k žádné změně hladiny lipidů.
Ve druhé srovnávací studii telmisartanu (80 mg/den) s losartanem (50 mg/den) u 40 pacientů s metabolickým syndromem došlo u pacientů léčených telmisartanem ke statisticky signifikantnímu poklesu sérových koncentrací glukózy, inzulinu i inzulinové rezistence. U pacientů léčených losartanem ke srovnatelným metabolickým změnám nedošlo.
Potenciální role v aterogenezi
Ve zvířecích modelech bylo popsáno, že selektivní aktivátory PPAR-g iniciují regresi aterosklerotických plátů [9–11]. V klinických studiích zabraňují aktivátory PPAR-g progresi aterosklerotických změn intimy a. carotis interna media, snižují hladiny markerů aktivace endoteliálních buněk i koncentrací reaktantů akutní fáze u pacientů s ICHS a/nebo metabolickým syndromem [12–15]. Telmisartan by mohl mít i tyto protektivní účinky díky selektivnímu působení na PPAR-g, ale jednoznačné průkazy antiaterogenního působení telmisartanu prozatím nejsou k dispozici. Zda telmisartan tyto teoretické předpoklady naplní, ukážou až další klinické studie.
Probíhající klinické studie
V současnosti probíhají velké klinické studie naplánované k posouzení potenciálních kardiovaskulárních a metabolických účinků telmisartanu. Jde o studii ONTARGET (ONgoing Telmisartan Alone and in combination with Ramipril Global Endpoint Trial) s paralelní větví nazvanou TRANSCEND (Telmisartan Randomized AssessmeNt Study in ACE-iNtolerant subjects with cardiovascular Disease) [16]. Tyto studie jsou naplánovány tak, aby popsaly účinky monoterapie nebo kombinační léčby telmisartanem a ramiprilem na kardiovaskulární a metabolické cílové parametry u rizikových pacientů s kardiovaskulárním onemocněním a/nebo diabetem s orgánovým postižením. Jedná se o největší komparativní studii provedenou s antagonisty angiotenzinu II, která zahrnuje také etnicky rozličné subpopulace pacientů. Do studie ONTARGET bylo zařazeno 25 620 pacientů, paralelní studie TRANSCEND je menší, zahrnuje 5926 pacientů. Zařazování pacientů bylo ukončeno v letech 2003 a 2004 a výsledky obou studií budou publikovány v roce 2007.
Závěr
Potenciální metabolické účinky telmisartanu jsou podporovány relativně novým pohledem na mechanismus účinku léčiva na PPAR-g. Terapeutický prospěch plynoucí z aktivace PPAR-g je známý u selektivních čistých agonistů oproti nimž ale může mít parciální agonismus ve spojení s antagonistickým účinkem angiotenzinu II významné výhody. Předpoklady i dosavadní klinické zkušenosti naznačují, že by telmisartan neměl způsobovat nežádoucí účinky vyvolané selektivní aktivací PPAR-g při zachovaném prospěšném metabolickém působení. Pokud se tyto předběžné klinické údaje potvrdí ve velkých klinických studiích, které nyní probíhají, mohl by se telmisartan stát významnou účinnou látkou v prevenci i terapii metabolického syndromu, diabetu a aterosklerózy.
Seznam použité literatury
- [1] Benson SC, Pershadsingh HA, Ho CI, et al. Identification of telmisartan as a unique angiotensin II receptor antagonist with selective PPAR--modulating activity. Hypertension 2004; 43: 993–1002.
- [2] Lehrke M, Lazar MA. The many faces of PPAR-. Cell 2005; 123: 993–999.
- [3] Marshall TG, Lee RE, Marshall FE. Common angiotensin receptor blockers may directly modulate the immune system via VDR, PPAR and CCR2b. Theor Biol Med Model 2006; 3: 1.
- [4] Fujimoto M, Masuzaki H, Tanaka T, et al. An angiotensin II AT1 receptor antagonist, telmisartan augments glucose uptake and GLUT4 protein expression in 3T3-L1 adipocytes. FEBS Lett 2004; 576: 492–497.
- [5] Kurtz TW. Treating the metabolic syndrome: telmisartan as a peroxisome proliferator-activated receptor- activator. Acta Diabetol 2005; 42 (Suppl 1): S9–16.
- [6] Pershadsingh HA, Kurtz TW. Insulin-sensitizing effects of telmisartan: implications for treating insulin-resistant hypertension and cardiovascular disease. Diabetes Care 2004; 27: 1015.
- [7] Michel MC, Bohner H, Koster J, et al. Safety of telmisartan in patients with arterial hypertension: an open-label observational study. Drug Saf 2004; 27: 335–344.
- [8] Derosa G, Ragonesi PD, Mugellini A, et al. Effects of telmisartan compared with eprosartan on blood pressure control, glucose metabolism and lipid profile in hypertensive, type 2 diabetic patients: a randomized, double-blind, placebo-controlled 12-month study. Hypertens Res 2004; 27: 457–464.
- [9] Inoue I, Katayama S. The possible therapeutic actions of peroxisome proliferator-activated receptor alpha (PPAR-) agonists, PPAR- agonists, 3-hydroxy-3-methylglutaryl coenzyme A (HMG-CoA) reductase inhibitors, angiotensin converting enzyme (ACE) inhibitors and calcium (Ca)-antagonists on vascular endothelial cells. Curr Drug Targets Cardiovasc Haematol Disord 2004; 4: 35–52.
- [10] Corti R, Osende JI, Fallon JT, et al. The selective peroxisomal proliferator-activated receptor- agonist has an additive effect on plaque regression in combination with simvastatin in experimental atherosclerosis: in vivo study by high-resolution magnetic resonance imaging. J Am Coll Cardiol 2004; 43: 464–473.
- [11] Levi Z, Shaish A, Yacov N, et al. Rosiglitazone (PPAR- agonist) attenuates atherogenesis with no effect on hyperglycaemia in a combined diabetes-atherosclerosis mouse model. Diabetes Obes Metab 2003; 5: 45–50.
- [12] Sidhu JS, Kaposzta Z, Markus HS, et al. Effect of rosiglitazone on common carotid intima-media thickness progression in coronary artery disease patients without diabetes mellitus. Arterioscler Thromb Vasc Biol 2004; 24: 930–934.
- [13] Sidhu JS, Cowan D, Tooze JA, et al. Peroxisome proliferator-activated receptor- agonist rosiglitazone reduces circulating platelet activity in patients without diabetes mellitus who have coronary artery disease. Am Heart J 2004; 147: e25.
- [14] Sidhu JS, Cowan D, Kaski JC. Effects of rosiglitazone on endothelial function in men with coronary artery disease without diabetes mellitus. Am J Cardiol 2004; 94: 151–156.
- [15] Wang TD, Chen WJ, Lin JW, et al. Effects of rosiglitazone on endothelial function, C-reactive protein, and components of the metabolic syndrome in nondiabetic patients with the metabolic syndrome. Am J Cardiol 2004; 93: 362–365.
- [16] Teo K, Yusuf S, Sleight P, et al. Rationale, design, and baseline characteristics of 2 large, simple, randomized trials evaluating telmisartan, ramipril, and their combination in high-risk patients: the Ongoing Telmisartan Alone and in Combination with Ramipril Global Endpoint Trial/Telmisartan Randomized Assessment Study in ACE Intolerant Subjects with Cardiovascular Disease (ONTARGET/TRANSCEND) trials. Am Heart J 2004; 148: 52–61.
- [17] Pershadsingh HA. Treating the metabolic syndrome using angiotensin receptor antagonists that selectively modulate peroxisome proliferator-activated receptor-. Int J Biochem Cell Biol 2005.
- [18] Doležal T. Telmisartanum. Remedia 2002; 2: 85–91.