Možnosti léčby karcinomu plic durvalumabem v roce 2021
Souhrn:
Bílek O. Možnosti léčby karcinomu plic durvalumabem v roce 2021. Remedia 2021; 31: 219–222.
Imunoterapie checkpoint inhibitory prokázala pozoruhodný přínos v léčbě řady onkologických diagnóz včetně karcinomu plic. Standardně je indikována léčba inhibitory PD‑1/PD‑L1 v monoterapii, jako kombinovaná imunoterapie s inhibitory CTLA‑4 nebo v kombinaci s jinými léčebnými modalitami, např. s chemoterapií či radioterapií. Tento článek si klade za cíl shrnout aktuální zkušenosti s durvalumabem v léčbě karcinomu plic.
Summary:
Bilek O. Treatment options for lung cancer with durvalumab in 2021. Remedia 2021; 31: x‑y.
Immunotherapy with check‑point inhibitors has demonstrated remarkable therapeutical benefits in many oncological diagnoses, including lung cancer. Treatment with PD‑1/PD‑L1 inhibitors can be indicated in various ways: as monotherapy, combination immunotherapy with CTLA‑4 inhibitors or in combination with other treatment modalities as chemotherapy or radiotherapy. The aim of this review is to summarize the clinical evidence for the use of durvalumab in lung cancer treatment.
Key words: non‑small cell lung cancer, small cell lung cancer, immunotherapy, durvalumab
Úvod
Karcinom plic představuje nejčastější příčinu úmrtí v souvislosti s nádorovým onemocněním [1]. Imunoterapie v posledních letech významně zlepšila výsledky léčby a stala se standardní součástí léčebného algoritmu. Checkpoint inhibitory CTLA 4 (cytotoxický T lymfocytární antigen 4, cytotoxic T lymphocyte antigen 4), PD 1 (membránový protein programované buněčné smrti, programmed cell death protein 1), PD L1 (ligand PD 1) prokázaly účinnost v léčbě skvamózních i neskvamózních nemalobuněčných nádorů plic (non small cell lung carcinoma, NSCLC) a také v léčbě malobuněčných nádorů plic (small cell lung carcinoma, SCLC) [2]. Průlomovým výsledkem je vyšší četnost dosažení dlouhodobé léčebné odpovědi, která může přetrvávat i po přerušení nebo předčasném ukončení léčby. Léčba checkpoint inhibitory je rovněž spojena s odlišným profilem nežádoucích účinků, které mohou být imunitně podmíněné a vyžadují včasné odhalení a zahájení léčby [3]. Tento článek si klade za cíl shrnout aktuální výsledky podávání durvalumabu v léčbě pacientů s karcinomem plic.
Výsledky klinických studií
Durvalumab v léčbě metastatického NSCLC – studie MYSTIC
Studie fáze III MYSTIC hodnotila účinnost durvalumabu v monoterapii nebo v kombinaci s anti CTLA 4 protilátkou tremelimumabem ve srovnání s chemoterapií [4]. Celkem bylo randomizováno 1 118 pacientů s metastatickým NSCLC s negativitou EGFR (receptor pro epidermální růstový faktor, epidermal growth factor receptor) a ALK (anaplastická lymfomová kináza) k léčbě durvalumabem v dávce 20 mg/kg podávané v intervalu čtyři týdny, dále k terapii durvalumabem 20 mg/kg v kombinaci s tremelimumabem 1 mg/kg každé čtyři týdny po dobu maximálně 4 cyklů a k chemoterapii s platinou. Primárním cílovým ukazatelem bylo celkové přežití (overall survival, OS) pacientů s hodnotou PD L1 TC (exprese PD L1 na nádorových buňkách) ≥ 25 %. Byl prokázán přínos durvalumabu v monoterapii nebo v kombinaci s tremelimumabem ve srovnání s chemoterapií, výsledky však nebyly statisticky signifikantní.
V roce 2019 byla zveřejněna explorativní analýza zahrnující vliv následné léčby. Překřížení (crossover) nebylo ve studii povoleno, avšak 95 (58,6 %) pacientů v rameni s chemoterapií absolvovalo následnou léčbu včetně imunoterapie. Po korekci dat prokázal durvalumab významné prodloužení přežití ve srovnání s chemoterapií (poměr rizik [hazard ratio, HR] 0,66; 97,54% interval spolehlivosti [confidence interval, CI] 0,49–0,90; p = 0,002) [5]. Další explorativní analýza zahrnovala vyšetření mutační nálože (tumour mutational burden, TMB) v krvi pacientů a vliv na OS. Hodnoceno bylo 70 % zařazených pacientů, 40 % z nich mělo vysokou hodnotu TMB, tj. ≥ 20 mut/Mb. U pacientů s vysokou TMB bylo dosaženo mediánu OS 16,5 měsíce při kombinované léčbě durvalumabem s tremelimumabem vs. 10,5 měsíce při léčbě chemoterapií. Při léčbě durvalumabem v monoterapii bylo OS 11 měsíců. U pacientů s nízkou TMB činil medián OS 8,5 měsíce při léčbě durvalumabem s tremelimumabem, 12,2 měsíce při léčbě durvalumabem a 11,6 měsíce při chemoterapii [6].
Durvalumab v léčbě NSCLC stadia III – studie PACIFIC
Multicentrická dvojitě zaslepená studie fáze III PACIFIC hodnotila efekt konsolidační léčby durvalumabem po standardní konkomitantní radioterapii a chemoterapii u pacientů s lokálně pokročilým inoperabilním NSCLC III. klinického stadia [7]. Zařazení pacienti absolvovali dva či více cyklů chemoterapie založené na platinovém derivátu konkomitantně s definitivní radioterapií v dávce 54−66 Gy. Bylo zařazeno 713 pacientů, kteří byli randomizováni v poměru 2 : 1 ve prospěch imunoterapie. Pokud nedošlo k progresi onemocnění, byla v horizontu 1−42 dní po ukončení chemoradioterapie zahájena konsolidační aplikace durvalumabu v dávce 10 mg/kg tělesné hmotnosti ve dvoutýdenním intervalu, nebo podávání placeba. Primární cílové ukazatele představovaly OS a přežití bez progrese onemocnění (progression free survival, PFS). Součástí studie bylo hodnocení exprese PD L1 v nádorové tkáni, stav exprese však neměl vliv na zařazení pacientů.
První interim analýza prokázala
prodloužení mediánu PFS (16,8 měsíce vs. 5,6 měsíce)
ve prospěch durvalumabu (HR 0,52; 95% CI 0,42–0,65; p < 0,001).
Dále vyšší celková míra odpovědi (overall response rate, ORR)
ve skupině s durvalumabem oproti skupině s placebem –
28,4 % vs. 16 % (p < 0,001). V této
analýze byl významně prodloužen čas do druhé progrese nebo
úmrtí ve skupině s durvalumabem (medián 28,3 měsíce
vs. 17,1 měsíce) [8]. Durvalumab však zejména přinesl významné
zlepšení OS [9]. V rámci čtyřletého sledování bylo
dosaženo mediánu OS 47,5 měsíce vs. 29,1 měsíce ve prospěch
durvalumabu (graf 1). Přínos durvalumabu byl zaznamenán bez
ohledu na použitý režim chemoterapie, dávku radioterapie
nebo dobu od radioterapie do randomizace [10]. Lepších
výsledků OS však dosahovali pacienti, u kterých byla léčba
durvalumabem zahájena již do dvou týdnů od ukončení
radioterapie [11]. Zlepšení sledovaných parametrů bylo
zaznamenáno u všech podskupin včetně pacientů s nízkou
expresí PD L1 [12].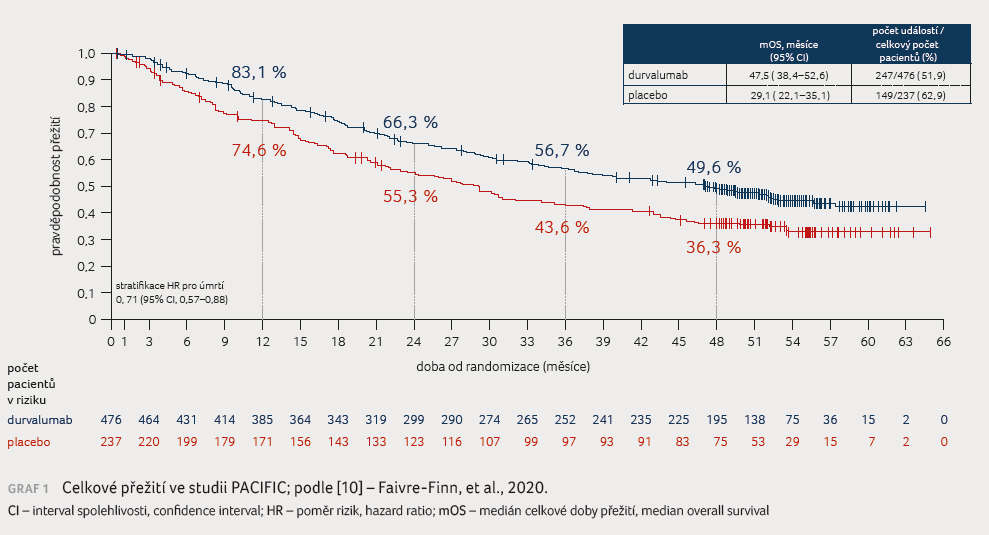
V roce 2020 však byla prezentována post hoc analýza s cílem posouzení vlivu exprese PD L1 na parametry PFS a OS. Ve skupině pacientů s TPS (tumour proportion score) ≥ 1 % bylo dosaženo mediánu PFS 23,9 měsíce vs. 5,6 měsíce (HR 0,49; 95% CI 0,36–0,66) ve prospěch durvalumabu. U pacientů s TPS < 1 % dosáhl medián PFS 10,7 měsíce vs. 5,6 měsíce ve prospěch durvalumabu (HR 0,79; 95% CI 0,53–1,19). V parametru OS byl zaznamenán významně lepší výsledek u pacientů s TPS ≥ 1 %‚ medián OS činil 57,4 měsíce versus 29,6 měsíce ve prospěch durvalumabu (HR 0,60; 95% CI 0,43–0,84), ve srovnání s pacienty TPS < 1 % ‚ kde medián OS dosáhl 33,9 měsíce vs. 43,0 měsíce ve prospěch placeba (HR 1,05; 95% CI 0,69–1,62) [13]. Studie PACIFIC byla primárně definována pro léčbu pacientů bez ohledu na expresi PD L1, u 37 % pacientů nebyla míra exprese známa. V rámci Evropy však byla schválena indikace konsolidační imunoterapie durvalumabem pro pacienty s expresí PD L1 TPS ≥ 1 % [14].
Durvalumab v léčbě SCLC – studie CASPIAN
CASPIAN je randomizovaná studie fáze
III srovnávající efekt imunoterapie v kombinaci se standardní
chemoterapií platina/etoposid (EP) u pacientů s diagnózou
SCLC v extendovaném stadiu onemocnění [16]. Pacienti byli
randomizováni do tří ramen;
durvalumab/tremelimumab/chemoterapie, durvalumab/chemoterapie
a samotná chemoterapie. V rámci první interim analýzy
nebylo dosaženo statisticky významného výsledku při léčbě
trojkombinací tremelimumab/durvalumab/EP, proto
byla následně hodnocena pouze dvojkombinace durvalumab/EP
ve srovnání s EP. Durvalumab byl podáván v dávce
1 500 mg každé tři týdny po dobu chemoterapie, následně
každé čtyři týdny do progrese onemocnění nebo
do neakceptovatelné toxicity. Pacienti, kteří podstoupili
radioterapii cílenou na oblast hrudníku, nebyli do studie
zařazeni. Primárním cílovým ukazatelem bylo OS, sekundárními
PFS, ORR a bezpečnost léčby.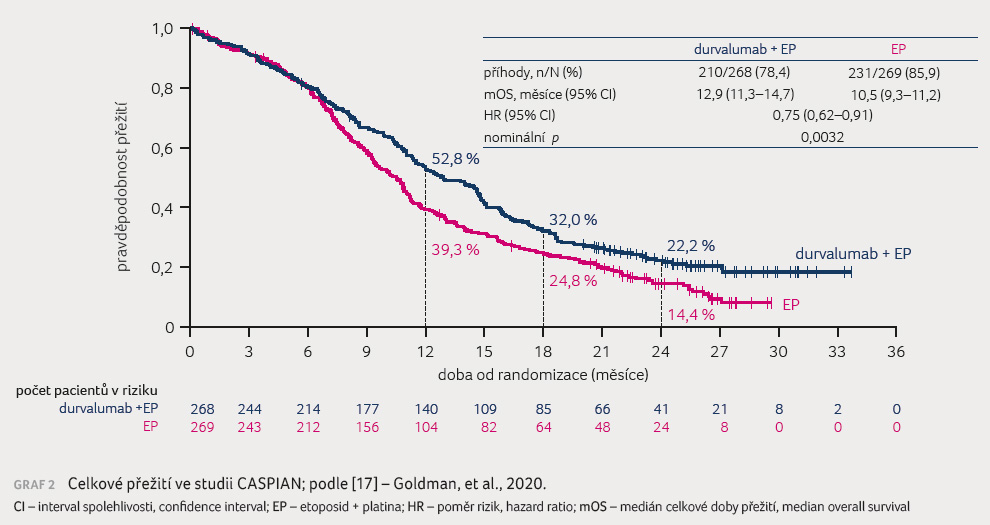
V rameni durvalumab/EP bylo dosaženo zlepšení ORR 68 % vs. 58 %. Medián doby trvání odpovědi (duration of response, DOR) byl 5,1 měsíce pro obě skupiny; trvání odpovědi po 12 měsících však bylo vyšší v rameni s léčbou kombinací durvalumab/EP, kde jej dosahovalo 23 %, oproti 6 % v rameni s EP. Medián PFS byl 5,1 měsíce v rameni durvalumab/EP vs. 5,4 měsíce v rameni EP. Křivky PFS se začaly oddělovat až po šesti měsících a po 12 měsících bylo PFS lepší v rameni durvalumab/EP oproti rameni s EP − 18 % vs. 5 % (HR 0,78; 95% CI 0,65–0,94). Medián OS dosáhl 12,9 měsíce vs. 10,5 měsíce ve prospěch imunoterapie. Přínos v parametru OS začal být rovněž patrný až po přibližně šesti měsících sledování, po 18 měsících přežívalo 32 % vs. 25 % pacientů (HR 0,75; 95% CI 0,62–0,91; p = 0,0035) a po 24 měsících 22,2 % vs. 14,4 % pacientů ve prospěch kombinace durvalumab/EP [17] (graf 2).
Durvalumab v klinické praxi
V České republice je od 1. ledna 2021 hrazena indikace léčby durvalumabem pro pacienty s NSCLC III. neoperabilního stadia s expresí PD L1 alespoň 1 % po ukončení konkomitantní chemoterapie. Léčba je hrazena do progrese onemocnění nebo do nepřijatelné toxicity nebo maximálně po dobu 12 měsíců [14]. Aplikace musí být zahájena do šesti týdnů od ukončení radioterapie, v rámci studie PACIFIC dosahovali lepších výsledků OS pacienti, u kterých byla léčba zahájena již do dvou týdnů od ukončení radioterapie [11]. Před zahájením je třeba provedení zobrazovacího vyšetření k vyloučení progrese onemocnění v průběhu léčby chemoradioterapií. Ve studii PACIFIC bylo standardní dávkování durvalumabu 10 mg/kg každé dva týdny. V následujících klinických studiích se osvědčila jednotná aplikace durvalumabu v dávce 1 500 mg každé čtyři týdny. V České republice je alternativní dávkování k dispozici od ledna 2021 [15].
U pacientů se SCLC a metastatickým NSCLC není léčba durvalumabem v současné době hrazena.
Závěr
Konsolidační léčba durvalumabem se stala standardní součástí léčebného algoritmu inoperabilního lokálně pokročilého NSCLC. Přináší první možnost konsolidační aplikace imunoterapie po aplikaci chemoradioterapie. Byly zaznamenány pozitivní výsledky léčby extendovaného stadia SCLC. Tolerance a bezpečnostní profil jsou příznivé, je nutná včasná diagnostika a léčba imunitně podmíněných nežádoucích účinků.
Seznam použité literatury
- [1] Dušek L, Mužík J, Kubásek M, et al. Epidemiologie zhoubných nádorů v České republice [online]. Masarykova univerzita 2005 [cit. 2021‑1‑30]. Dostupné na http://www.svod.cz.
- [2] Non‑small cell lung cancer. [Accessed January 30, 2021]. Dostupné na: https://www.nccn.org/professionals/physician_gls/pdf/nscl_blocks.pdf
- [3] Haanen J, Carbonnel F, Robert C, et al. Management of toxicities from immunotherapy: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow‑up. Ann Oncol 2018; 29(Suppl 4): iv264–iv266.
- [4] Rizvi NA, Cho BC, Reinmuth N, et al. Durvalumab With or Without Tremelimumab vs Standard Chemotherapy in First‑line Treatment of Metastatic Non‑Small Cell Lung Cancer: The MYSTIC Phase 3 Randomized Clinical Trial. JAMA Oncol 2020; 6: 661−674.
- [5] First‑line Durvalumab Improves Survival | ESMO. [Accessed January 3, 2020]. Dostupné na: https://www.esmo.org/Oncology‑News/First‑line‑Durvalumab‑Improves‑Survival‑Compared‑to‑Chemotherapy‑in‑Metastatic‑NSCLC
- [6] Peters S, Cho BC, Reinmuth N, et al. Abstract CT074: Tumor mutational burden (TMB) as a biomarker of survival in metastatic non‑small cell lung cancer (mNSCLC): Blood and tissue TMB analysis from MYSTIC, a Phase III study of first‑line durvalumab ± tremelimumab vs chemotherapy. Cancer Res 2019; 79(13 Suppl): CT074−CT074.
- [7] Antonia SJ, Villegas A, Daniel D, et al., for the PACIFIC Investigators. Durvalumab after Chemoradiotherapy in Stage III Non–Small‑Cell Lung Cancer. N Engl J Med 2017; 377: 1919‑1929.
- [8] Antonia SJ, Villegas A, Daniel D, et al. Durvalumab after Chemoradiotherapy in Stage III Non‑Small‑Cell Lung Cancer. N Engl J Med 2017; 377: 1919−1929.
- [9] Gray JE, Villegas A, Daniel D, et al. Three‑Year Overall Survival with Durvalumab after Chemoradiotherapy in Stage III NSCLC‑Update from PACIFIC. J Thorac Oncol 2020; 15: 288−293.
- [10] Faivre‑Finn C, Vicente D, Kurata T, et al. LBA49 Durvalumab after chemoradiotherapy in stage III NSCLC: 4‑year survival update from the phase III PACIFIC trial. Ann Oncol 2020; 31: S1178−S1179.
- [11] Antonia SJ, Villegas A, Daniel D, et al. Overall Survival with Durvalumab after Chemoradiotherapy in Stage III NSCLC. N Engl J Med 2018; 379: 2342−2350.
- [12] Faivre‑Finn C, Spigel DR, Senan S, et al. 1363OEfficacy and safety evaluation based on time from completion of radiotherapy to randomization with durvalumab or placebo in pts from PACIFIC. Ann Oncol 2018; 29(Suppl 8): vii488–viii492.
- [13] Faivre‑Finn C, Vicente D, Kurata T, et al. Four‑Year Survival With Durvalumab After Chemoradiotherapy in Stage III NSCLC‑an Update From the PACIFIC Trial; J Thorac Oncol 2021; 16: 860–867.
- [14] European Medical Agency. Imfinzi: Summary of Product Characteristics. Dostupné na: https://www.ema.europa.eu.
- [15] Imfinzi‑epar‑product‑information_cs.pdf. [Accessed March 10, 2021]. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/imfinzi‑epar‑product‑information_cs.pdf
- [16] Paz‑Ares L, Dvorkin M, Chen Y, et al. Durvalumab plus platinum‑etoposide versus platinum‑etoposide in first‑line treatment of extensive‑stage small‑cell lung cancer (CASPIAN): a randomised, controlled, open‑label, phase 3 trial. Lancet 2019; 394: 1929−1939.
- [17] Goldman JW, Dvorkin M, Chen Y, et al. Durvalumab, with or without tremelimumab, plus platinum‑etoposide versus platinum‑etoposide alone in first‑line treatment of extensive‑stage small‑cell lung cancer (CASPIAN): updated results from a randomised, controlled, open‑label, phase 3 trial. Lancet Oncol 2021; 22: 51−65.