Nalmefen
Nalmefen je vedle naloxonu a naltrexonu specifickým antagonistou opioidních receptorů. Zpočátku byl používán jako antagonista respirační deprese po opioidech. Má velmi dlouhý biologický poločas a větší biologickou dostupnost po perorálním podání než naltrexon, kterému se chemicky velmi podobá. V dnešní době je nalmefen užíván hlavně při léčbě pacientů, kteří mají vysoké riziko abúzu alkoholu bez fyzických abstinenčních příznaků. Mechanismus jeho účinku spočívá hlavně v ovlivnění opioidního systému v oblastech mozku, které se podílejí na odměně.
Nalmefen byl syntetizován již začátkem sedmdesátých let 20. století a zpočátku studován jeho antagonistický účinek na respirační depresi po opioidech [1, 2]. V současné době se stále více uplatňuje při léčení závislosti na alkoholu spolu s naltrexonem [3, 4]. Je však vhodný také při léčbě jiných závislostí, např. na hracích automatech (gambling) nebo nákupech 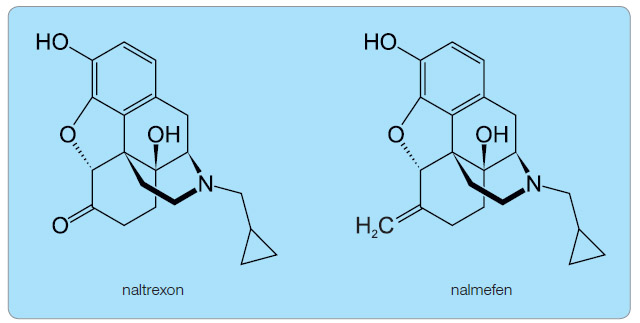 (oniománie).Nalmefen je derivát opioidů, vedle naloxonu a naltrexonu je dalším specifickým antagonistou opioidních receptorů. Chemickou strukturou a aktivitou se nalmefen podobá naltrexonu (obr. 1). Na rozdíl od něho má delší biologický poločas, vyšší biologickou dostupnost po perorální aplikaci a při opakovaném podání nebyla oproti naltrexonu zaznamenána jaterní toxicita [5].
(oniománie).Nalmefen je derivát opioidů, vedle naloxonu a naltrexonu je dalším specifickým antagonistou opioidních receptorů. Chemickou strukturou a aktivitou se nalmefen podobá naltrexonu (obr. 1). Na rozdíl od něho má delší biologický poločas, vyšší biologickou dostupnost po perorální aplikaci a při opakovaném podání nebyla oproti naltrexonu zaznamenána jaterní toxicita [5].
Nalmefen se liší od naltrexonu substitucí ketonové skupiny v šesté pozici skupinou methylovou, která výrazně zvyšuje jeho afinitu k µ-opioidním receptorům. Nalmefen je antagonista µ- a δ-opioidních receptorů a částečný agonista χ-opioidních receptorů. Parciální agonista na rozdíl od úplného agonisty obsadí také příslušný receptor, ale jeho účinek je slabší. Aktivace µ- a v menší míře δ-opioidních receptorů exogenními opioidy je spojena s odměnou a adiktivním účinkem opioidů. Naopak interakce s χ-opioidními receptory vede k dysforickým účinkům a tím pocitům nelibosti. Proto mají nalmefen i naltrexon částečně averzivní účinky vůči alkoholu [6].
Ovlivnění pocitů libosti
V dnešní době se zkoušejí specifičtí antagonisté opioidů při léčbě závislosti na alkoholu. Alkohol a ostatní drogy zasahují do mozkových oblastí, které se podílejí na odměně (obr. 2). Objev center odměny a potěšení v mozku má zajímavou historii. Koncept odměny v mozku vytvořili James Olds a Peter Miles náhodně již v roce 1954, kdy mylně zavedli při studiích procesů bdělosti v potkaním mozku elektrody do určité oblasti limbického systému. Když byl pokus uspořádán tak, že zvíře mohlo samo tyto elektrody stimulovat stisknutím páčky, Olds pozoroval, že tak činilo takřka bez přestávky až 5000krát za hodinu. Zvíře bylo schopno tolerovat i bolestivé podněty a omezit příjem potravy, jen aby dosáhlo příležitosti zmáčknout páčku. Tak byly nalezeny v mozku oblasti, které jsou zodpovědné za pocity libosti. Výzkumy u lidí pak ukázaly, že elektrická stimulace v některých oblastech mozku (zvláště tzv. mediální hypothalamus) vede k pocitům podobným jako při orgasmu. Libost a slast jsou tedy i u člověka svázány se systémem posilování a odměny [6]. 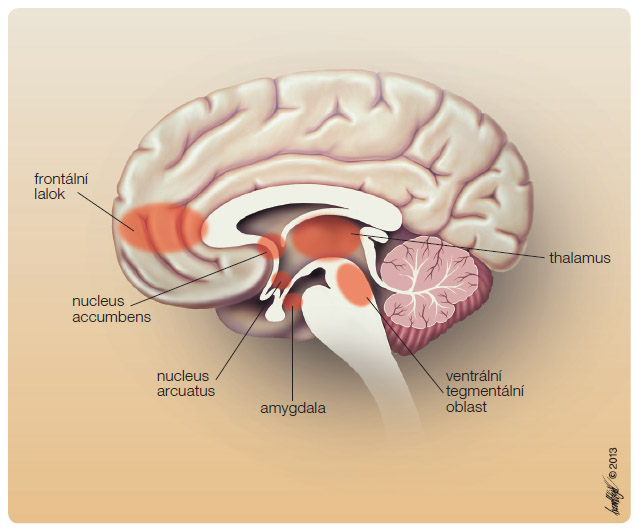
Pocit odměny má hierarchické vyjádření od „blaženého klidu a libosti“ až po zážitek srovnatelný s orgasmem. Závisí v první řadě na podané látce (opioidy, ketamin) a dále na způsobu aplikace. Obvykle nejsilnějšího účinku je dosaženo po intravenózní aplikaci. Ale i při netradičních způsobech aplikace (například kokain nazálně) je nástup účinku rychlý a výrazný. Na výsledném účinku se podílejí jak zevní faktory (prostředí, neznámé nebo známé osoby, hudba atd.), tak i vnitřní faktory (momentální nálada). Všechny tyto faktory shrnujeme pod pojmy „set and setting“.
V následujících desetiletích byly objeveny další mozkové oblasti a neurotransmitery, které se podílejí na odměňování. Právě závislost na alkoholu a ostatních drogách, jako je kokain nebo morfin, je vázána na systém odměny. Pro vyjádření odměny jsou rozhodující fylogeneticky staré mozkové struktury zahrnující limbický systém, nucleus accumbens a globus pallidus. Drogy působí uvolnění dopaminu v nucleus accumbens. Dopamin je tedy primárním neurotransmiterem odměny a posilování. Na biologii odměny se však podílejí i další neurotransmitery – serotonin v hypothalamu, enke![Obr. 3 Schéma účinků alkoholu v centrální nervové soustavě; volně podle [13] – Clapp, et al., 2008. GABA – kyselina γ-aminomáselná; VTA – ventrální tegmentální oblast](https://www.remedia.cz/photo-a-29457---.jpg) falin ve ventrální tegmentální oblasti (VTA) a v nucleus accumbens a inhibiční γ-aminomáselná kyselina (GABA) ve stejných mozkových oblastech. Jiný odměňovací neuronální okruh zahrnuje noradrenalin, který se nachází v hlavním noradrenergním jádru mozku – locus coeruleus. Za normálních okolností působí jednotlivé neurotransmitery v harmonické spolupráci excitaci a inhibici, což vede k pocitům pohody a uspokojení. Negativní emoce (strach, úzkost a hněv) vedou k narušení této rovnováhy a k eventuálnímu sáhnutí po drogách, které tyto negativní emoce odstraní.Alkohol ovlivňuje většinu neurotransmiterů a zasahuje na několika úrovních (obr. 3). Na vzniku závislosti na alkoholu se podílejí také genetické faktory.
falin ve ventrální tegmentální oblasti (VTA) a v nucleus accumbens a inhibiční γ-aminomáselná kyselina (GABA) ve stejných mozkových oblastech. Jiný odměňovací neuronální okruh zahrnuje noradrenalin, který se nachází v hlavním noradrenergním jádru mozku – locus coeruleus. Za normálních okolností působí jednotlivé neurotransmitery v harmonické spolupráci excitaci a inhibici, což vede k pocitům pohody a uspokojení. Negativní emoce (strach, úzkost a hněv) vedou k narušení této rovnováhy a k eventuálnímu sáhnutí po drogách, které tyto negativní emoce odstraní.Alkohol ovlivňuje většinu neurotransmiterů a zasahuje na několika úrovních (obr. 3). Na vzniku závislosti na alkoholu se podílejí také genetické faktory.
Opioidní systém
Důležitou úlohu při vzniku závislosti na drogách má také opioidní systém. Ten se nachází v celé centrální nervové soustavě. Podstatnou úlohu hraje při nocicepci, učení a paměti, emočním chování a také v procesech odměny [7]. Jeho význam při vzniku závislosti byl znám již delší dobu, když bylo prokázáno, že morfin a jeho deriváty mají vysoce adiktivní účinky. Avšak specifické opioidní receptory ( µ, δ a χ) a endogenní opiáty (enkefaliny a endorfiny) byly objeveny teprve v časných sedmdesátých letech 20. století [8]. Všechny typy opioidních receptorů jsou spojeny s G-proteinem. Při interakci opioidů s receptorem dochází k inhibici G-proteinu, což vede k redukci uvolnění neurotransmiterů a k inhibici neuronální aktivity.
Endogenní opioidní systém je v těsném vztahu s mezolimbickým dopaminovým systémem a jeho komponenty jsou vysoce zastoupeny v mozkových strukturách odměny [9, 10]. Opioidní receptory a peptidy se nacházejí v husté koncentraci v prefrontálním kortexu, jádrech hypothalamu (zejména n. arcuatus), ve VTA a amygdale. Enkefaliny také přímo modulují uvolnění dopaminu aktivací µ- a δ-receptorů v nucleus accumbens. Neurony opioidního systému v nucleus arcuatus v hypothalamu usnadňují aktivací µ-opioidních receptorů uvolnění dopaminu. Naopak aktivace opioidního systému dynorfin–χ-opioidní receptor tvoří protihráče zvýšené hladině dopaminu.
Na základě úzkého spojení mezi mezolimbickou µ- a δ-opioidní receptorovou aktivací a uvolněním dopaminu v nucleus accumbens by mohla farmakologická inhibice této cesty stejně tak jako aktivace χ-opioidních receptorů vést k léčbě adiktivního chování. Pokusy u tzv. knockoutovaných myší (myši, jejichž cílový gen je vyřazen) ukázaly, že při chybějícím µ-opioidním receptoru u nich dochází k zeslabení bažení po alkoholu. Vyplavení dopaminu alkoholem v nucleus accumbens je u těchto zvířat redukováno. Naopak myši s chybějícím δ-opioidním receptorem vykazují zvýšenou spontánní konzumaci alkoholu. U myší s chybějícím β-endorfinem dochází ke snížení spotřeby alkoholu, zatímco myši s chybějícím proenkefalinem (předstupeň enkefalinu) se významně neliší od divokého typu zvířat [11].
Klinické zkušenosti s nalmefenem
V osmdesátých a devadesátých letech 20. století byl nalmefen testován k antagonizování respirační deprese po opioidech. Moore a kol. [2] studovali schopnost nalmefenu předejít fentanylem indukované respirační depresi u 8 mužských dobrovolníků. Ti dostali 4krát v jednohodinových intervalech fentanyl v dávce 1 µg/kg. Při druhém sezení jim byl podán jednu hodinu před aplikací opioidů nalmefen i.v. v celkové dávce 1 mg. Při samostatném podání fentanylu došlo k progresivně se prohlubující dechové depresi. Při podání nalmefenu před aplikací fentanylu nebyly změny v respiraci vůbec pozorovány.
Gal a DiFazio aplikovali nalmefen v dávkách 0,5 mg, 1 mg nebo 2 mg i.v. [1]. Za 1, 2, 4, 6 a 8 hodin podali fentanyl v dávce 2 µg/kg. Samotný fentanyl vedl k výrazné respirační depresi. Předchozí podání nalmefenu v dávce 2 mg preventivně zabránilo ovlivnění psychiky a respiračně depresivních účinků fentanylu po celou dobu osmihodinového experimentu. Nalmefen v poloviční dávce 1 mg výrazně omezil účinky fentanylu, ale v době mezi 6. a 8. hodinou došlo k výrazné dechové depresi. Nejnižší dávka nalmefenu 0,5 mg působila antagonisticky na respiračně depresivní účinek fentanylu 4 hodiny. Nalmefen rovněž antagonizoval v závislosti na dávce analgetický účinek fentanylu.
Osud v organismu
Nalmefen může být podáván intravenózně, intramuskulárně a má dobrou biologickou dostupnost při perorální aplikaci, čehož se využívá při léčbě závislosti na alkoholu. Intravenózní dávka nalmefenu 0,5 mg a 1 mg úplně dlouhodobě antagonizuje respirační depresi po opioidech. Při perorální aplikaci se pohybuje dávkování mezi 20–80 mg.Při perorálním podání jedné dávky 18 mg je nejvyšší plazmatické koncentrace – cmax (16,5 ng/ml) – dosaženo za 1,5 hodiny. Absolutní biologická dostupnost nalmefenu je 41 %. Požití potravy s vysokým obsahem tuku zvyšuje cmax o 50 %, čas k dosažení nejvyšší plazmatické koncentrace je však prodloužen o 30 % [5]. Nalmefen se váže na plazmatické bílkoviny pouze z 30 %. Vyšetření pozitronovou tomografií ukázalo, že dávka 18 mg vede k 94–100% obsazení opioidních receptorů během tří hodin po požití. Nalmefen rychle prochází hematoencefalickou bariérou.
Nalmefen je metabolizován hlavně v játrech přímou konjugací s kyselinou glukuronovou a také N-dealkylací. Metabolity s glukuronidy jsou neaktivní, N-dealkylované metabolity mají minimální farmakologické účinky. Méně než 1 % dávky se vylučuje nezměněno.
Alkoholismus
Alkohol patří mezi poživatiny s vysokou kalorickou hodnotou. Jeho chronické požívání vede k celé řadě medicínských problémů a k postižení orgánových funkcí. Biologové F. Wiens a A. Zitzmann z Univerzity Bayreuth prokázali, že konzumace alkoholu má prastarý původ a vyskytuje se už velmi brzy v evoluci primátů. Tany péroocasé (Ptilocercus lowii), které patří k nejbližším příbuzným primátů, tráví v malajských džunglích noci tím, že vyhledávají zkvašený nektar palmy rodu Eugeissona. Palma láká návštěvníky opylující květy svým silně vonícím nektarem v květních poupatech. Působením různých druhů kvasinek dochází k jeho kvašení a koncentrace alkoholu v nektaru dosahuje až 3,8 %, což je nejvyšší obsah alkoholu, který je rostlinami vyráběn. Tany stráví pitím nektaru až dvě hodiny každou noc. Na rozdíl od ostatních rostlin kvete palma po celý rok, konzumace alkoholu je tak u tan chronická. Ačkoliv tany váží pouze okolo 50 g, nevykazují po požití alkoholu žádné známky opilosti. Alkohol v těle tany je velmi rychle odbouráván [12]. Zkvašenou šťávu plodů konzumují také opice, žirafy, sloni či prasata bradavičnatá. U všech těchto zvířat však byly pozorovány pohybové dyskoordinace a známky opilosti.
Alkohol ovlivňuje celou řadu neurotransmiterů, především opioidní systém a s ním těsně svázaný mezolimbický dopaminový systém. Aktivací endogenního opiátového systému a uvolněním endogenních opiátů účinkem alkoholu dochází k posílení závislosti na této droze. Zvýšené hladiny β-endorfinu se podílejí na vzniku závislosti a posilujícího chování. Jak již bylo zmíněno, knockoutované myši s chybějícím β-endorfinem mají velmi sníženou konzumaci alkoholu na rozdíl od divokých myší. Alkohol však také zasahuje do glutaminergních a GABAergních synapsí a také do metabolismu serotoninu. Při abstinenčních příznacích se uplatňuje především zvýšená aktivace excitační aminokyseliny glutamátu.
Terapeutické využití
Nalmefen i naltrexon zmírňují naléhavost touhy napít se a redukují stimulační a odměňující účinky alkoholu. Na druhé straně zvyšují jeho nežádoucí účinky, jako je únava, sedace i konfuze. Snižují impulzivitu rozhodnutí napít se. Zvýšení kognitivní kontroly a pokles impulzivity se uplatňuje také u patologických gamblerů. Účinkem obou antagonistů dochází k výrazné redukci frekvence pití a množství vypitého alkoholu. Trvalá psychosociální podpora pomáhá při adherenci k léčbě a omezování spotřeby alkoholu. Snížení potřeby alkoholu je pak mezistupněm na cestě k abstinenci. Pacient si zaznamenává údaje o konzumaci alkoholu v průběhu léčení nalmefenem. Jednu až dvě hodiny před předpokládaným pitím požije potahovanou tabletu v dávce 18 mg, která musí být polknuta celá. Pokud je nezbytné podat pacientům, kteří užívají nalmefen, opioidy, např. při akutním chirurgickém výkonu, je zapotřebí indikovat vyšší dávky. Optimální je přerušit aplikaci nalmefenu jeden týden před předpokládaným chirurgickým výkonem. Nalmefen nemá žádný nebo má zanedbatelný vliv na schopnost řídit a obsluhovat stroje. V těhotenství se nalmefen nedoporučuje, v pokusech na zvířatech byla zaznamenána reprodukční toxicita.
Seznam použité literatury
- [1] Gal TJ, DiFazio CA. Prolonged antagonism of opioid action with intravenous nalmefene in man. Anesthesiology 1986; 64: 175–180.
- [2] Moore LR, Bikhazi GB, Tuttle RR, Weidler DJ. Antagonism of fentanyl – induced respiratory depression with nalmefene. Methods Find Exp Clin Pharmacol 1990; 12: 29–35.
- [3] Mason BJ, Ritvo EC, Morgan RO, et al. A Double-Blind, Placebo-Controlled Pilot Study to Evaluate the Efficacy and Safety of Oral Nalmefene HCI for Alcohol Dependence. Alcohol Clin Exp Res 1994; 18: 1162–1167.
- [4] Anthon RF, Pttinati H, Zweben A, et al. A Multi-site Dose Ranging Study of Nalmefene in the Treatment of Alcohol Dependence. J Clin Psychopharmacol 2004; 24: 421–428.
- [5] Souhrn údajů o přípravku Selincro 2013, dostupné na www.sukl.cz (navštíveno 30. června 2013).
- [6] Hillemacher T, Heberlein A, Muschler M, et al. Opioid modulators for alcohol dependence. Expert Opin Investig Drugs 2011; 20: 1073–1086.
- [7] Bodnar RJ. Endogenous opiates and behavior: 2009. Peptides 2010; 31: 2325–2359.
- [8] Pert CB, Snider SH. Opiate receptor: Demonstration in nervous tissue. Science 1973; 179: 1011–1014.
- [9] Rada P, Barson JR, Leibowitz SF, et al. Opioids in the hypothalamus control dopamine and acetylcholine levels in the nucleus accumbens. Brain Res 2010; 131: 1–9.
- [10] Barson JR, Carr AJ, Soun JE, et al. Opioids in the nucleus accumbens stimulate ethanol intake. Physiol Behav 2009; 98: 453-459.
- [11] Kieffer BL, Gaveriaux-Rulf C. Exploring the opioid system by gene knockout. Prog Neurobiol 2002; 66: 285–306.
- [12] Spanagel R. Alkohol – Belohnungseffekte, Enthemmung und Sucht. Schweizer Zeitschrift für Ernährungsmedizin 2009; 1: 13–17.
- [13] Clapp P, Bhave SV, Hoffman PL. How adaptation of the brain to alcohol leeds to dependence. Alcohol Res Health 2008; 31: 310–339.