Nová data prezentovaná na kongresu ECTRIMS 2022 potvrzují účinnost i bezpečnost perorálního kladribinu
Souhrn
Andělová M. Nová data prezentovaná na kongresu ECTRIMS 2022 potvrzují účinnost i bezpečnost perorálního kladribinu. Remedia 2022; 32: 528–534.
Rozhodování o léčebné strategii u pacientů s roztroušenou sklerózou (RS) vždy zahrnuje odhad poměru bezpečnosti a účinnosti léčby. Ideální lék by měl být samozřejmě jak vysoce účinný, tak dlouhodobě co nejbezpečnější. V březnu 2019 schválil americký Úřad pro kontrolu potravin a léčiv (FDA) purinový antimetabolit kladribin pro perorální léčbu dospělých pacientů s vysoce aktivní relabující‑remitující RS. Jedná se o tzv. selektivní imunorekonstituční terapii, která se aplikuje v opakovaných krátkodobých pulzech s dlouhodobým účinkem. Jeden pulz představuje užívání tablet (počet tablet závisí na hmotnosti pacienta) v jedné denní dávce po dobu pěti dnů v prvním a druhém měsíci léčby. Tento léčebný pulz se zopakuje v druhém léčebném roce, zatímco ve třetím a čtvrtém roce jej není třeba opakovat. Celkově přibývá dat z klinických studií i z reálné praxe, která potvrzují vysokou účinnost, dobrou adherenci k léčbě i bezpečnostní profil léku. Tento článek uvádí některé nové poznatky o kladribinu, které byly prezentovány na kongresu European Committee for Treatment and Research in Multiple Sclerosis (ECTRIMS) 2022 v Amsterodamu. První část se týká hodnocení účinnosti a bezpečnosti uvedeného přípravku, druhá část shrnuje data o adherenci a kvalitě života.
Klíčová slova: roztroušená skleróza – perorální kladribin – bezpečnost – adherence – perzistence.
Summary
Andelova M. New data presented at the ECTRIMS 2022 congress confirm the effectiveness and safety of oral cladribine. Remedia 2022; 32: 528–534.
Treatment strategy decisions for patients with multiple sclerosis (MS) always involve an assessment of the safety‑effectiveness ratio. The ideal drug should be both highly effective and as safe as possible. In March 2019, FDA approved the purine antimetabolite cladribine for the oral treatment of adult patients with highly active relapsing‑remitting MS. It is a so‑called selective immune reconstitution therapy that is administered in repeated short‑term pulses with a long‑term effect. One pulse represents taking tablets (the number of tablets depends on the patient's weight) in one daily dose for five consecutive days in the first and second month of treatment. This treatment pulse is repeated in the second treatment year, while in the third and fourth years there is no need to repeat the pulse. Overall, there is increasing data from clinical trials and real‑world evidence confirming high effectiveness of this treatment, good adherence to it and it’s favorable safety profile. This article presents some new findings on cladribine that were presented at the ECTRIMS 2022 congress in Amsterdam. The first part is dedicated to the efficacy and safety evaluation of this agent, while the second part summarizes data on adherence and quality of life.
Key words: multiple sclerosis – oral cladribine – safety – adherence – persistence.
Na kongresu ECTRIMS (European Commitee for Treatment and Research in Multiple Sclerosis), který se konal v Amsterodamu 26.–28. října 2022, byla prezentována řada nových dat z klinických studií i reálné praxe týkajících se účinnosti a bezpečnosti léčby perorálním kladribinem.
Bezpečnost a účinnost
Časné zahájení vysoce aktivní léčby je důležité zejména u pacientů s negativními prognostickými markery.
Kromě zmírnění klinické aktivity byla v placebem kontrolované studii CLARITY vysoká účinnost kladribinu prokázána mimo jiné i pomocí magnetickorezonančních (MR) parametrů po 96 týdnech sledování [1]. První vyšetření MR ve studii CLARITY však bylo provedeno až šest měsíců po zahájení léčby, a proto nebylo možné hodnotit, zda k efektu terapie dochází již dříve. Protože rychlost nástupu účinku je u vysoce účinných imunomodulačních terapií důležitým parametrem, bylo jedním z cílů prospektivní intervenční multicentrické studie MAGNIFY‑MS určit načasování nástupu účinku kladribinu pomocí sledování aktivních ložisek na MR v prvních šesti měsících léčby [2]. Pacienti byli vyšetřeni na MR na počátku studie (baseline) a poté v měsících 1, 2, 3, 6, 12, 15, 18 a 24 po podání prvního pulzu kladribinu. První výsledky byly prezentovány již na kongresu ECTRIMS v roce 2020. Na letošním kongresu byla k dispozici data z dvouletého sledování [3]. Autoři vyhodnocovali u 270 dospělých pacientů s vysoce aktivní relabující‑remitující roztroušenou sklerózou (RR‑RS) s hodnotou na škále disability (Expanded Disability Status Scale, EDSS) ≤ 5,5 účinnost kladribinu pomocí následujících klinických parametrů: roční počet relapsů (annualized relapse rate, ARR), hodnocení fyzického postižení pomocí škály EDSS a hodnocení kognice pomocí SDMT (Symbol Digit Modalities Test), který reflektuje rychlost zpracování informací, pozornost, pracovní paměť a psychomotorické tempo. Kromě toho byly hodnoceny MR ukazatele: počet gadolinium enhancujících lézí, počet aktivních (nových nebo zvětšujících se) lézí a kombinace těchto dvou parametrů (combined unique activity, CUA). Během léčby zůstalo 71,1 % pacientů bez relapsu, 17 % pacientů mělo nejméně jeden relaps a u 11,9 % pacientů nebylo známo, zda měli, či neměli relaps. Parametr ARR činil 0,11 (95% interval spolehlivosti [CI] 0,09–0,15) a EDSS bylo u většiny pacientů stabilní (medián EDSS 2,0). Z hlediska MR parametrů bylo pozorováno výrazné snížení počtu aktivních lézí (CUA) již od druhého měsíce po zahájení léčby. Maximální průměrný rozdíl v počtu lézí (tedy rozdíl mezi průměrným počtem aktivních lézí na počátku a během léčby) byl doložen v šestém měsíci léčby a tento rozdíl přetrval až do konce sledování (24. měsíc). Stejný trend byl patrný pro průměrný roční počet gadolinium enhancujících lézí a aktivních T2 lézí. Od druhého měsíce byla MR aktivita onemocnění relativně nízká – nejméně jedna nová léze se objevila u 20,1 % pacientů mezi měsíci 6–12, u 20,8 % pacientů mezi měsíci 12–18 a u 13,8 % pacientů mezi měsíci 18–24. Podíl pacientů, u nichž nebyla pozorována žádná MR aktivita, se zvýšil ze vstupních 47 % na 86,2 % v posledních šesti měsících léčby (měsíce 18–24). Nežádoucí příhody vzniklé při léčbě byly hlášeny u 45,2 % pacientů (26,3 % bylo mírných, 17,4 % středně závažných a 1,5 % závažných). Hlášené lymfopenie byly prvního či druhého stupně (dohromady 54,4 %). Lymfopenie třetího stupně byla zaznamenána u 24,4 % pacientů a čtvrtého stupně pouze u 0,7 % pacientů.
Zmírnění MR aktivity po zahájení léčby kladribinem bylo jednoznačné také v malé retrospektivní studii ze Španělska [4]. Při zahájení terapie byla MR aktivita patrná u velké části pacientů (82,9 %), zatímco po jednom roce, resp. dvou letech pouze u 42,4 %, resp. 40 % pacientů. Přestože se jednalo o malou kohortu nemocných, důležitým pozorováním bylo, že pacienti, u nichž byla po jednom roce léčby zaznamenána MR aktivita, měli významně vyšší riziko relapsu (p = 0,024) i pozdější MR aktivity po 2–3 letech léčby (poměr šancí [odds ratio, OR] 14; 95% CI 1,86–10,5; p = 0,01).
Nová data o účinnosti a bezpečnosti kladribinu ukázala rovněž studie CLARIFY‑MS [5], jejímž primárním cílem bylo hodnocení kvality života pacientů užívajících kladribin. Celkem 482 nemocných bylo rozděleno do dvou skupin – skupina bez předchozí léčby (n = 134) a skupina s jakoukoliv předchozí zkušeností s chorobu modifikující terapií (disease‑modifying therapy, DMT; n = 348). Ve druhé skupině byli pacienti s delším trváním RS (průměr u osob bez předchozí léčby 42,6 ± 58,7 měsíce, u předléčených 120,9 ± 90,3 měsíce) a s mírně vyšší hodnotou na EDSS (medián u osob bez předchozí léčby 2,0, u předléčených 2,5). U obou skupin zůstala hodnota na EDSS po dvou letech stabilní. Nejčastějšími nežádoucími příhodami spojenými s léčbou byly bolesti hlavy, lymfopenie (většina 1.–2. stupně) a nazofaryngitida. Nebyly pozorovány žádné nové závažné oportunní infekce.
Bezpečností kladribinu se blíže zabýval také profesor Giovannoni se svými kolegy [6]. Cílem práce byla aktualizace poregistrační bezpečnosti kladribinu, jímž bylo do července 2022 léčeno odhadem 56 300 pacientů (95 664 pacientoroků od roku 2017). Autoři analyzovali závažné a nezávažné nežádoucí účinky z poregistračních studií (včetně spontánně hlášených případů týkajících se bezpečnosti), neintervenčních a intervenčních postmarketingových studií a ze zpráv z dalších vyžádaných zdrojů. Důraz byl kladen na takzvané nežádoucí účinky zvláštního významu, na hypersenzitivitu a jaterní léze. Pro nežádoucí účinky zvláštního významu autoři vypočetli adjustovanou incidenci na 100 pacientoroků, zatímco pro hypersenzitivitu a jaterní léze uvádějí hrubé odhady. V období mezi 8. červencem 2021 a 7. červencem 2022 nebyla identifikována žádná nová rizika. Nejčastějším nežádoucím účinkem zvláštního významu byla infekce virem herpes zoster (514 případů; adjustovaná incidence 0,54/100 pacientoroků; 95% CI 0,49–0,59). Daleko nejčastější byl pásový opar (494 případů), zatímco herpes zoster ophtalmicus (14 případů), genitální herpes zoster (4 případy), reaktivace herpes zoster (4 případy), herpetická meningitida a meningoencefalitida (po 1 případu) byly vzácné. Dále byly hlášeny oportunní infekce (15 případů) – zde autoři uvádějí ojedinělé případy mykotických infekcí gastrointestinálního traktu, histoplazmózu, nokardiózu, kryptokokovou pneumonii a toxoplazmózu. Případ progresivní multifokální leukoencefalopatie naštěstí zaznamenán nebyl. Z dalších infekcí byla hlášena tuberkulóza (23 případů).
Ze závažných průběhů neoportunních infekcí (754 případů) byly nejčastější infekce močových cest (n = 117) a covid‑19. Malignity byly dokumentovány u 187 pacientů. Závažná lymfopenie byla hlášena ve 112 případech (43 případů bylo spojeno s infekčními komplikacemi) a 1 810 hlášení se týkalo hypersenzitivity (kožní výsev, pruritus, kopřivka, erytém a otok obličeje). Zvláštní kategorii představovalo poškození jater. V klinických studiích byly pozorovány pouze ojedinělé (n = 2) případy mírné hepatopatie. Během postmarketingových sledování se objevilo dalších 58 případů hepatopatie, z nichž byly dva závažné a jeden fatální. Šlo o izolované případy přechodné elevace hodnot aminotransferáz (až 40násobek normy) a/nebo o hepatitidu s přechodnou hyperbilirubinemií a ikterem. Většina těchto nečetných případů se objevila během osmi týdnů po prvním léčebném pulzu. V případě fatální hepatopatie se však jednalo o pacienta s anamnézou alkoholického poškození jater a s tuberkulózou, který byl před zahájením léčby kladribinem léčen i isoniazidem a u něhož autoři případové studie interpretovali fatální selhání ledvin jako důsledek toxicity isoniazidu, a nikoliv samotného kladribinu. Před zahájením léčby kladribinem je doporučeno odebrat podrobnou anamnézu s důrazem na jaterní léze způsobené jinými léky či možné jaterní onemocnění. Dále je nutné laboratorní vyšetření hodnot aminotransferáz, alkalické fosfatázy a bilirubinu před podáním tablet kladribinu (rok 1 i 2) a průběžné monitorování jaterních funkcí dle klinického stavu. Autoři uzavírají práci shrnutím, že bezpečnostní profil kladribinu se k červenci 2022 shoduje s daty z klinických studií a hepatotoxicita je důležitým, ale vzácným nežádoucím účinkem léčby kladribinem.
Časovou souvislost mezi zahájením léčby kladribinem a časnými nežádoucími účinky analyzovali autoři z Německa a Švýcarska na základě dat ze studie CLEVER [7]. CLEVER (2017–2020) byla první neintervenční studií zabývající se spokojeností pacientů v Německu s léčbou kladribinem. Pacienti byli monitorováni během prvních šesti měsíců po zahájení léčby celkem třikrát (baseline, týden 4 a týden 24) a mimo jiné byla sbírána i data týkající se nežádoucích účinků. Výskyt nežádoucích účinků byl hodnocen u pacientů ve vztahu k předchozí léčbě: 1. u 61 pacientů bez předchozí léčby; 2. u 242 pacientů ‚ kteří byli před kladribinem na léčbě první linie (interferony, glatiramer acetát, dimetylfumarát či teriflunomid) a 3. u 106 pacientů ‚ kteří již před kladribinem měli vysoce účinnou léčbu (alemtuzumab, fingolimod, natalizumab, okrelizumab). Nežádoucí účinky nahlásilo 187 pacientů (38,1 %). Nežádoucí účinky spojené s léčbou byly hlášeny u 90 pacientů (18,3 %), z nichž se pouze v případě jednoho pacienta (0,2 %) jednalo o závažný nežádoucí účinek. U značné části pacientů, kteří zaznamenali nežádoucí účinek (53 %), se tento nežádoucí účinek objevil v prvních 45 dnech po užití první tablety kladribinu. Nejčastějšími nežádoucími účinky v prvních 45 dnech léčby kladribinem byly bolesti hlavy (2,2 %), zažívací obtíže (2,0 %), kožní afekce (1,8 %), lymfopenie (1,2 %), chyba v užití léku (1,2 %) a únava (0,8 %). Zatímco ve skupině pacientů, kteří před kladribinem neměli specifickou léčbu pro RS, byly častější gastrointestinální a kožní obtíže, u pacientů přecházejících na kladribin z první linie DMT byly častější bolesti hlavy a u pacientů, kteří již před kladribinem byli léčeni vysoce účinnými léky na RS, byla častější lymfopenie. Celkově byl však kladribin tolerován dobře s relativně nízkým výskytem časných nežádoucích účinků a po 45. dni počet nežádoucích příhod poklesl. Tyto výsledky jsou v souladu s post hoc analýzami bezpečnosti ze studií CLARITY [1] a ORACLE‑MS [8].
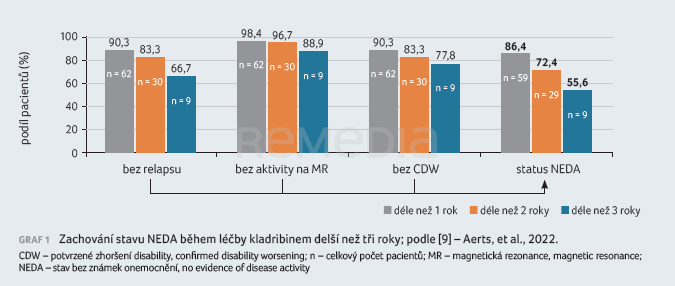 Menší práce z belgického pracoviště využila k hodnocení dat z reálné praxe koncept NEDA (no evidence of disease activity) [9]. Retrospektivně bylo hodnoceno 84 pacientů, jimž byla mezi srpnem 2018 a listopadem 2021 indikována terapie kladribinem. Většině pacientů (n = 47) byla léčba kladribinem nasazena na základě předchozí aktivity onemocnění. Nejčastější léčbou před kladribinem byly dimetylfumarát či fingolimod. Kladribin byl dobře tolerován a nebyly hlášeny závažné nežádoucí účinky. Léčbu přerušili pouze dva pacienti a sedm pacientů dostalo třetí pulz. NEDA, tedy stav, kdy u pacienta není zaznamenán relaps, setrvalé zhoršení EDSS ani nová aktivita na MR, byl dokumentován u 86,4 % pacientů po prvním roce léčby, u 72,4 % pacientů po druhém roce léčby a u 55,6 % pacientů po třetím roce léčby (graf 1).
Menší práce z belgického pracoviště využila k hodnocení dat z reálné praxe koncept NEDA (no evidence of disease activity) [9]. Retrospektivně bylo hodnoceno 84 pacientů, jimž byla mezi srpnem 2018 a listopadem 2021 indikována terapie kladribinem. Většině pacientů (n = 47) byla léčba kladribinem nasazena na základě předchozí aktivity onemocnění. Nejčastější léčbou před kladribinem byly dimetylfumarát či fingolimod. Kladribin byl dobře tolerován a nebyly hlášeny závažné nežádoucí účinky. Léčbu přerušili pouze dva pacienti a sedm pacientů dostalo třetí pulz. NEDA, tedy stav, kdy u pacienta není zaznamenán relaps, setrvalé zhoršení EDSS ani nová aktivita na MR, byl dokumentován u 86,4 % pacientů po prvním roce léčby, u 72,4 % pacientů po druhém roce léčby a u 55,6 % pacientů po třetím roce léčby (graf 1).
Také v datech z reálné praxe v Austrálii u 180 relativně starších pacientů (průměrný věk 49,13 roku), z nichž byl významný počet léčen před kladribinem vysoce účinnými léky (38 osob anti‑CD20, 33 osob fingolimod, 30 osob natalizumab) a pouze 46 pacientů nemělo předchozí léčbu, byl kladribin dobře tolerován a po druhém pulzu mělo 51 % pacientů stabilní EDSS, u 30 % došlo ke zlepšení a 19 % pacientů se zhoršilo [10].
Adherence k léčbě a kvalita života
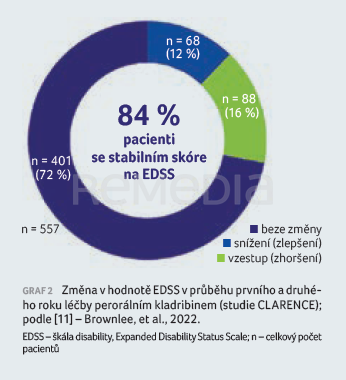 Adherence a perzistence k léčbě kladribinem u pacientů z Anglie byla předmětem části studie CLARENCE [11]. Sběr dat z reálné praxe probíhal přes platformu BlueteqÒ, kde jsou registrováni všichni pacienti, jimž je v rámci National Health Service (NHS) předepsána nákladná léčba RS. Autoři se zaměřili na období mezi listopadem 2017 a zářím 2021 a hodnotili, zda pacienti dokončili léčbu kladribinem (kumulativní dávka 3,5 mg/kg během dvou let), zda léčbu nedokončili, nebo změnili léčbu z kladribinu na jiný přípravek v jakémkoliv časovém odstupu po podání první dávky kladribinu. Dále byla hodnocena změna EDSS. Celkově byla analyzována data 1 934 pacientů, z nichž 36 % bylo zcela bez předchozí léčby a 48 % bylo před kladribinem léčeno pouze jedním přípravkem DMT. Medián EDSS činil 2,5 (0–8,5). Kompletní dva roky léčby dokončilo 1 020 pacientů (53 %). Dalších 742 pacientů (38 %) dostalo první pulz (první rok) léčby, ale v době analýzy jejich follow‑up ještě nedosáhl délky 18 měsíců. Pouze 172 pacientů (9 %) během hodnoceného období buď nedokončilo léčbu (pacienti, jimž byl předepsán pouze jeden rok léčby a měli follow‑up 18 měsíců), nebo změnili léčbu po prvních dvou pulzech léčby kladribinem (a to i v případě, že byl follow‑up < 18 měsíců). Přerušení, resp. nedokončení léčby bylo častěji pozorováno u skupiny pacientů se závažným postižením – po prvním pulzu v léčbě nepokračovalo 14 % pacientů s EDSS ≥ 5,0, zatímco u skupiny pacientů s EDSS 3,0–4,5 to bylo 9 % pacientů a ve skupinách s EDSS ≤ 2,5 pouze 7 % pacientů. S tím souvisela i vyšší četnost přerušení léčby u nemocných, kteří byli před kladribinem léčeni dvěma a více DMT (81 % osob léčbu dokončilo a 19 % osob léčbu přerušilo). U pacientů bez předchozí léčby a u pacientů léčených před kladribinem pouze jednou DMT bylo přerušení léčby méně časté (87 % a 86 % osob léčbu dokončilo, 13 % a 14 % osob léčbu přerušilo). Léčbu změnilo pouze 78 pacientů (4 %), z toho 45 pacientů (2,3 %) po prvním pulzu (prvním roce) a 33 pacientů (1,7 %) po druhém pulzu (po druhém roce) kladribinu. Změny léčby byly častější u předléčených pacientů (n = 58; 3 %) než u pacientů bez předchozí léčby (n = 20; 1 %). U 557 nemocných, kteří dokončili oba léčebné roky kladribinu, byla k dispozici klinická data (změna EDSS mezi 1. a 2. léčebným rokem). U 84 % pacientů buď nedošlo ke změně EDSS (n = 401; 72 %), nebo se hodnota na EDSS oproti baseline zlepšila (n = 68; 12 %). U zbylých 88 pacientů (16 %) bylo zaznamenáno zhoršení EDSS (graf 2). Podíl pacientů se stabilním či zlepšeným skóre EDSS a pacientů, u kterých došlo k jeho zhoršení, se nelišil mezi skupinou předléčených nemocných a nemocných bez předchozí léčby. Výsledky studie CLARENCE, tedy vysoký podíl perzistence, nízká frekvence změn léčby a stabilní EDSS mezi léčebným rokem 1 a 2, a to zejména u pacientů bez předchozí léčby nebo u pacientů léčených pouze jedním přípravkem DMT před léčbou kladribinem, zdůrazňují význam časného zahájení léčby kladribinem.
Adherence a perzistence k léčbě kladribinem u pacientů z Anglie byla předmětem části studie CLARENCE [11]. Sběr dat z reálné praxe probíhal přes platformu BlueteqÒ, kde jsou registrováni všichni pacienti, jimž je v rámci National Health Service (NHS) předepsána nákladná léčba RS. Autoři se zaměřili na období mezi listopadem 2017 a zářím 2021 a hodnotili, zda pacienti dokončili léčbu kladribinem (kumulativní dávka 3,5 mg/kg během dvou let), zda léčbu nedokončili, nebo změnili léčbu z kladribinu na jiný přípravek v jakémkoliv časovém odstupu po podání první dávky kladribinu. Dále byla hodnocena změna EDSS. Celkově byla analyzována data 1 934 pacientů, z nichž 36 % bylo zcela bez předchozí léčby a 48 % bylo před kladribinem léčeno pouze jedním přípravkem DMT. Medián EDSS činil 2,5 (0–8,5). Kompletní dva roky léčby dokončilo 1 020 pacientů (53 %). Dalších 742 pacientů (38 %) dostalo první pulz (první rok) léčby, ale v době analýzy jejich follow‑up ještě nedosáhl délky 18 měsíců. Pouze 172 pacientů (9 %) během hodnoceného období buď nedokončilo léčbu (pacienti, jimž byl předepsán pouze jeden rok léčby a měli follow‑up 18 měsíců), nebo změnili léčbu po prvních dvou pulzech léčby kladribinem (a to i v případě, že byl follow‑up < 18 měsíců). Přerušení, resp. nedokončení léčby bylo častěji pozorováno u skupiny pacientů se závažným postižením – po prvním pulzu v léčbě nepokračovalo 14 % pacientů s EDSS ≥ 5,0, zatímco u skupiny pacientů s EDSS 3,0–4,5 to bylo 9 % pacientů a ve skupinách s EDSS ≤ 2,5 pouze 7 % pacientů. S tím souvisela i vyšší četnost přerušení léčby u nemocných, kteří byli před kladribinem léčeni dvěma a více DMT (81 % osob léčbu dokončilo a 19 % osob léčbu přerušilo). U pacientů bez předchozí léčby a u pacientů léčených před kladribinem pouze jednou DMT bylo přerušení léčby méně časté (87 % a 86 % osob léčbu dokončilo, 13 % a 14 % osob léčbu přerušilo). Léčbu změnilo pouze 78 pacientů (4 %), z toho 45 pacientů (2,3 %) po prvním pulzu (prvním roce) a 33 pacientů (1,7 %) po druhém pulzu (po druhém roce) kladribinu. Změny léčby byly častější u předléčených pacientů (n = 58; 3 %) než u pacientů bez předchozí léčby (n = 20; 1 %). U 557 nemocných, kteří dokončili oba léčebné roky kladribinu, byla k dispozici klinická data (změna EDSS mezi 1. a 2. léčebným rokem). U 84 % pacientů buď nedošlo ke změně EDSS (n = 401; 72 %), nebo se hodnota na EDSS oproti baseline zlepšila (n = 68; 12 %). U zbylých 88 pacientů (16 %) bylo zaznamenáno zhoršení EDSS (graf 2). Podíl pacientů se stabilním či zlepšeným skóre EDSS a pacientů, u kterých došlo k jeho zhoršení, se nelišil mezi skupinou předléčených nemocných a nemocných bez předchozí léčby. Výsledky studie CLARENCE, tedy vysoký podíl perzistence, nízká frekvence změn léčby a stabilní EDSS mezi léčebným rokem 1 a 2, a to zejména u pacientů bez předchozí léčby nebo u pacientů léčených pouze jedním přípravkem DMT před léčbou kladribinem, zdůrazňují význam časného zahájení léčby kladribinem.
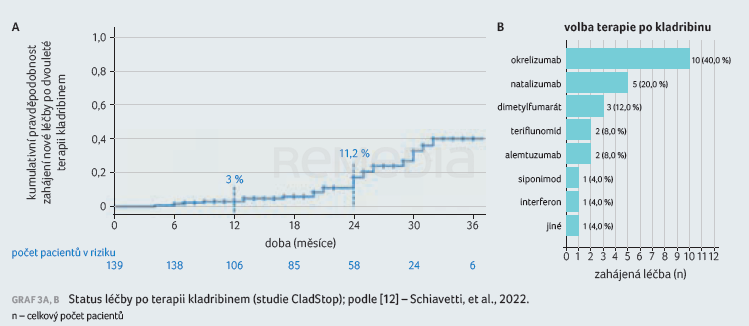 Tyto výsledky odpovídají pozorováním ze studie CladStop, které prezentovala profesorka Schiavetti [12]. CladStop je retrospektivní observační, multicentrická italská studie hodnotící přídavnou terapii po léčbě kladribinem. Do studie bylo zařazeno 139 pacientů, kteří dokončili standardní terapii (2 × 5 léčebných dnů s odstupem jednoho měsíce ve dvou cyklech s odstupem jednoho roku) a kteří měli follow‑up nejméně šest měsíců po podání druhého léčebného pulzu. U 25 pacientů byla během 12 měsíců po druhém pulzu (druhém léčebném roce) většinou z důvodu relapsu zahájena nová léčba, nejčastěji se jednalo o okrelizumab (n = 10; 40 %) a natalizumab (n = 5; 20 %), graf 3A, B. Většina pacientů po druhém léčebném roce novou léčbu nepotřebovala.
Tyto výsledky odpovídají pozorováním ze studie CladStop, které prezentovala profesorka Schiavetti [12]. CladStop je retrospektivní observační, multicentrická italská studie hodnotící přídavnou terapii po léčbě kladribinem. Do studie bylo zařazeno 139 pacientů, kteří dokončili standardní terapii (2 × 5 léčebných dnů s odstupem jednoho měsíce ve dvou cyklech s odstupem jednoho roku) a kteří měli follow‑up nejméně šest měsíců po podání druhého léčebného pulzu. U 25 pacientů byla během 12 měsíců po druhém pulzu (druhém léčebném roce) většinou z důvodu relapsu zahájena nová léčba, nejčastěji se jednalo o okrelizumab (n = 10; 40 %) a natalizumab (n = 5; 20 %), graf 3A, B. Většina pacientů po druhém léčebném roce novou léčbu nepotřebovala.
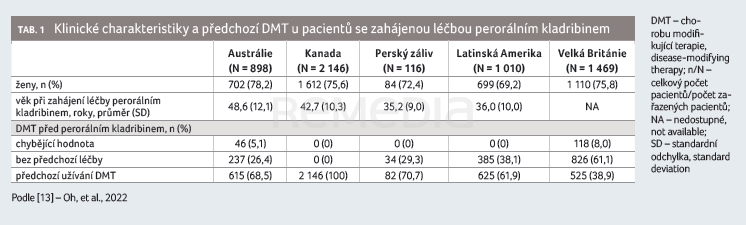 Přestože po doporučené kumulativní dávce kladribinu (3,5 mg/kg podaných během prvních dvou léčebných let) dle Evropské lékové agentury (EMA) není v roce 3 a 4 doporučeno další podání léčby, je nutno pacienty pravidelně monitorovat a v některých případech aplikovat další (třetí) pulz kladribinu i po druhém roce léčby. V České republice lze po druhém léčebném roce žádat o úhradu kladribinu individuálně. Otázkou, kolik pacientů léčených kladribinem zahájí třetí léčebný pulz, se mimo jiné zabývala práce, která jako zdroj dat využila podpůrný program pro pacienty léčené kladribinem (AdvevaÒ) v několika zemích (Austrálie, Kanada, Velká Británie, země v oblasti Perského zálivu a Latinské Ameriky) [13]. Hodnoceno bylo období mezi prosincem 2017 a únorem 2022. Dalším cílem práce bylo hodnotit zahájení léčby a případné zpožděné zahájení ve druhém léčebném roce. Celkově byla analyzována data 5 649 pacientů, kteří zahájili léčbu kladribinem a využívali program AdvevaÒ. Klinické charakteristiky a zejména podíl pacientů, kteří byli před kladribinem léčeni jinými DMT a který se výrazně lišil mezi jednotlivými zeměmi, ukazuje tabulka 1. Zatímco u pacientů z Velké Británie byl kladribin u většiny nemocných (61 %) první léčbou, v ostatních zemích byla většina pacientů před kladribinem již léčena jinými DMT (62–100 % dle regionu). U pacientů, u nichž byla dostupná nejméně 18měsíční data (po zahájení léčby), se ukázalo, že více než 95 % zahájilo druhý léčebný rok (Austrálie 97,2 %, Kanada 95,8 %, země Perského zálivu a Latinské Ameriky 100 % a Velká Británie 95,5 %). Doba mezi zahájením léčby v prvním a druhém roce se pohybovala mezi 12,16–13,14 měsíce. Ke zpožděnému zahájení druhého léčebného roku (posunutí o šest či více měsíců) došlo u 4,6 % pacientů v Austrálii, u 4,3 % v Kanadě, u 2,5 % v zemích Perského zálivu, u 2,3 % v zemích Latinské Ameriky a u 10,3 % ve Velké Británii. Autoři neuvádějí konkrétní důvody zpoždění léčby (např. infekce, lymfopenie, vakcinace?), ale spekulují, že opoždění léčby ve Velké Británii by mohlo souviset s doporučením Asociace britských neurologů týkajícím se onemocnění covid‑19 a užívání kladribinu u pacientů s RS (odsunutí léčby kladribinem u vysoce rizikových pacientů). Data týkající se třetího pulzu kladribinu byla dostupná pro australskou, kanadskou a britskou skupinu pacientů. Třetí pulz byl podán v těchto zemích u 0,5–7,7 % pacientů, a to v průměru 29,4–40,2 měsíce po zahájení prvního pulzu. Důvody přidání třetího pulzu autoři neanalyzovali. Adherence k léčbě byla tedy ještě vyšší než ve výše zmíněné studii CLARENCE a zpoždění zahájení léčby ve druhém léčebném roce bylo minimální.
Přestože po doporučené kumulativní dávce kladribinu (3,5 mg/kg podaných během prvních dvou léčebných let) dle Evropské lékové agentury (EMA) není v roce 3 a 4 doporučeno další podání léčby, je nutno pacienty pravidelně monitorovat a v některých případech aplikovat další (třetí) pulz kladribinu i po druhém roce léčby. V České republice lze po druhém léčebném roce žádat o úhradu kladribinu individuálně. Otázkou, kolik pacientů léčených kladribinem zahájí třetí léčebný pulz, se mimo jiné zabývala práce, která jako zdroj dat využila podpůrný program pro pacienty léčené kladribinem (AdvevaÒ) v několika zemích (Austrálie, Kanada, Velká Británie, země v oblasti Perského zálivu a Latinské Ameriky) [13]. Hodnoceno bylo období mezi prosincem 2017 a únorem 2022. Dalším cílem práce bylo hodnotit zahájení léčby a případné zpožděné zahájení ve druhém léčebném roce. Celkově byla analyzována data 5 649 pacientů, kteří zahájili léčbu kladribinem a využívali program AdvevaÒ. Klinické charakteristiky a zejména podíl pacientů, kteří byli před kladribinem léčeni jinými DMT a který se výrazně lišil mezi jednotlivými zeměmi, ukazuje tabulka 1. Zatímco u pacientů z Velké Británie byl kladribin u většiny nemocných (61 %) první léčbou, v ostatních zemích byla většina pacientů před kladribinem již léčena jinými DMT (62–100 % dle regionu). U pacientů, u nichž byla dostupná nejméně 18měsíční data (po zahájení léčby), se ukázalo, že více než 95 % zahájilo druhý léčebný rok (Austrálie 97,2 %, Kanada 95,8 %, země Perského zálivu a Latinské Ameriky 100 % a Velká Británie 95,5 %). Doba mezi zahájením léčby v prvním a druhém roce se pohybovala mezi 12,16–13,14 měsíce. Ke zpožděnému zahájení druhého léčebného roku (posunutí o šest či více měsíců) došlo u 4,6 % pacientů v Austrálii, u 4,3 % v Kanadě, u 2,5 % v zemích Perského zálivu, u 2,3 % v zemích Latinské Ameriky a u 10,3 % ve Velké Británii. Autoři neuvádějí konkrétní důvody zpoždění léčby (např. infekce, lymfopenie, vakcinace?), ale spekulují, že opoždění léčby ve Velké Británii by mohlo souviset s doporučením Asociace britských neurologů týkajícím se onemocnění covid‑19 a užívání kladribinu u pacientů s RS (odsunutí léčby kladribinem u vysoce rizikových pacientů). Data týkající se třetího pulzu kladribinu byla dostupná pro australskou, kanadskou a britskou skupinu pacientů. Třetí pulz byl podán v těchto zemích u 0,5–7,7 % pacientů, a to v průměru 29,4–40,2 měsíce po zahájení prvního pulzu. Důvody přidání třetího pulzu autoři neanalyzovali. Adherence k léčbě byla tedy ještě vyšší než ve výše zmíněné studii CLARENCE a zpoždění zahájení léčby ve druhém léčebném roce bylo minimální.
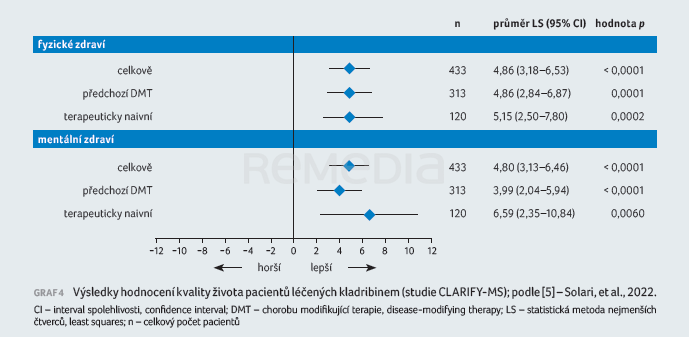 Kromě účinnosti a bezpečnosti léčby ovlivňujících průběh onemocnění je zcela zásadní kvalita života pacientů. Cílem výše uvedené studie CLARIFY‑MS bylo mimo jiné zhodnotit kvalitu života pacientů s vysoce aktivní RS léčených kladribinem pomocí strukturovaného sebehodnoticího dotazníku Multiple Sclerosis Quality of Life‑54 (MSQoL‑54). Skóre MSQoL‑54 se na počátku nelišilo mezi předléčenými pacienty a pacienty, kteří před kladribinem DMT neměli [5]. Graf 4 znázorňuje změny ve skóre MSQoL‑54 (zvlášť fyzické a psychické zdraví) mezi počátkem sledování a měsícem 24. V celé kohortě i u obou podskupin došlo k významnému zlepšení kvality života.
Kromě účinnosti a bezpečnosti léčby ovlivňujících průběh onemocnění je zcela zásadní kvalita života pacientů. Cílem výše uvedené studie CLARIFY‑MS bylo mimo jiné zhodnotit kvalitu života pacientů s vysoce aktivní RS léčených kladribinem pomocí strukturovaného sebehodnoticího dotazníku Multiple Sclerosis Quality of Life‑54 (MSQoL‑54). Skóre MSQoL‑54 se na počátku nelišilo mezi předléčenými pacienty a pacienty, kteří před kladribinem DMT neměli [5]. Graf 4 znázorňuje změny ve skóre MSQoL‑54 (zvlášť fyzické a psychické zdraví) mezi počátkem sledování a měsícem 24. V celé kohortě i u obou podskupin došlo k významnému zlepšení kvality života.
Závěr
Aktuální práce týkající se tolerance i bezpečnosti terapie perorálním kladribinem u pacientů s relabující‑remitující roztroušenou sklerózou se shodují s výsledky z klinických studií. Kromě několika nově zaznamenaných případů hepatotoxicity nebyla identifikována nová rizika. Celkově tedy přibývá dat, jež potvrzují vysokou účinnost, dobrou adherenci k léčbě i lepší bezpečnostní profil, než se původně předpokládalo, a kladribin si získává pevné místo mezi léky ovlivňujícími průběh onemocnění. Ne zcela vyřešena je otázka změny léčby, resp. podání dalšího pulzu kladribinu po ukončení druhého léčebného roku. Bylo prezentováno rovněž několik zajímavých posterů představujících probíhající studie s kladribinem, jejichž výsledky zatím nejsou k dispozici – např. londýnská observační studie CLADRIPLAS hodnotící vliv kladribinu na intratekální B lymfocyty, plazmocyty a lehké řetězce neurofilament [14], jejíž výsledky očekávají autoři počátkem roku 2023. Další důležitou studií je norská prospektivní, randomizovaná, otevřená multicentrická studie non‑inferiority porovnávající kohortu pacientů léčených rituximabem a kladribinem (NOR‑MS), do níž bylo zařazeno 264 pacientů a jejíž výsledky jsou očekávány v létě 2024 [15]. Této problematice bude jistě věnována část prací na dalších kongresech ECTRIMS.
Literatura
[1] Giovannoni G, Comi G, Cook S, et al. A Placebo‑Controlled Trial of Oral Cladribine for Relapsing Multiple Sclerosis. N Engl J Med 2010; 362: 416–426.
[2] De Stefano N, Barkhof F, Montalban X, et al. Early Reduction of MR Activity During 6 Months of Treatment With Cladribine Tablets for Highly Active Relapsing Multiple Sclerosis: MAGNIFY‑MS. Neurol Neuroimmunol Neuroinflamm 2022; 9: e1187.
[3] De Stefano N, Achiron A, Barkhof F, et al. Early Onset of Action and Sustained Efficacy for MR Outcomes Over 2 Years of Cladribine Tablets Treatment for Highly Active Relapsing Multiple Sclerosis: Final Results of the MAGNIFY‑MS Study. ECTRIMS 2022; P717.
[4] Fernandez‑Diaz E, Romero‑Sanchez CM, Gracia‑Gil J, et al. Early MR activity predicts subsequent disease activity in multiple sclerosis patients treated with cladribine. ECTRIMS 2022; P766.
[5] Solari A, Montalban X, Lechner‑Scott J, et al. Improvements in Quality of Life Over 2 Years in Patients Treated With Cladribine Tablets for Highly Active Relapsing Multiple Sclerosis: Final Analysis of CLARIFY‑MS. ECTRIMS 2022; P108.
[6] Giovannoni G, Leist T, Jack D, et al. Updated Post‑Approval Safety of Cladribine Tablets in the Treatment of Multiple Sclerosis, With Particular Reference to Liver Safety. ECTRIMS 2022; P341.
[7] Ziemssen T, Posevitz‑Fejfar, Wagner T, et al. Treatment Related Adverse Events Experienced Early and Transiently in the Treatment Course with
Cladribine Tablets: Data from the CLEVER Real‑world Study. ECTRIMS 2022; P772.
[8] Leist T, Comi G, Cree B, et al. Effect of oral cladribine on time to conversion to clinically definite multiple sclerosis in patients with a first demyelinating event (ORACLE MS): A phase 3 randomised trial. Lancet Neurol 2014; 13: 257–267.
[9] Aerts S, Khan H, Severijns D, et al. A Real‑World Single‑Centre Analysis of the Safety and Efficacy of Cladribine Tablets for Relapsing Multiple Sclerosis. ECTRIMS 2022; EP1131.
[10] O’Neill DT, Sharma M, Dong G, et al. A real‑world study of four‑year follow up study of patients treated with oral cladribine from 2018–2022. ECTRIMS 2022; EP1132.
[11] Brownlee W, Amin A, Herbert A, Ashton L. Evaluating the Real‑World Prescribing Patterns of Cladribine Tablets in Patients With Multiple Sclerosis in England: The CLARENCE Study. ECTRIMS 2022; P762.
[12] Schiavetti I, Signoriello E, Frau J, et al. CladStop study group. Therapeutic choices and disease activity after the end of Cladribine treatment: an Italian multicenter study (CladStop). ECTRIMS 2022; O121.
[13] Oh J, Ayer M, Alroughani R, et al. High Adherence and Minimal Delays of Year 2 Treatment in People with Multiple Sclerosis Treated with Cladribine Tablets: Results from Multi‑Country Patient Support Programmes. ECTRIMS 2022; P727.
[14] Allen‑Philbey K, Andrews M, Redha I, et al. CLADRIPLAS: Does cladribine Target CNS plasma cells and reduce neuro‑axonal damage in people with MS? ECTRIMS 2022; EP0930.
[15] Øverås MH, Skattebøl LL, Lorentzen ÅR, et al. Norwegian prospective randomized open‑label blinded endpoint multicentre noninferiority study of oral cladribine and rituximab in multiple sclerosis (NOR‑MS) – baseline patient data. ECTRIMS 2022; EP1057.