Novinky v léčbě karcinomu prostaty
Souhrn:
Katolická J. Novinky v léčbě karcinomu prostaty. Remedia 2020; 30: 383–386.
Relugolix dosáhl rychlého a trvalého potlačení koncentrací testosteronu s 54% snížením rizika rozvoje závažných kardiovaskulárních příhod. Apalutamid, s následnou terapií, podaný již u metastatického hormonálně senzitivního karcinomu prostaty, pomáhá pacientům žít déle. Enzalutamid významně prodloužil celkové přežití oproti placebu u nemetastatického kastračně rezistentního karcinomu prostaty. Olaparib významně zlepšil přežití bez progrese u pacientů s genetickými změnami BRCA1, BRCA2 nebo ATM. CARD představuje první studii fáze III, která prokazuje přínos pro přežití u terapie třetí linie metastatického kastračně rezistentního karcinomu prostaty.
Summary:
Katolicka J. News in the treatment of prostate cancer. Remedia 2020; 30: 383–386.
Relugolix achieved rapid, sustained suppression of testosterone levels with a 54% lower risk of major adverse cardiovascular events. Apalutamide, with subsequent therapy, administered upfront in metastatic castration‑sensitive prostate cancer helps patients live longer. Enzalutamide significantly prolonged overall survival vs placebo in non‑metastatic castration‑resistant prostate cancer. Olaparib significantly improved progression‑free survival in patients with BRCA1, BRCA2, or ATM genetic alterations. CARD is the first phase III study to show a survival benefit for third‑line therapy in metastatic castration‑resistant prostate cancer.
Key words: relugolix, apalutamide, enzalutamide, olaparib, metastatic castration‑sensitive prostate cancer, CARD study, non‑metastatic castration‑resistant prostate cancer
Nádor prostaty je onemocněním mnoha stadií, od lokalizované choroby s dlouhodobou prognózou až po metastatický kastračně rezistentní karcinom, který představuje poslední fázi nemoci. S přibývajícími léčebnými možnostmi se takto nemocným mužům významně prodloužilo celkové přežití. Klinický onkolog má možnost využít nové léčebné postupy zejména u metastatických karcinomů.
Androgen deprivační léčba (ADT) pokročilého karcinomu prostaty
Kastrační léčba karcinomu prostaty probíhá chirurgicky (orchiektomie) nebo chemicky, injekčními agonisty nebo antagonisty LHRH (hormon uvolňující luteinizační hormon). Agonisté LHRH představují standardní léky pro dosažení androgenní deprivace u karcinomu prostaty navzdory počátečnímu vzestupu hodnoty testosteronu. Relugolix je tabletový selektivní antagonista receptoru gonadotropiny uvolňujícího hormonu (GnRHR).
Ve studii fáze III byli pacienti s pokročilým karcinomem prostaty randomizováni v poměru 2 : 1 k aplikaci relugolixu (120 mg perorálně jednou denně) nebo leuprolidu (injekce každé tři měsíce) po dobu 48 týdnů [1]. Primárním cílovým ukazatelem bylo trvalé potlačení koncentrace testosteronu na kastrační hodnotu (< 50 ng/dl) po dobu 48 týdnů. Sekundární cílové ukazatele zahrnovaly non inferioritu s ohledem na primární cíl, kastrační hodnoty testosteronu čtvrtý den a koncentrace testosteronu < 20 ng/dl v den 15. Celkem 622 pacientů dostávalo relugolix a 308 byl podáván leuprolid. Ve skupině mužů, kteří užívali relugolix, mělo kastrační hodnotu testosteronu po dobu 48 týdnů 96,7 % ve srovnání s 88,8 % mužů, kteří dostávali leuprolid. Rozdíl 7,9 procentního bodu (95% interval spolehlivosti [CI] 4,1‒11,8) ukázal non inferioritu a superioritu relugolixu (p < 0,001 pro superioritu). Všechny ostatní klíčové sekundární koncové body vykazovaly výhodu relugolixu nad leuprolidem (p < 0,001). Podíl pacientů s kastračními hodnotami testosteronu čtvrtý den činil 56,0 % s relugolixem a 0 % s leuprolidem. V podskupině 184 pacientů sledovaných po léčbě kvůli opětovnému navýšení koncentrace testosteronu byly jeho průměrné hodnoty 90 dní po ukončení terapie 288,4 ng/dl ve skupině s relugolixem a 58,6 ng/dl ve skupině s leuprolidem. Výskyt závažných nežádoucích kardiovaskulárních příhod činil 2,9 % ve skupině s relugolixem a 6,2 % ve skupině s leuprolidem (poměr rizik [HR] 0,46; 95% CI 0,24‒0,88).
Relugolix jako ADT pokročilého karcinomu prostaty v tabletové formě u mužů s pokročilým onemocněním dosáhl rychlého a trvalého potlačení hodnot testosteronu s 54% snížením rizika výskytu závažných kardiovaskulárních příhod.
Metastatický hormonálně senzitivní karcinom prostaty (mHSPC)
Do mezinárodní dvojitě zaslepené studie TITAN bylo zařazeno 1 052 pacientů s metastatickým hormonálně senzitivním karcinomem prostaty (metastatic hormone sensitive prostate cancer, mHSPC) bez ohledu na předchozí léčbu docetaxelem nebo na rozsah onemocnění [2]. Pacienti byli randomizováni k léčbě perorálním apalutamidem v dávce 240 mg jednou denně plus ADT nebo placebo v kombinaci s ADT až do progrese onemocnění, nepřijatelné toxicity nebo do ukončení léčby. Při průměrné době sledování 22,7 měsíce činila celková míra dvouletého přežití v rameni s apalutamidem 82,4 % vs. 73,5 % u pacientů, kteří dostávali ADT samotnou. Přidání apalutamidu k ADT snížilo riziko progrese nebo smrti (PFS2 [progression free survival] byl definován jako čas od zahájení první terapie apalutamidem do doby do progrese onemocnění nebo smrti při první následné terapii) o 34 % oproti samotnému ADT u pacientů s mHSPC. Mediánu celkového přežití (overall survival, OS) nebylo dosaženo ani v jednom rameni. Přidání apalutamidu také významně snížilo riziko radiologické progrese nebo smrti – o 52 %. Nová data uvádějí, že pokles rizika byl pozorován bez ohledu na první následnou terapii, kterou pacienti dostali ‒ tj. hormonální terapii nebo taxan [3]. Následně systémovou terapii karcinomu prostaty užívalo celkem 277 pacientů, z toho 87 bylo v rameni apalutamid plus ADT a 190 v rameni placebo plus ADT. Nová hormonální terapie byla první následnou terapií pro 24 pacientů v rameni s apalutamidem a pro 62 osob v kontrolním rameni. Terapie taxanem byla první následnou terapií u 30 pacientů v rameni s apalutamidem a u 69 osob v kontrolním rameni. Další systémové terapie byly podávány 33 pacientům v rameni s apalutamidem a 59 pacientům v kontrolním rameni. Ať už byla pacientům podána jakákoliv další následná terapie, ti, kteří byli ve studii TITAN časně léčeni apalutamidem, měli mnohem lepší výsledky. Významná výhoda apalutamidu byla pozorována pro druhou progresi onemocnění nebo případ úmrtí, a to v podobě 34% snížení jejich výskytu (p = 0,0026), které bylo konzistentní u pacientů následně léčených hormonální terapií (p = 0,326) nebo taxanem (p = 0,0062). Mediánu PFS2 nebylo dosaženo ani při podávání apalutamidu, ani placeba v každém z následujících léčebných ramen. Základní demografické charakteristiky a charakteristiky onemocnění byly podobné mezi oběma skupinami s následnou léčbou, tj. hormonálními přípravky nebo taxanem, včetně ECOG (skóre výkonnosti), Gleasonova skóre (stupeň diferenciace nádorů) při počáteční diagnóze, metastazování ve fázi diagnózy a střední hodnoty prostatického specifického antigenu (PSA) ve výchozím stavu. U pacientů, kteří byli již před zařazením do studie TITAN léčeni docetaxelem v hormonálně senzitivním prostředí, byla vyšší pravděpodobnost, že jako první následující terapii po selhání ADT +/‒ apalutamid obdrží novou hormonální terapii vs. terapii taxanem (20,9 % vs. 8,1 %).
Post hoc analýza studie fáze III TITAN u mHSPC doložila, že léčba apalutamidem plus ADT oddálila druhou progresi choroby nebo úmrtí bez ohledu na následnou terapii. Výsledky naznačují, že primární podání apalutamidu pomáhá pacientům žít déle.
Léčba nemetastatického kastračně rezistentního karcinomu prostaty (M0 CRPC)
Významného léčebného přínosu v této fázi kastračně rezistentního karcinomu prostaty (castrate resistant prostate cancer, M0 CRPC) bylo dosaženo podáním přípravků ARTA (androgen receptor targeted agents).
K dispozici máme aktualizovaná
data o léčbě enzalutamidem. Jeho účinnost byla sledována
v rámci studie fáze III PROSPER, která zkoumala použití
enzalutamidu u pacientů s nemetastatickým CRPC (nmCRPC)
[4], obrázek 1.
Zařazeni byli muži v dobrém klinickém stavu, s performance
status (PS) 0‒1, léčení ADT, s kastrační hodnotou
testosteronu, s alespoň třemi stoupajícími koncentracemi PSA
v minimálně týdenních intervalech, s časem
zdvojnásobení PSA 10 měsíců nebo méně a se
základní hodnotou PSA ≥ 2 ng/ml. Pacienti byli
rozděleni do podskupin založených na času zdvojnásobení
PSA (< 6 měsíců nebo ≥ 6 měsíců) a na základě
toho, zda byli léčeni antiosteoklastickým přípravkem. Primárním
cílovým ukazatelem bylo stanovení přežití bez metastáz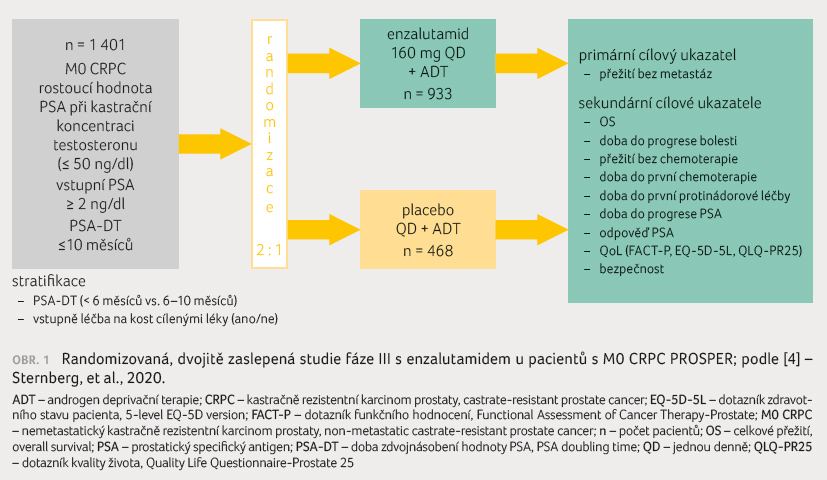 (metastasis free survival, MFS) nebo času do úmrtí
z jakékoliv příčiny. Sekundární cílové ukazatele
představovaly OS, čas do progrese PSA, míra odpovědi PSA
(definovaná jako snížení o více než 50 % od vstupní
hodnoty oproti vstupní hodnotě PSA), čas do první
chemoterapie, zhodnocení kvality života a bezpečnosti léčby.
V rámci hodnocení celkového přežití k říjnu 2019
zemřelo celkem 288 pacientů (31 %) ve skupině s léčbou
enzalutamidem a 178 (38 %) ve skupině s placebem.
Medián OS byl 67,0 měsíce (95% CI 64,0–nebylo dosaženo)
ve skupině s enzalutamidem a 56,3 měsíce (95% CI
54,4–63,0) ve skupině s placebem (HR 0,73; 95% CI
0,61–0,89; p = 0,001).
Protože byla překročena předem definovaná hranice významnosti,
stala se analýza konečnou analýzou. Toto hodnocení ukázalo, že
OS za tři roky činilo 80 % vs. 73 %. Přínos enzalutamidu
byl obecně konzistentní ve všech předdefinovaných
podskupinách, s možnou výjimkou malé skupiny pacientů,
kteří dostávali látky šetřící kosti. Medián doby do prvního
použití nové antineoplastické terapie byl 66,7 měsíce
oproti 19,1 měsíce (HR 0,29; 95% CI 0,25–0,35). Celkem
87 pacientů ve skupině s placebem přešlo
na enzalutamid (po odslepení studie), se střední dobou
léčby 14,5 měsíce po křížení. Po vyloučení
těchto pacientů bylo alespoň jednou následnou terapií,
po ukončení studijní medikace, léčeno 33 % osob
z enzalutamidové skupiny a 56 % osob (84 %, včetně
pacientů s křížením) z placebové terapie.
Nejběžnějšími terapeutickými látkami u těch, kteří
zahájili novou léčbu, byly abirateron acetát (49 % a 59 %),
docetaxel (60 % a 47 %) a enzalutamid (14 % a 36 %,
bez pacientů s křížením). Střední doba trvání studie
činila 33,9 měsíce ve skupině s enzalutamidem
a 14,2 měsíce ve skupině s placebem. Četnost
výskytu nežádoucích účinků stupně ≥ 3 činila
17/100 pacientů ve skupině s enzalutamidem oproti
20/100 pacientů ve skupině s placebem. Nežádoucí
účinky ve skupině s enzalutamidem byly shodné s těmi,
které byly dříve hlášeny, přičemž k nejčastějším
patřily únava a muskuloskeletální příhody. Nežádoucí
příhody zvláštního zájmu, které se vyskytly s četností ≥ 3
události/100 pacientů, byly ve větším počtu zaznamenány
ve skupině s enzalutamidem, a to pády (9 vs. 4)
a zlomeniny (9 vs. 5). Kardiovaskulární nežádoucí účinky
představovaly nejčastěji hlášené nežádoucí příhody vedoucí
k úmrtí ‒ 14 nemocných (2 %) oproti dvěma pacientům
(< 1 %). Léčba enzalutamidem v kombinaci s ADT
vedla k delšímu průměrnému OS než kombinace placebo plus
ADT u mužů s nmCRPC s rychle rostoucí hodnotou PSA.
Riziko úmrtí spojené s enzalutamidem bylo o 27 % nižší
než u placeba. Nežádoucí účinky byly v souladu se
zavedeným bezpečnostním profilem enzalutamidu.
(metastasis free survival, MFS) nebo času do úmrtí
z jakékoliv příčiny. Sekundární cílové ukazatele
představovaly OS, čas do progrese PSA, míra odpovědi PSA
(definovaná jako snížení o více než 50 % od vstupní
hodnoty oproti vstupní hodnotě PSA), čas do první
chemoterapie, zhodnocení kvality života a bezpečnosti léčby.
V rámci hodnocení celkového přežití k říjnu 2019
zemřelo celkem 288 pacientů (31 %) ve skupině s léčbou
enzalutamidem a 178 (38 %) ve skupině s placebem.
Medián OS byl 67,0 měsíce (95% CI 64,0–nebylo dosaženo)
ve skupině s enzalutamidem a 56,3 měsíce (95% CI
54,4–63,0) ve skupině s placebem (HR 0,73; 95% CI
0,61–0,89; p = 0,001).
Protože byla překročena předem definovaná hranice významnosti,
stala se analýza konečnou analýzou. Toto hodnocení ukázalo, že
OS za tři roky činilo 80 % vs. 73 %. Přínos enzalutamidu
byl obecně konzistentní ve všech předdefinovaných
podskupinách, s možnou výjimkou malé skupiny pacientů,
kteří dostávali látky šetřící kosti. Medián doby do prvního
použití nové antineoplastické terapie byl 66,7 měsíce
oproti 19,1 měsíce (HR 0,29; 95% CI 0,25–0,35). Celkem
87 pacientů ve skupině s placebem přešlo
na enzalutamid (po odslepení studie), se střední dobou
léčby 14,5 měsíce po křížení. Po vyloučení
těchto pacientů bylo alespoň jednou následnou terapií,
po ukončení studijní medikace, léčeno 33 % osob
z enzalutamidové skupiny a 56 % osob (84 %, včetně
pacientů s křížením) z placebové terapie.
Nejběžnějšími terapeutickými látkami u těch, kteří
zahájili novou léčbu, byly abirateron acetát (49 % a 59 %),
docetaxel (60 % a 47 %) a enzalutamid (14 % a 36 %,
bez pacientů s křížením). Střední doba trvání studie
činila 33,9 měsíce ve skupině s enzalutamidem
a 14,2 měsíce ve skupině s placebem. Četnost
výskytu nežádoucích účinků stupně ≥ 3 činila
17/100 pacientů ve skupině s enzalutamidem oproti
20/100 pacientů ve skupině s placebem. Nežádoucí
účinky ve skupině s enzalutamidem byly shodné s těmi,
které byly dříve hlášeny, přičemž k nejčastějším
patřily únava a muskuloskeletální příhody. Nežádoucí
příhody zvláštního zájmu, které se vyskytly s četností ≥ 3
události/100 pacientů, byly ve větším počtu zaznamenány
ve skupině s enzalutamidem, a to pády (9 vs. 4)
a zlomeniny (9 vs. 5). Kardiovaskulární nežádoucí účinky
představovaly nejčastěji hlášené nežádoucí příhody vedoucí
k úmrtí ‒ 14 nemocných (2 %) oproti dvěma pacientům
(< 1 %). Léčba enzalutamidem v kombinaci s ADT
vedla k delšímu průměrnému OS než kombinace placebo plus
ADT u mužů s nmCRPC s rychle rostoucí hodnotou PSA.
Riziko úmrtí spojené s enzalutamidem bylo o 27 % nižší
než u placeba. Nežádoucí účinky byly v souladu se
zavedeným bezpečnostním profilem enzalutamidu.
Aktualizovaná data o enzalutamidu v léčbě M0 CPRC prokázala, že enzalutamid ve srovnání s placebem signifikantně prodloužil OS. Medián OS činil 67,0 měsíce pro enzalutamid vs. 56,3 měsíce pro placebo.
Léčba pacientů s metastatickým kastračně rezistentním karcinomem prostaty a genetickými změnami
Karcinom prostaty s mutací genu BRCA2 se vyskytuje u mužů v mladším věku, je častěji agresivnější a je spojen s horší prognózou, s vyšším rizikem rekurence a s horším přežíváním. Výsledky studií prokazují zvýšené riziko i u nosičů mutací v genu BRCA1 [5].
Do studie PROfound byli zařazeni muži s metastatickým kastračně rezistentním karcinomem prostaty (metastatic castration resistant prostate cancer, mCRPC), jejichž onemocnění progredovalo během léčby enzalutamidem nebo abirateronem [6]. Pacienti byli rozděleni do dvou kohort na základě stavu mutace genu HRR. Pacienti s mutacemi v BRCA1, BRCA2 nebo ATM byli náhodně přiřazeni do kohorty A (n = 245); pacienti s mutacemi mezi 12 dalšími geny zapojenými do dráhy HRR byli náhodně přiřazeni do kohorty B (n = 142); nemocní s komutacemi (gen kohorty A a gen kohorty B) byli přiřazeni do kohorty A. V období mezi dubnem 2017 a listopadem 2018 byli pacienti randomizováni do dvou kohort v poměru 2 : 1, aby dostávali buď olaparib v dávce 300 mg dvakrát denně, nebo enzalutamid v dávce 160 mg jednou denně, nebo abirateron v dávce 1 000 mg jednou denně plus prednison v dávce 5 mg dvakrát denně. Kohorta A zahrnovala 162 pacientů ve skupině s olaparibem a 83 osob v kontrolní skupině. Kohorta B zahrnovala 94 pacientů v rameni s olaparibem a 48 osob v kontrolní skupině. Primárním cílovým ukazatelem bylo PFS v kohortě A. Mezi hlavní cílové ukazatele patřilo přežití bez radiologické progrese (rPFS, kohorta A). Mezi další hodnocení účinnosti patřila míra objektivní odpovědi (kohorta A) u pacientů s měřitelným onemocněním, rPFS pro kombinovanou kohortu A a B a OS (kohorta A). Statisticky významné zlepšení bylo prokázáno pro olaparib v kohortě A pro rPFS, s mediánem 7,4 měsíce vs. 3,6 měsíce (HR 0,34; 95% CI 0,25–0,47; p < 0,0001). Statisticky významné zlepšení bylo rovněž doloženo pro OS, s mediánem 19,1 měsíce vs. 14,7 měsíce (HR 0,69; 95% CI 0,50–0,97; p = 0,0175) a pro objektivní míru odpovědi: 33 % vs. 2 % (p < 0,0001). Statisticky významné zlepšení pro olaparib ve srovnání s výběrem zkoušejícího bylo též prokázáno pro rPFS v kombinovaných kohortách A a B, s mediánem 5,8 měsíce oproti 3,5 měsíce (HR 0,49; 95% CI 0,38–0,63; p < 0,0001). Po šesti měsících zůstávalo 85 % vs. 75 % pacientů bez progrese bolesti. Celkem 82 % pacientů v kontrolní skupině přešlo na léčbu olaparibem po potvrzené progresi onemocnění. Nejčastějšími nežádoucími účinky olaparibu (≥ 10 % pacientů) byly anémie, nauzea, únava (včetně astenie), snížená chuť k jídlu, průjem, zvracení, trombocytopenie, kašel a dušnost. Žilní tromboembolické příhody, včetně plicní embolie, se vyskytly u 7 % pacientů v rameni s olaparibem ve srovnání s 3,1 % pacientů, kteří dostávali enzalutamid nebo abirateron. Nežádoucí účinky stupně ≥ 3 se objevily u 51 % pacientů ve skupině s olaparibem oproti 38 % u kontrolní skupiny, přičemž nejčastější ve skupině s olaparibem byla anémie (21 %). Nebyly hlášeny žádné fatální případy a nebyly pozorovány žádné případy výskytu myelodysplastických syndromů nebo akutní myeloidní leukemie.
Olaparib v léčbě pacientů s mCRPC s genetickými změnami BRCA1, BRCA2 nebo ATM významně zlepšil PFS.
Sekvenční léčba metastatického kastračně rezistentního karcinomu prostaty
Možnosti terapie mCRPC v posledních letech významně vzrostly. Ukázalo se, že kombinovaná léčba nemá v této fázi choroby velký přínos. Opakem je léčba sekvenční.
Multicentrická studie CARD
(Randomized, Open Label Study of Cabazitaxel
vs Abiraterone or Enzalutamide in Metastatic Castration Resistant
Prostate Cancer) zahrnovala muže s mCRPC, u nichž
došlo k progresi choroby během 12 měsíců po léčbě
enzalutamidem nebo abirateronem, před léčbou nebo po léčbě
docetaxelem [7]. V závislosti na tom, kterým inhibitorem
androgenního receptoru byli muži předem léčeni, byli
randomizováni k podání kabazitaxelu plus prednisonu (n = 129)
nebo abirateronu plus prednisonu nebo enzalutamidu (n = 126),
obrázek 2.
Charakteristiky pacientů byly mezi oběma léčebnými skupinami
dobře vyvážené. Střední věk činil 70 let a asi 30 %
mužů bylo ve věku 75 a více let. Dvě třetiny pacientů
měly při vstupu do studie bolesti. Předchozí výběr
inhibitoru ARTA a sekvence s docetaxelem (před léčbou
nebo po léčbě) byly rovnoměrně rozděleny a srovnatelné
mezi rameny při randomizaci. Střední doba předchozí léčby
enzalutamidem nebo abirateronem činila 7,5 měsíce. Střední
doba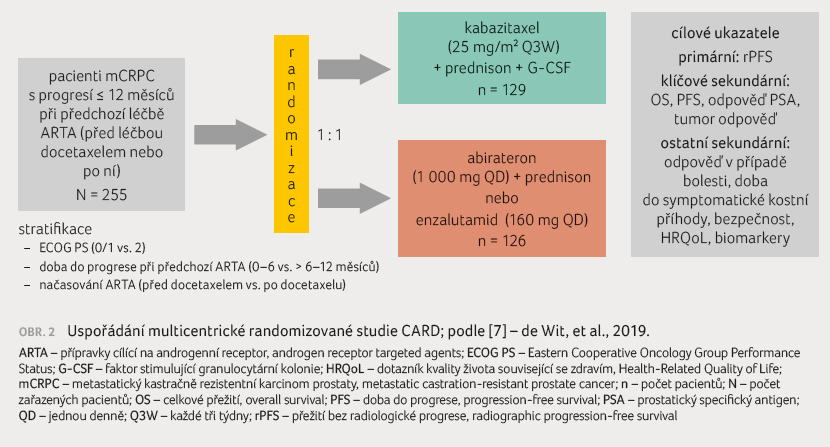 trvání studie byla 22 týdnů u léčených kabazitaxelem
oproti 12,5 týdne v kontrolní skupině. Více pacientů
v kontrolní skupině přerušilo léčbu z důvodu
progrese onemocnění (71 % vs. 43,7 % v kabazitaxelové
skupině). Přerušení léčby bylo hlášeno kvůli nežádoucím
účinkům v rameni kabazitaxelu v 19,8 % vs. 8,9 %
u kontrol, částečně také v souvislosti s delší
expozicí. V primární analýze kabazitaxel snížil riziko
progrese radiografického onemocnění o 46 % ve srovnání
s kontrolami (p < 0,0001).
Střední doba přežití bez radiografické progrese činila 8,0
měsíce u kabazitaxelu oproti 3,7 měsíce u abirateronu
nebo enzalutamidu. Předběžná analýza ukázala, že všechny
podskupiny s kabazitaxelem měly konzistentní PFS. Medián OS
představoval 13,6 měsíce u kabazitaxelu a 11 měsíců
u abirateronu nebo enzalutamidu. Nebylo zjištěno, že by
pacienti, kteří dostávali docetaxel mezi dvěma liniemi
abirateronu a enzalutamidu, prospívali lépe. Analýza ukázala,
že na sekvenci inhibitorů ARTA nezáleží; poměr rizika pro
sekvenci enzalutamidu po abirateronu a docetaxelu byl 0,57.
Hodnocení PFS, objektivních odpovědí a ovlivnění bolesti
upřednostňuje kabazitaxel. Potvrzená odpověď PSA byla pozorována
u 35,7 % léčených v kabazitaxelové skupině
oproti 13,5 % u kontrol (p = 0,0002).
Objektivní míra odpovědi byla 36,5 % oproti 11,5 %
(p = 0,004),
míra odezvy na bolest 45 % vs. 19,3 % (p < 0,0001)
a mediánu času do symptomatické kostní příhody nebylo
dosaženo vs. 16,7 měsíce (p = 0,05).
Četnost výskytu nežádoucích účinků stupně 3 nebo
vyššího a závažných nežádoucích účinků byla v obou
léčebných ramenech podobná. Úmrtí bylo způsobeno hlavně
progresí onemocnění. Četnost výskytu infekce stupně 3 nebo
vyššího činila 7 % v obou ramenech; febrilní neutropenie
se vyskytla u 3,2 % v rameni s kabazitaxelem oproti
0 % u kontrol. Všem pacientům, jimž byl podáván
kabazitaxel, byl preventivně aplikován faktor stimulující
granulocytární kolonie (G CSF). Je to
poprvé, co je v randomizované studii vidět přínos pro
přežití po léčbě třetí linie. Jsou to nové informace
podporující kabazitaxel jako léčbu třetí linie po terapii
docetaxelem a přípravky ARTA pro pacienty v dobrém stavu
s progresivním onemocněním (po předchozí léčbě
abirateronem nebo enzalutamidem s odpovědí do 12 měsíců).
trvání studie byla 22 týdnů u léčených kabazitaxelem
oproti 12,5 týdne v kontrolní skupině. Více pacientů
v kontrolní skupině přerušilo léčbu z důvodu
progrese onemocnění (71 % vs. 43,7 % v kabazitaxelové
skupině). Přerušení léčby bylo hlášeno kvůli nežádoucím
účinkům v rameni kabazitaxelu v 19,8 % vs. 8,9 %
u kontrol, částečně také v souvislosti s delší
expozicí. V primární analýze kabazitaxel snížil riziko
progrese radiografického onemocnění o 46 % ve srovnání
s kontrolami (p < 0,0001).
Střední doba přežití bez radiografické progrese činila 8,0
měsíce u kabazitaxelu oproti 3,7 měsíce u abirateronu
nebo enzalutamidu. Předběžná analýza ukázala, že všechny
podskupiny s kabazitaxelem měly konzistentní PFS. Medián OS
představoval 13,6 měsíce u kabazitaxelu a 11 měsíců
u abirateronu nebo enzalutamidu. Nebylo zjištěno, že by
pacienti, kteří dostávali docetaxel mezi dvěma liniemi
abirateronu a enzalutamidu, prospívali lépe. Analýza ukázala,
že na sekvenci inhibitorů ARTA nezáleží; poměr rizika pro
sekvenci enzalutamidu po abirateronu a docetaxelu byl 0,57.
Hodnocení PFS, objektivních odpovědí a ovlivnění bolesti
upřednostňuje kabazitaxel. Potvrzená odpověď PSA byla pozorována
u 35,7 % léčených v kabazitaxelové skupině
oproti 13,5 % u kontrol (p = 0,0002).
Objektivní míra odpovědi byla 36,5 % oproti 11,5 %
(p = 0,004),
míra odezvy na bolest 45 % vs. 19,3 % (p < 0,0001)
a mediánu času do symptomatické kostní příhody nebylo
dosaženo vs. 16,7 měsíce (p = 0,05).
Četnost výskytu nežádoucích účinků stupně 3 nebo
vyššího a závažných nežádoucích účinků byla v obou
léčebných ramenech podobná. Úmrtí bylo způsobeno hlavně
progresí onemocnění. Četnost výskytu infekce stupně 3 nebo
vyššího činila 7 % v obou ramenech; febrilní neutropenie
se vyskytla u 3,2 % v rameni s kabazitaxelem oproti
0 % u kontrol. Všem pacientům, jimž byl podáván
kabazitaxel, byl preventivně aplikován faktor stimulující
granulocytární kolonie (G CSF). Je to
poprvé, co je v randomizované studii vidět přínos pro
přežití po léčbě třetí linie. Jsou to nové informace
podporující kabazitaxel jako léčbu třetí linie po terapii
docetaxelem a přípravky ARTA pro pacienty v dobrém stavu
s progresivním onemocněním (po předchozí léčbě
abirateronem nebo enzalutamidem s odpovědí do 12 měsíců).
V rámci sekvenční léčby mCRPC studie CARD potvrdila, že kabazitaxel by měl být podáván jako terapie třetí linie po docetaxelu a abirateronu nebo enzalutamidu u mužů s mCRPC, kteří jsou vhodní pro chemoterapii. Kabazitaxel prodloužil přežití jako terapie třetí linie. CARD je první studií fáze III, která v prostředí mCRPC prokazuje přínos pro přežití pro terapii třetí linie. Zdá se, že na sekvenci abirateronu nebo enzalutamidu nezáleží.
Závěr
Na základě výše uvedených poznatků lze odpovědně potvrdit, že nové možnosti léčby metastatického karcinomu prostaty významně prodlužují přežití takto nemocných mužů s nízkou frekvencí toxicity a s dobrou kvalitou života.
Seznam použité literatury
- [1] Shore ND, Saad F, Cookson MS, et al. Oral Relugolix for Androgen‑Deprivation Therapy in Advanced Prostate Cancer. N Engl J Med 2020; 382: 2187‒2196.
- [2] Agarwal N, Mcquarrie K, Bjartell A, et al. Patient‑reported outcomes (PROs) from TITAN: A phase 3, randomized, double‑blind study of apalutamide (APA) versus placebo (PBO) added to androgen deprivation therapy (ADT) in patients (pts) with metastatic castration‑sensitive prostate cancer (mCSPC). Ann Oncol 2019; 30(Suppl 5): 330‒331.
- [3] Chi KN, Agarwal N, Bjartell A, et al; TITAN Investigators. Apalutamide for metastatic, castration‑sensitive prostate cancer. N Engl J Med 2019; 381: 13‒24.
- [4] Sternbegr CN, Fizazi K, Saad F, et al. Enzalutamide and Survival in Nonmetastatic, Castration‑Resistant Prostate Cancer. N Engl J Med 2020; 382: 2197‒2206.
- [5] Plevová P, Hladíková A. Genetické poradenství u mužů nosičů mutací v genech BRCA1 a BRCA2. Klin Onkol 2012; 25(Suppl): S67– S73.
- [6] de Bono J, Mateo J, Fizazi K, et al. Olaparib for Metastatic Castration‑Resistant Prostate Cancer. N Engl J Med 2020; 382: 2091‒2102.
- [7] de Wit R, de Bono J, Sternberg CN, et al. Cabazitaxel versus Abiraterone or Enzalutamide in Metastatic Prostate Cancer. N Engl J Med 2019; 381: 2506‒2518.