Novinky v systémové léčbě hepatocelulárního karcinomu
Souhrn:
omášek J. Novinky v systémové léčbě hepatocelulárního karcinomu. Remedia 2020; 30: 387–390.
Po deset let byl jediným účinným lékem systémové léčby hepatocelulárního karcinomu sorafenib. Nově lze v první linii použít jako alternativu lenvatinib, který je proti sorafenibu non‑inferiorní v parametru celkového přežití, ale má statisticky a klinicky významně vyšší míru léčebných odpovědí. Významné prodloužení celkového přežití přináší v první linii léčby hepatocelulárního karcinomu kombinační léčba atezolizumabem plus bevacizumabem. Ve druhé linii po selhání sorafenibu lze použít regorafenib, kabozantinib a ramucirumab.
Summary:
Tomasek J. News in systemic treatment of hepatocellular carcinoma. Remedia 2020; 30: 387–390.
Sorafenib was the only effective drug for systemic hepatocellular carcinoma treatment for 10 years. Lenvatinib is non‑inferior to sorafenib in overall survival. Lenvatinib has a statistically significant and clinically meaningful higher response rate. First line treatment with atezolizumab plus bevacizumab is associated with significantly better overall survival and progression‑free survival than sorafenib. Regorafenib, cabozantinib and ramucirumab can be used in second line in patients with advanced hepatocellular carcinoma who had been previously treated with sorafenib.
Key words: hepatocellular carcinoma, targeted therapy, immunotherapy
Algoritmus
léčby hepatocelulárního karcinomu
Hepatocelulární karcinom
(hepatocellular carcinoma, HCC) má oproti jiným solidním nádorům
některá specifika. Pro stanovení léčebného postupu je nutné
znát kromě rozsahu nádoru (TNM klasifikace zhoubných novotvarů)
a výkonnostního stavu pacienta (Eastern Cooperative Oncology
Group Performance Status, ECOG PS) také funkční stav jater
(Childova–Pughova klasifikace). Algoritmus léčby na základě
těchto parametrů popisuje široce používaná Barcelonská
klasifikace BCLC (Barcelona Clinic Liver Cancer staging system).
Tento systém dělí pacienty do stadií 0, A, B, C, D
a popisuje prognózu jednotlivých stadií onemocnění a vhodné
možnosti léčby (obr. 1)
[1]. Je nutné si uvědomit rozdíl mezi stadiem nádoru podle
klasifikace TNM a podle klasifikace BCLC. Pro časná stadia
(BCLC 0, A) onemocnění je vhodná léčba chirurgická, včetně
transplantace jater a ablační metody, pro pokročilejší
stadium B (víceložiskové postižení jater) je doporučována
transarteriální chemoembolizace (transcatheter arterial
chemoembolization, TACE). Systémová léčba je doporučována pro
stadium C, ale lze ji podat i u časnějších stadií,
pokud není možné indikovat léčbu lokální. V systémové
léčbě dochází v současné době k významnému
pokroku. Byly registrovány nové léky a lékové kombinace pro
první linii léčby a máme několik možností léčby také
v liniích následných. Ve stručném přehledu shrneme
možnosti systémové léčby HCC.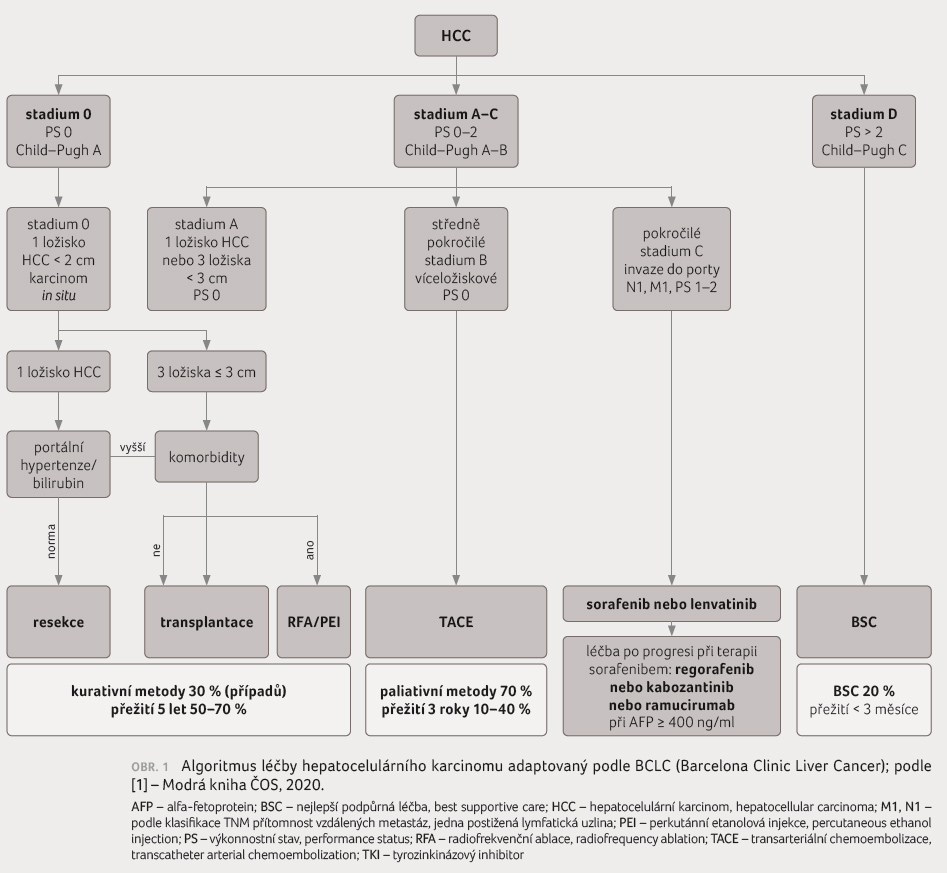
Je vhodné upozornit na problematiku hodnocení léčebné odpovědi při terapii HCC. Pro radiologické hodnocení bylo pro potřebu klinických studií vyvinuto několik systémů hodnocení. Kritéria RECIST (Response Evaluation Criteria in Solid Tumours) 1.1 se používají pro hodnocení systémové léčby většiny solidních nádorů, pro regionální léčbu jaterních nádorů jsou používána kritéria mRECIST, která berou v úvahu, že po ablaci nebo TACE není část nádoru, která je ošetřena, nádorem vitálním, pro imunoterapii byla vyvinuta kritéria iRECIST. Problém nastává v okamžiku, kdy je pacient léčen ablační metodou a následně cílenou léčbou třeba v kombinaci s imunoterapií. Je nezbytná úzká spolupráce a komunikace onkologa s radiodiagnostikem.
První
linie léčby hepatocelulárního karcinomu
Tyrozinkinázový inhibitor (TKI) sorafenib se stal v roce 2008 na základě studie Sharp na více než 10 let standardem systémové léčby pokročilého HCC podle všech respektovaných mezinárodních doporučení. Ve srovnání s placebem sorafenib prodloužil celkové přežití (overall survival [OS] 10,7 měsíce vs. 7,9 měsíce; poměr rizik [HR] 0,69; p < 0,001) u pacientů BCLC stadia C a stadia B, kteří nebyli vhodní pro regionální léčbu nebo u kterých při takové léčbě došlo k progresi [2]. Další úspěšné studie s novými léky v této indikaci byly publikovány až po dalších 10 letech.
Lenvatinib
Lenvatinib je perorální TKI, který ovlivňuje mimo jiné receptory vaskulárního endotelového růstového faktoru (VEGFR) 1–3 a receptory pro fibroblastový růstový faktor (FGFR) 1–4. V randomizované studii fáze III REFLECT byla prokázána non inferiorita lenvatinibu oproti sorafenibu v parametru OS, primárním cílovém ukazateli studie (13,6 měsíce vs. 12,3 měsíce; HR 0,92; 95% interval spolehlivosti [CI] 0,79–1,06). Významně lepší byly výsledky lenvatinibu ve všech sekundárních cílových ukazatelích. Pro praxi je důležitá především vysoká míra léčebných odpovědí (objective response rate, ORR). Podle hodnocení nezávislé komise činila ORR podle mRECIST 40,6 % vs. 12,6 %, stejný parametr měřený investigátory činil 24,1 % vs. 9,2 %. Tento parametr je v praxi důležitý v případě, že nádor svým tlakem nebo prorůstáním působí symptomy nebo pokud by byla možná při regresi nádoru nějaká další lokální terapie. Statisticky lepší byly výsledky lenvatinibu oproti sorafenibu také v parametru přežití bez progrese (progression free survival, PFS – 7,3 měsíce vs. 3,6 měsíce; HR 0,64; 95% CI 0,55–0,75; p < 0,0001). Doporučená denní dávka lenvatinibu je 8 mg (dvě 4mg tobolky) jednou denně u pacientů s tělesnou hmotností < 60 kg a 12 mg (tři 4mg tobolky) jednou denně u pacientů s tělesnou hmotností ≥ 60 kg. Spektrum nežádoucích účinků u lenvatinibu se zásadně neliší od ostatních TKI. Ve studii REFLECT byly zaznamenány arteriální hypertenze, průjem, snížení chuti k jídlu a snížení hmotnosti; hand foot syndrom ve srovnání se sorafenibem vzniká méně častěji. Podle potřeby lze v případě přetrvávající nebo špatně tolerované toxicity stupně 2–3 dávku lenvatinibu redukovat po 4 mg, minimální doporučená dávka je 4 mg obden.
Kombinace atezolizumabu a bevacizumabu
Nádorový růst HCC je ovlivněn řadou mechanismů, jimiž nádorové buňky unikají imunitnímu dohledu. Jedním z těchto mechanismů je overexprese VEGF, která vede k nádorovému růstu a imunosupresivnímu působení v nádoru a jeho mikroprostředí. Blokáda signální dráhy VEGF může blokovat tento imunosupresivní účinek a potencovat účinek inhibitoru programované buněčné smrti a jeho ligandu (PD 1 a PD L1) [3,4].
Zásadní posun v léčbě HCC přinášejí výsledky studie IMbrave 150, která prokázala, že kombinace atezolizumabu a bevacizumabu prodlužuje OS i PFS u významné části pacientů s pokročilým HCC. Atezolizumab je inhibitor PD L1, patří mezi léky moderní imunoterapie. Bevacizumab je monoklonální protilátka proti VEGF, která je řadu let součástí protokolů léčby řady solidních nádorů. IMbrave je randomizovaná otevřená studie fáze III, která porovnávala účinnost kombinace bevacizumabu s atezolizumabem oproti sorafenibu, randomizace byla v poměru 2 : 1. Do studie byli zařazováni pacienti s lokálně pokročilým nebo metastatickým HCC, kteří nebyli doposud předléčeni systémovou léčbou. Pacienti nesměli být vhodní pro lokoregionální terapii nebo u nich při takové léčbě došlo k progresi. V případě jaterní cirhózy byla pro stanovení diagnózy HCC dostatečná radiologická kritéria bez nutnosti biopsie. Další podmínkou byl dobrý výkonnostní stav (ECOG PS 0–1) a zachovalá jaterní funkce (Child–Pugh A). Kontraindikaci představovaly stavy, které obecně kontraindikují antiangiogenní léčbu a imunoterapii (anamnéza významného autoimunitního onemocnění, aktivní virová hepatitida B nebo C, jícnové a žaludeční varixy s rizikem krvácení). Studie měla dva primární cílové ukazatele: OS a PFS. Kritérium ORR hodnocené nezávislou komisí a bezpečnostní parametry patřily k sekundárním cílovým ukazatelům. Hodnoceno bylo celkem 336 pacientů v rameni s atezolizumabem a bevacizumabem a 165 pacientů v rameni se sorafenibem. Doporučená dávka atezolizumabu činila 1 200 mg i.v. s opakováním jednou za tři týdny, dávka bevacizumabu činila 15 mg/kg i.v. ve stejném intervalu. Sorafenib byl podáván v obvyklé dávce 400 mg dvakrát denně p.o. Výsledky studie byly publikovány v květnu 2020, byly splněny oba primární cíle studie – OS i PFS. Mediánu OS v rameni s atezolizumabem/bevacizumabem nebylo zatím dosaženo, OS v rameni se sorafenibem byl 13,2 měsíce (HR 0,58; 95% CI 0,42–0,79; p < 0,001), 12měsíční OS 67,2 % vs. 54,6 %. Medián PFS činil 6,8 měsíce vs. 4,3 měsíce (HR 0,59; 95% CI 0,47–0,76; p < 0,001), ORR podle mRECIST 33,2 % vs. 13,3 % (p < 0,001). K nejčastějším nežádoucím účinkům kombinace atezolizumabu s bevacizumabem patřily arteriální hypertenze, slabost, proteinurie, pruritus, exantém, průjem, zácpa, nechutenství, nevolnost, bolesti břicha a kašel. Podíl nežádoucích příhod stupně 3–4 byl v obou ramenech obdobný – 56,5 % vs. 55,1 %, stejně tak stupně 5 – 4,6 % vs. 5,8 %. Vynikající výsledky studie IMbrave 150 vedly k zařazení kombinace atezolizumabu s bevacizumabem do aktualizovaných doporučení ESMO (European Society for Medical Oncology) [5] pro léčbu HCC v první linii systémové terapie a stejně tak do doporučení NCCN 5.2020 (National Comprehensive Cancer Network) pro léčbu HCC [6].
Druhá
linie léčby hepatocelulárního karcinomu
Regorafenib
Regorafenib představuje TKI blokující řadu kináz, byl vyvinut v rámci programu, který testoval molekuly příbuzné sorafenibu. Je již zařazen do běžné praxe jako lék pro druhou linii systémové léčby pokročilého HCC po předléčení sorafenibem. Pro léčbu HCC byl registrován na základě pozitivního výsledku randomizované klinické studie fáze III RESORCE, do níž byli zařazováni pacienti s pokročilým HCC s dokumentovanou progresí při léčbě sorafenibem [7]. Předpokladem pro zařazení do studie byla zachovalá jaterní funkce (Child–Pugh A) a dobrý výkonnostní stav. Randomizace do ramene s regorafenibem nebo placebem byla v poměru 2 : 1. Regorafenib byl podáván v dávce 160 mg p.o. jednou denně celkem tři týdny s následující týdenní pauzou, jeden cyklus tak trval čtyři týdny. Primárním cílovým ukazatelem studie bylo OS a tento cíl byl splněn. Medián OS dosahoval 10,6 měsíce v rameni s regorafenibem oproti 7,8 měsíce při podávání placeba, došlo tak k signifikantní redukci rizika smrti o 37 % (HR 0,63; 95% CI 0,50–0,79; p < 0,0001), také PFS bylo signifikantně delší při léčbě regorafenibem: 3,1 měsíce vs. 1,5 měsíce (HR 0,46; p < 0,001). Kontroly nemoci bylo dosaženo častěji při léčbě regorafenibem: 65,2 % vs. 36,1 % (p < 0,001), stejně tak kompletní nebo parciální odpovědi: 10,6 % vs. 4,1 % (p = 0,01). Nejčastějšími nežádoucími účinky stupně 3 a vyššího byly arteriální hypertenze, hand foot syndrom, slabost a průjem. Proti dosavadním zkušenostem s regorafenibem v jiných indikacích nebyla zaznamenána žádná nová významná toxicita.
Kabozantinib
Kabozantinib je další moderní TKI, který má v léčbě HCC obdobnou indikaci jako regorafenib. Jeho účinnost ve druhé linii systémové léčby HCC u pacientů předléčených sorafenibem byla prokázána v klinické studii fáze III CELESTIAL, jež byla rovněž kontrolována placebem a randomizační poměr činil 2 : 1 [8]. Indikační kritéria byla oproti studii s regorafenibem mírně odlišná, zařazeni byli také pacienti, kteří netolerovali sorafenib a byli předléčeni jednou nebo dvěma liniemi systémové léčby. Kabozantinib byl podáván v dávce 60 mg p.o. denně. Primární cíl studie – OS – byl splněn: 10,2 měsíce versus 8,0 měsíce (HR 0,76; 95% CI 0,63–0,92; p = 0,0049). Statisticky signifikantní a klinicky relevantní rozdíl byl též v parametru PFS – 5,2 měsíce vs. 1,9 měsíce (HR 0,44; 95% CI 0,36–0,52; p < 0,0001). Kontroly nemoci bylo dosaženo častěji v rameni s kabozantinibem – 64 % vs. 33,4 %. Bezpečnostní profil kabozantinibu byl obdobný jako při jeho použití v jiných indikacích: hand foot syndrom, arteriální hypertenze, únava, průjem, astenie, nechutenství, anémie, elevace hodnoty aspartátaminotransferázy.
Ramucirumab
Ramucirumab je humánní monoklonální protilátka, která se specificky váže na receptor 2. typu pro VEGFR – VEGFR2. Ramucirumab byl testován proti placebu ve druhé linii léčby pokročilého HCC ve studii fáze III REACH, kde v celkové populaci nebylo dosaženo signifikantního rozdílu v OS, rozdíl byl ale patrný v podskupině pacientů s elevací hodnot alfa fetoproteinu (AFP) ≥ 400 ng/ml. Do následné studie fáze III REACH 2 byli zařazováni pacienti s progresí při léčbě sorafenibem a s elevací AFP nad tuto hodnotu. Primární cíl byl splněn, došlo ke zlepšení OS – 7,3 měsíce vs. 8,5 měsíce (HR 0,710; 95% CI 0,531–0,949; p = 0,0199) – a PFS – 1,6 měsíce vs. 2,8 měsíce (HR 0,452; 95% CI 0,339–0,603; p < 0,0001). Bezpečnostní profil byl příznivý, obdobný, jak ho známe u ramucirumabu v jiných indikacích.
Závěr
Pokrok v systémové léčbě HCC se projevuje prodloužením OS pacientů. Toto přežití může být u významné skupiny pacientů srovnatelné s přežíváním pacientů stadia BCLC B, kteří jsou léčeni TACE. Pro praxi tak lze udělat závěr, že pokud je indikace TACE hraniční třeba pro větší rozsah onemocnění v játrech nebo jiné technické komplikace, lze tuto regionální léčbu nahradit systémovou terapií. V pokročilé fázi testování je řada nových přípravků a kombinací, velmi nadějné jsou kombinace s imunoterapií. Lze zmínit kombinaci lenvatinibu s pembrolizumabem, která je nyní testována ve studii fáze III [9]. Podobně je testována kombinace pembrolizumabu s regorafenibem [10]. Zkoušena je rovněž kombinace imunoterapie s TACE [11] nebo s radioembolizací [12].
Podpořeno MZ ČR – RVO (MOÚ, 00209805).
Seznam použité literatury
- [1] Modrá kniha ČOS, 2020. 6. Primární nádory jater, žlučníku a žlučových cest (C22–24). Dostupné na: https://www.linkos.cz/lekar‑a‑multidisciplinarni‑tym/diagnostika‑a‑lecba/modra‑kniha‑cos/aktualni‑vydani‑modre‑knihy/26‑6‑primarni‑nadory‑jater‑zlucniku‑a‑zlucovych‑cest‑c22‑24/
- [2] Llovet JM, Ricci S, Mazzaferro V, et al. Sorafenib in advanced hepatocellular carcinoma. N Engl J Med 2008; 359: 378–390.
- [3] Motz GT, Santoro SP, Wang LP, et al. Tumor endothelium FasL establishes a selective immune barrier promoting tolerance in tumors. Nat Med 2014; 20: 60715.
- [4] Zhu AX, Duda DG, Sahani DV, Jain RK. HCC and angiogenesis: possible targets and future directions. Nat Rev Clin Oncol 2011; 8: 292–301.
- [5] eUpdate – Hepatocellular Carcinoma Treatment Recommendations Published: 19 June 2020. Authors: ESMO Guidelines Committee. Dostupné na: https://www.esmo.org/guidelines/gastrointestinal‑cancers/hepatocellular‑carcinoma/eupdate‑hepatocellular‑carcinoma‑treatment‑recommendations3
- [6] NCCN Guidelines Version 5.2020 Hepatocellular Carcinoma. Dostupné na: http://www.nccn.org
- [7] Bruix J, Qin S, Merle P, et al. Regorafenib for patients with hepatocellular carcinoma who progressed on sorafenib treatment (RESORCE): a randomised, double‑blind, placebo‑controlled, phase 3 trial. Lancet 2017; 389: 56–66.
- [8] Abou‑Alfa GK, Meyer T, Cheng Ann‑Li, et al. Cabozantinib in patients with advanced and progressing hepatocellular carcinoma. N Engl J Med 2018; 379: 54–63.
- [9] Zhu AX, Finn RS, Ikeda M, et al. A phase Ib study of lenvatinib (LEN) plus pembrolizumab (PEMBRO) in unresectable hepatocellular carcinoma (uHCC). ASCO 2020. Abstr 4519. Dostupné na: https://meetings.asco.org/am/abstracts‑posters
- [10] El‑Khoueiry AB, Kim RD, Garris WP, et al. Phase Ib study of regorafenib (REG) plus pembrolizumab (PEMBRO) for first‑line treatment of advanced hepatocellular carcinoma (HCC). ASCO GI 2020. Abstr 564. Dostupné na: https://meetings.asco.org/gi/abstracts‑posters
- [11] Harding JJ, Yarmohammadi H, Reiss KA, et al. Nivolumab (NIVO) and drug eluting bead transarterial chemoembolization (deb‑TACE): Preliminary results from a phase I study of patients (pts) with liver limited hepatocellular carcinoma (HCC). ASCO GI 2020. Abstr 525. Dostupné na: https://meetings.asco.org/gi/abstracts‑posters
- [12] Tai WMD, Loke KSH, Gogna A, et al. A phase II open‑label, single‑center, nonrandomized trial of Y90‑radioembolization in combination with nivolumab in Asian patients with advanced hepatocellular carcinoma: CA 209‑678. ASCO 2020. Abstr 4590. Dostupné na: https://meetings.asco.org/am/abstracts‑posters