Olaparib – první inhibitor PARP v léčbě zhoubných nádorů
Souhrn:
Snaha o nalezení buněčných pochodů, které mohou být cílem biologické léčby, se soustřeďuje také na mechanismy opravy poškozené DNA. Až u poloviny karcinomů vaječníků je defektní homologní rekombinace – jeden ze způsobů opravy DNA. Vyřazení mechanismu opravy vyštěpením báze (base excision repair, BER) inhibicí poly(ADP ribóza) polymerázy (PARP) vede ke zvýšení citlivosti nádorových buněk k chemoterapii nebo přímo k tzv. syntetické letalitě. V současné době je užití olaparibu schváleno v léčbě recidivujícího tzv. high grade serózního karcinomu vaječníku citlivého k platině u pacientek s prokázanou germinální nebo somatickou mutací genů BRCA1 nebo BRCA2.
Key words: PARP – olaparib – BRCA1 – BRCA2 – ovarian cancer.
Summary:
The search for cellular processes that may serve as targets for targeted therapy is also concentrated on DNA repair mechanisms. Up to half of ovarian carcino-mas are defective in homologous recombination, one of the pathways of DNA repair. Disabling base excision repair (BER) mechanism via poly(ADP-ribosa)polymerase (PARP) inhibition leads to increased cancer cell sensitivity to chemotherapy or directly to the so called synthetic lethality. Currently, olaparib has been approved for the treatment of recurrent platinum sensitive high grade serous ovarian carcinoma in patients with proven germ line or somatic mu-tation in either BRCA1 or BRCA2.
Úvod
Cílená léčba je jednou z hlavních oblastí výzkumu léčby zhoubných nádorů. Lepší pochopení molekulárních procesů vzniku a progrese nádoru vedlo historicky k odhalení mnoha nitrobuněčných cest (přesněji proteinů, které se těchto cest účastní), které jsou vlastními cíli biologické léčby. Oprava deoxyribonukleové kyseliny (DNA) je jedním z buněčných pochodů, na něž se výzkum zaměřuje. K poškozování DNA dochází neustále, a to jak vlivem faktorů zevních (chemických karcinogenů, záření) a biologických (virů), tak především spontánně vzniklými chybami při replikaci DNA v rámci buněčného dělení. Aby byla zachována genomová integrita, která je zásadně důležitá pro přežití, je buňka vybavena několika mechanismy opravy poškození DNA. Dosud bylo identifikováno nejméně šest způsobů opravy DNA (base excision repair, nucleotide excision repair, mismatch repair, translesional synthesis, homologous recombination, non‑homologous end‑joining). Některé slouží spíše pro nouzové a rychlé scelení DNA bez zachování dostatečné přesnosti a zachování genetického kódu, jiné, především homologní rekombinace (homologous recombination), jsou velmi přesnými a složitými mechanismy, které pečlivě opravují strukturu DNA na templátu komplementárního vlákna DNA [1].
Právě porucha tzv. homologní rekombinace hraje v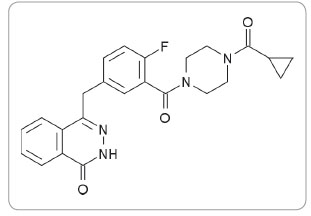 ýznamnou roli v procesu rozvoje a progrese nádoru až u poloviny všech ovariálních karcinomů [2]. Proto se tento nádor stal modelem pro vývoj látek, které terapeuticky zasahují na úrovni reparace DNA. Buňky s poruchou homologní rekombinace musejí využívat jiné cesty opravy DNA. Tyto cesty se tak stávají terapeutickým cílem. Olaparib, inhibitor poly(ADP‑ribóza)polymerázy (PARP), je prvním léčivem využívajícím tohoto principu a schváleným pro klinické použití, v tomto případě u karcinomu vaječníku (obr. 1).
ýznamnou roli v procesu rozvoje a progrese nádoru až u poloviny všech ovariálních karcinomů [2]. Proto se tento nádor stal modelem pro vývoj látek, které terapeuticky zasahují na úrovni reparace DNA. Buňky s poruchou homologní rekombinace musejí využívat jiné cesty opravy DNA. Tyto cesty se tak stávají terapeutickým cílem. Olaparib, inhibitor poly(ADP‑ribóza)polymerázy (PARP), je prvním léčivem využívajícím tohoto principu a schváleným pro klinické použití, v tomto případě u karcinomu vaječníku (obr. 1).
Farmakologické vlastnosti
Proteiny rodiny PARP, především PARP1, hrají významnou roli v opravě jednovláknových zlomů DNA mechanismem nahrazování jednotlivých bází (base excision repair) – obr. 2. Inhibice PARP vede ke ![Obr. 2 Role PARP při opravě jednovláknových zlomů DNA mechanismem nahrazování jednotlivých bází (base excision repair); podle [12] – Cacciatore, 2011. Sedmnáctičlennou rodinu PARP tvoří četné jaderné enzymy, PARP1 a PARP2 se účastní opravy jednovláknových zlomů DNA. DNA – kyselina deoxyribonukleová; NAD – nikotinamidadenindinukleotid (nikotinamid); PAR – poly(ADP-ribóza); PARP – poly(ADP-ribóza)polymeráza](https://www.remedia.cz/photo-a-30349---.jpg) kumulaci jednovláknových zlomů DNA a následně, v důsledku kolapsu replikační vidlice, i k hromadění dvouvláknových zlomů DNA [3]. Tyto zlomy jsou ale opravovány jiným reparačním mechanismem – právě homologní rekombinací. Hlavními účastníky homologní rekombinace jsou geny BRCA1 a BRCA2 [4].
kumulaci jednovláknových zlomů DNA a následně, v důsledku kolapsu replikační vidlice, i k hromadění dvouvláknových zlomů DNA [3]. Tyto zlomy jsou ale opravovány jiným reparačním mechanismem – právě homologní rekombinací. Hlavními účastníky homologní rekombinace jsou geny BRCA1 a BRCA2 [4].
Homologní rekombinace může být vyřazena v důsledku germinální (zárodečné, dědičné) mutace genu BRCA1 nebo BRCA2. Tyto mutace se dědí autosomálně dominantně – stejnou měrou je dědí muži i ženy a pravděpodobnost přenosu z rodičů na děti je 50 %. Vykazují vysokou penetranci – riziko vzniku karcinomu prsu dosahuje u nositelek mutací 50–85 % a riziko vzniku karcinomu vaječníku 15–40 %.
Zárodečná mutace je tedy faktorem, který oslabuje schopnost buňky opravovat chyby v syntéze DNA a otevírá cestu ke vzniku maligní transformace buňky [5].
Kromě zárodečných mutací mohou být geny podílející se na procesech homologní rekombinace inaktivovány i somatickými mutacemi (alteracemi vzniklými v samotných nádorových buňkách) nebo v některých případech i metylací promotorových sekvencí. Nejčastěji jde opravdu o alterace genů BRCA1 a BRCA2, stejné působení však zřejmě může vykazovat i funkční porucha jiných genů, což zatím zůstává předmětem výzkumu [2].
Na současné úrovni poznání dokážeme analyzovat germinální nebo somatické změny genů BRCA1 nebo BRCA2; do budoucna se však jako přínosnější metoda jeví zjišťování funkce všech proteinů účastnících se homologní rekombinace jako celku, která by na funkční úrovni zachytila nejen změny konkrétních genů, nýbrž i skutečnou poruchu tohoto mechanismu opravy DNA.
Mutace v genech účastnících se reparace DNA nejen otevírají cestu pro karcinogenezi, ale zároveň mohou zvyšovat citlivost k některým typům cytotoxických látek. U žen s germinální mutací genu BRCA1 nebo BRCA2 a s karcinomem prsu či vaječníku byla popsána vyšší citlivost k léčbě platinovými deriváty. Vysvětlení spočívá zřejmě v omezené možnosti reparovat addukty DNA tvořené působením platiny [6].
Vývoj inhibitorů PARP se soustředil na využití dvou principů: a) vyřazení alternativní cesty reparace DNA (v tomto případě dominantně base excision repair) za použití inhibitorů PARP vede k chemosenzibilizaci nádoru; b) použití inhibitorů PARP vede k syntetické letalitě nádorových buněk [3].
Na modelu bylo prokázáno, že nádorová tkáň s defektní homologní rekombinací (např. právě s defektem genu BRCA1 nebo BRCA2) je zvýšeně citlivá k blokádě oprav jednovláknových zlomů prostřednictvím inhibitorů PARP. Využití kombinace preexistujícího defektu (v tomto případě poruchy homologní rekombinace) a dalšího defektu navozeného léčivem (oprav jednovláknových zlomů DNA v důsledku inhibice PARP1) je označováno jako koncept syntetické letality – každý z procesů samostatně nevede ke smrti buňky, protože ta může využít alternativní mechanismus oprav DNA; avšak jejich uměle (podáním inhibitoru PARP) vyvolané spojení již letální je [7].
Klinické hodnocení
Klinické studie se tedy v případě olaparibu – prvního registrovaného inhibitoru PARP – soustředily na testování tohoto léčiva v kombinaci s chemoterapií (jako senzibilizátoru) a v monoterapii při konsolidační i paliativní léčbě recidiv ovariálního karcinomu.
Ovariální karcinom (jednotka zahrnující epiteliální karcinomy označované jako ovariální, tubární a primární peritoneální) je v ekonomicky vyspělých zemích pátou nejčastější příčinou úmrtí žen na nádorové onemocnění a je spojen s nejvyšší mortalitou ze všech gynekologických malignit. Příčinou je pozdní záchyt jinak bezpříznakového nádoru. Navzdory kombinaci extenzivní chirurgické léčby a chemoterapie většina těchto nádorů recidivuje. Odpověď na chemoterapii podávanou v dalších liniích většinou netrvá dlouho [8]. Až u 14 % ovariálních karcinomů jsou detekovány mutace genů BRCA1 a BRCA2 [5].
Olaparib (AZD2281) je perorální inhibitor PARP1 a PARP2, který k dnešnímu dni prošel nejrozsáhlejšími klinickými zkouškami. Olaparib byl testován u karcinomu prsu, vaječníku a prostaty ve studiích I., II. i III. fáze a byla prokázána jeho protinádorová účinnost jak u nádorů se zárodečnou mutací genů BRCA, tak (ve významně nižší míře) u sporadických karcinomů vaječníků [9]. Nejdále dospělo testování olaparibu u ovariálního karcinomu. Americký Úřad pro kontrolu potravin a léčiv (Food and Drug Administration, FDA) i Evropská léková agentura (European Medicines Agency, EMA) schválily na podzim roku 2014 použití olaparibu v konsolidační léčbě recidiv ovariálního tzv. high‑grade serózního karcinomu citlivého k platině u pacientek s prokázanou germinální nebo somatickou mutací genu BRCA1 nebo BRCA2. Jako účinná a maximální tolerovaná dávka bylo stanoveno 400 mg olaparibu podaných dvakrát denně perorálně (celková denní dávka 800 mg při perorálním podání).
K ověření účinku perorálního olaparibu v léčbě recidivujícího ovariálního karcinomu byla uspořádána multicentrická randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie II. fáze (Study 19), která proběhla v letech 2008–2010 a sloužila jako registrační studie pro schválení použití olaparibu v konsolidační léčbě recidivujícího ovariálního karcinomu [10]. Do studie byly zařazeny pacientky s recidivou tohoto karcinomu citlivého k platině (definovanou jako progrese onemocnění s odstupem delším než šest měsíců po ukončení předchozí linie léčby s platinovým derivátem) high‑grade serózního ovariálního karcinomu nebo nádoru s high‑grade serózní komponentou. Pacientky byly po dokončení posledního cyklu chemoterapie s platinovým derivátem náhodně přiděleny v poměru 1 : 1 k udržovací léčbě perorálním olaparibem nebo k užívání placeba. Pro randomizaci byly stratifikovány podle délky přežití do progrese onemocnění po poslední linii chemoterapie s platinovým derivátem (6–12 měsíců vs. déle než 12 měsíců), podle odpovědi na současnou léčbu (kompletní vs. parciální odpověď) a podle etnického původu (židovský vs. nežidovský). Randomizováno bylo 265 pacientek, z nichž 136 užívalo olaparib a 129 placebo. Pacientky ve větvi s olaparibem užívaly perorálně 400 mg olaparibu dvakrát denně do progrese onemocnění podle kritérií RECIST (Response Evaluation Criteria In Solid Tumors) nebo do významné toxicity léčby. Primárním cílovým ukazatelem studie byla délka přežití bez progrese onemocnění (progression‑free survival, PFS) a sekundárními cílovými parametry byly celkové přežití (overall survival, OS) a míra objektivních odpovědí na léčbu podle RECIST.
Statistická analýza prokázala statisticky signifikantní prodloužení PFS ve skupině pacientek užívajících olaparib (8,4 měsíce vs. 4,8 měsíce), nebyl však nalezen signifikantní rozdíl v OS mezi skupinou užívající olaparib a placebovou skupinou (29,7 měsíce vs. 29,9 měsíce). V podskupině pacientek s měřitelnou lézí po skončení chemoterapie a před začátkem užívání olaparibu činila míra objektivních odpovědí na léčbu olaparibem podle RECIST 12 %.
K nejčastějším nežádoucím účinkům léčby olaparibem patřila nevolnost a zvracení, únava a anemie. Nauzea, zvracení a únava se projevovaly intermitentně a nebyly důvodem pro ukončení účasti ve studii, byly však důvodem pro dočasné přerušení léčby. Incidence příhod 3. a 4. stupně dosahovala ve skupině s olaparibem 35,3 % a v placebové skupině 20,3 %. Nebyly zaznamenány žádné neočekávané změny laboratorních ukazatelů, vitálních funkcí ani fyzikálního nálezu. Mezi oběma větvemi nebyl zaznamenán statisticky signifikantní rozdíl v kvalitě života měřené pomocí dotazníků.
Vzhledem k předpokladu vyšší účinnosti inhibitorů PARP u pacientek se zárodečnou mutací genů BRCA1 a BRCA2 byla provedena plánovaná subanalýza PFS a OS v podskupině pacientek se známou zárodečnou nebo somatickou mutací genů BRCA1 a BRCA2. Podle očekávání byla ve skupině pacientek s pozitivitou BRCA (se zárodečnou i se somatickou mutací) užívajících olaparib zaznamenána významně delší PFS než v placebové skupině (11,2 měsíce vs. 4,3 měsíce). Ve skupině pacientek s negativitou BRCA byl rovněž zaznamenán přínos užívání olaparibu, avšak jeho účinek nebyl tak výrazný (PFS: 7,4 měsíce vs. 5,5 měsíce). Ani při analýze podle mutačního statusu nebyl zjištěn rozdíl v OS mezi jednotlivými skupinami nebo větvemi. Celkem 18 % pacientek ve větvi s olaparibem užívalo léčbu déle než tři roky. Spektrum nežádoucích účinků olaparibu se u pacientek s mutací a bez mutace BRCA1 a BRCA2 nelišilo.
Další uskutečněné nebo probíhající klinické studie u ovariálního karcinomu testují použití olaparibu v primární léčbě v kombinaci s chemoterapií nebo v monoterapii (konsolidační léčba) [11]. Lze předpokládat, že zavedení olaparibu do léčby karcinomu prsu, popřípadě do léčby karcinomu prostaty, bude mít významný dopad na klinickou péči (i na nákladovou efektivitu léčby).
Závěr
V registrační studii byla ověřena účinnost olaparibu v léčbě platina-senzitivních recidiv ovariálního karcinomu u žen s germinální mutací genů BRCA1 nebo BRCA2. Do klinického použití se tak dostává první lék ze skupiny látek ovlivňujících opravy DNA. Jedná se také o první lék, jehož prediktorem účinku je germinální genetický defekt.
Genetická analýza genů BRCA1 a BRCA2 byla až dosud využívána jako nástroj vyhledávání rodin, v nichž se přenáší genetická dispozice ke vzniku zhoubných nádorů. S nástupem olaparibu se však ke slovu nově dostává i prediktivní funkce testování. Zároveň také nástup inhibitorů PARP představuje naději na zkvalitnění systému vyšetřování a péče o nositelky mutací genů BRCA1 a BRCA2.
Na základě probíhajících studií lze předpokládat i brzké zapojení olaparibu v léčbě karcinomu prsu, eventuálně karcinomu prostaty.
Seznam použité literatury
- [1] Plummer R. Perspective on the pipeline of drugs being developed with modulation of DNA damage as a target. Clin Cancer Res 2010; 16: 4527–4531.
- [2] Cancer Genome Atlas Research Network. Integrated genomic analyses of ovarian carcinoma. Nature 2011; 474: 609–615.
- [3] Rouleau M, Patel A, Hendzel MJ, et al. PARP inhibition: PARP1 and beyond. Nat Rev Cancer 2010; 10: 293–301.
- [4] Venkitaraman AR. Cancer suppression by the chromosome custodians, BRCA1 and BRCA2. Science 2014; 343: 1470–1475.
- [5] Chen S, Parmigiani G. Meta analysis of BRCA1 and BRCA2 penetrance. J Clin Oncol 2007; 25: 1329–1333.
- [6] Tan DS, Rothermundt C, Thomas K, et al. “BRCAness” syndrome in ovarian cancer: a case control study describing the clinical features and outcome of patients with epithelial ovarian cancer associated with BRCA1 and BRCA2 mutations. J Clin Oncol 2008; 26: 5530–5536.
- [7] Schultz N, Lopez E, Saleh Gohari N, Helleday T. Poly(ADP ribose) polymerase (PARP 1) has a controlling role in homologous recombination. Nucleic Acids Res 2003; 31: 4959–4964.
- [8] Luvero D, Milani A, Ledermann JA. Treatment options in recurrent ovarian cancer: latest evidence and clinical potential. Ther Adv Med Oncol 2014; 6: 229–239.
- [9] Liu JF, Tolaney SM, Birrer M, et al. A Phase 1 trial of the poly(ADP ribose) polymerase inhibitor olaparib (AZD2281) in combination with the anti angiogenic cediranib (AZD2171) in recurrent epithelial ovarian or triple negative breast cancer. Eur J Cancer 2013; 49: 2972–2978.
- [10] Ledermann J, Harter P, Gourley C, et al. Olaparib maintenance therapy in patients with platinum sensitive relapsed serous ovarian cancer: a preplanned retrospective analysis of outcomes by BRCA status in a randomised phase 2 trial. Lancet Oncol 2014; 15: 852–861.
- [11] Ledermann J, Harter P, Gourley C, et al. Olaparib maintenance therapy in platinum sensitive relapsed ovarian cancer. N Engl J Med 2012; 366: 1382–1392.
- [12] Cacciatore P. PARP Inhibitor MK 4827 Shows Anti Tumor Activity in First Human Clinical Study. Posted on November 17, 2010; http://libbyshope.com/2010/11/17/parp inhibitor mk 4827 shows anti tumor activity in first human clinical study/ (navštíveno 1. 10. 2015).