Ověřování pravosti léčiv po osmi měsících od startu
Protipadělková směrnice (Falsified Medicine Directive, FMD) nabyla v zemích Evropské unie účinnosti k 9. únoru 2019. Od té doby platí povinnost pro držitele registračního rozhodnutí propouštět na trh léčivé přípravky vybavené ochrannými prvky a koncoví uživatelé (lékárny a distributoři v některých specifických případech) musejí před výdejem lék ověřit a vyřadit ze systému. Cílem tohoto opatření je zabránit vstupu falzifikátů na evropský trh. Pro Českou republiku není hrozba falešných léků vysoká, ale byly již zachyceny zásilky padělků, které byly určeny pro český trh. Za osm měsíců fungování prošel systém několika „dětskými chorobami“, které byly odstraněny. Podzim by však měl proběhnout ve znamení přípravy na období, kdy za výdej neověřeného přípravku a nedodržení zákonem stanoveného postupu (ohlašovací povinnost) mohou být uděleny statisícové pokuty (koncoví uživatelé až 300 000 Kč, držitelé registračních rozhodnutí až dva miliony).
Podle nařízení Evropské komise
v přenesené pravomoci (EU) 2016/161 ze dne 2. října
2015, jímž se doplňuje směrnice Evropského parlamentu a Rady
2001/83/ES stanovením podrobných pravidel pro ochranné prvky
uvedené na obalu humánních léčivých přípravků,
vstoupila dnem 9. února 2019 v platnost povinnost
ověřovat pravost léčiv před jejich výdejem pacientovi. V České
republice je za implementaci a provozování systému pro
ověřování pravosti léčiv odpovědná nezisková organizace
Národní organizace pro ověřování pravosti léčiv z. s.
(NOOL). Podrobné informace na: www.czmvo.cz.
Co jsou ochranné prvky
Ochranné prvky sestávají z unikátního kódu (2D) a ze zabezpečení proti manipulaci s obsahem balení léčivého přípravku (např. přelepky). Tyto ochranné prvky umisťuje na obal výrobce (držitel registračního rozhodnutí), který data jedinečných identifikátorů nahraje před vypuštěním na trh do systému (prostřednictvím evropského úložiště do národního úložiště). Pravost každé originální krabičky lze tedy ověřit po celou cestu od výrobce až ke konečnému výdeji pacientovi.
Dostupnost léků na prvním místě
Evropský systém ověřování pravosti léčiv (European Medicines Verification System, EMVS) je velmi komplexním a nejsložitějším projektem, který byl v prostředí farmaceutického trhu spuštěn. Problémy s jeho implementací byly předem předpokládány, a proto bylo v ČR zákonem přijato bezsankční období pro koncové uživatele do konce roku 2019 na doladění Národního systému ověřování pravosti léčiv, aby nebyla narušena dostupnost léků.
Pokud se lékárníkovi z jakéhokoliv důvodu nepodaří ověřit unikátní kód, pak záleží na jeho rozhodnutí, jak bude dále postupovat. Podle novely zákona č. 378/2007 Sb., o léčivech, která byla schválena Poslaneckou sněmovnou Parlamentu ČR a následně i Senátem, byly odloženy sankce (k 1. 1. 2020) za případné chyby v postupu při ověřování (podrobněji senátní tisk 30).
Za prioritní označil dostupnost léků i ministr zdravotnictví České republiky Mgr. et Mgr. Adam Vojtěch, MHA, který prohlásil: „Ani Ministerstvo zdravotnictví, ani Státní ústav pro kontrolu léčiv nebude do konce tohoto roku postihovat lékárníky za to, že budou vydávat léky pacientům i v případě, kdy nemohli ověřit a vyřadit identifikátor léčivého přípravku v datovém úložišti, pokud mohli být v dobré víře ohledně pravosti takového léčivého přípravku. Tato dobrá víra může vyplývat jak z dosavadních zkušeností, tak ze zavedeného systému řízení rizik, který zahrnuje opatření, jako je odebírání léčivých přípravků pouze od zavedených a prověřených distributorů léčiv, vizuální kontrola nenarušení celistvosti balení a podobně.“ Toto opatření končí k 1. lednu 2020.
Ministr zdravotnictví taktéž může (podle novely) na žádost držitele registračního rozhodnutí uvolnit ve vyjmenovaných případech k výdeji celou šarži léků, kterou se z technických důvodů nepodařilo ověřit, za předpokladu, že je ohrožena dostupnost nenahraditelného léčivého přípravku, a tím pádem i zdraví pacientů (tento postup bude možné uplatnit i po 1. lednu 2020).
Národní systém ověřování
pravosti léčiv
Fungování a implementaci českého Národního systému ověřování pravosti léčiv (NSOL) zajišťuje nezisková Národní organizace pro ověřování pravosti léčiv (NOOL), která byla založena Asociací evropských distributorů léčiv (AEDL), Asociací inovativního farmaceutického průmyslu (AIFP), Asociací velkoobchodních distributorů farmaceutů (AVEL), Českou asociací farmaceutických společností (ČAFF) a Českou lékárnickou komorou (ČLnK) v březnu 2017.
Český NSOL byl spuštěn do testovacího provozu již v průběhu roku 2018 a 9. února 2019 do regulérního provozu. Počátečním problémem byl vysoký počet chybových hlášení (tzv. alertů, kolem 11 % všech transakcí), z nichž byla podstatná část způsobena neshodou s daty nahranými držiteli rozhodnutí o registraci (marketing authorisation holder, MAH) a s údaji v unikátním identifikátoru (2D kódu); část připadla na vrub softwaru používaného koncovými uživateli (ve čtečkách a formátech zápisu). V naprosté většině se jednalo o formální chyby, které nebudily podezření na padělané léčivo. Mírný optimismus klesajícího počtu alertů (na desetiny procenta) byl zbrzděn poruchou funkce NSOL v období od 10. dubna do konce května 2019 (menší problémy se vyskytovaly i v průběhu června), což vedlo často k nemožnosti ověřit léčivý přípravek koncovým uživatelem. U koncových uživatelů docházelo k prodlužování doby odezvy až na desítky sekund a následovala nedostupnost systému pro prodloužení doby odezvy (tzv. request timeout). V současnosti je stav optimalizován, nalezená příčina byla odstraněna. Skutečnost, že se problémy vyskytly jen v ČR, souvisí s nejvyšším počtem transakcí u českých koncových uživatelů v porovnání s dalšími zeměmi EU, které jsou klienty společnosti Solidsoft Reply. Tato zkušenost je užitečná také pro jiné země se stejným dodavatelským systémem.
Na základě této zkušenosti NOOL spustila 28. 5. 2019 vlastní monitoring systému NSOL včetně on line zobrazování stavu NSOL na stránkách NOOL (https://www.czmvo.cz/cs/stav nsol/).
Stav k polovině října 2019
Nyní se finalizuje sada reportů Státního ústavu pro kontrolu léčiv a nové testovací prostředí ITE pro systémy koncových uživatelů, komplexní monitoring EMVS. Podíl alertů vzhledem k počtu transakcí neustále klesá (ve 40. týdnu činil 0,46 %).
Národní organizace pro ověřování pravosti léčiv vytvořila Centrum správy alertů, které ve spolupráci s držiteli registračních rozhodnutí a s koncovými uživateli řeší vyšetřování alertů a zajišťuje další související činnosti. K tomu využívá systém správy alertů NSOL (obr. 1). V tuto chvíli probíhá rozvoj systému pro správu alertů
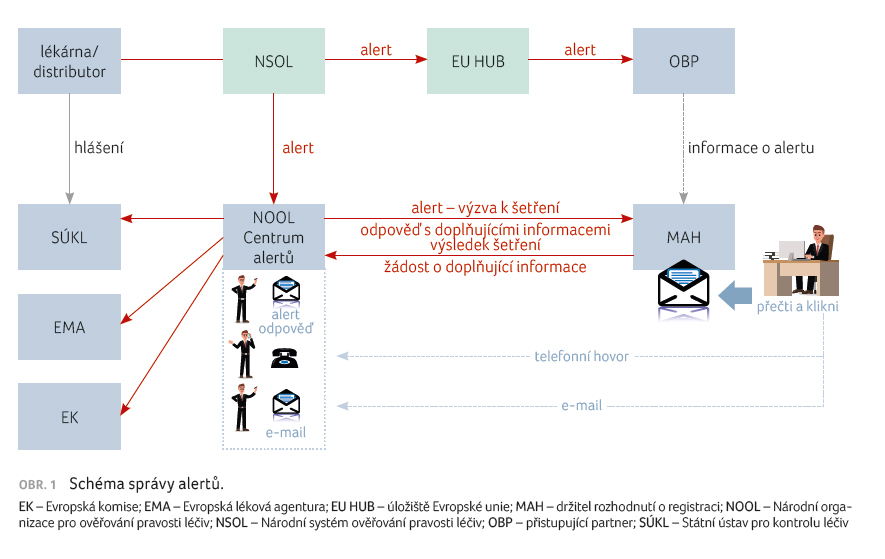
tak, aby bylo možno k němu přistupovat v otevřeném rozhraní (API) jak v systému koncových uživatelů, tak i MAH. Systém umožní MAH i koncovým uživatelům prostřednictvím svých systémů nebo webového rozhraní zjišťovat stav alertu (vyřešeno, alert k řešení, podezření na padělek atd.) a zaslat další informace nezbytné k vyšetření alertu, například fotografii balení.
Je nejvyšší čas, aby začali
ověřovat všichni
Období bez sankcí pro koncové uživatele končí 31. prosince 2019!
Podle informace expertní skupiny NOOL
se odhaduje, že v současné době se ověřuje zhruba 10–15 %
balení. Zbývá však jen několik měsíců do doby, kdy vstoupí
FMD do plného provozu, a to včetně sankcí. Koncoví
uživatelé, kteří zatím váhali s ověřováním pravosti
léků, budou ve značné nevýhodě oproti zkušeným, kteří
pracují s NSOL na denní bázi a ověřování se pro
ně stalo rutinní činností (tab. 1‒4).
Druhým vážným důvodem pro
ověřování pravosti léčiv již na podzim 2019 je zkouška
samotného systému (na evropské úrovni). Jako příklad
prospěšné aktivity lékárníků lze uvést přechodné jarní
potíže systému (viz výše), které souvisely s centrální
databází a uspořádáním jejích „uzlů“. Nebýt
pravidelného načítání vysokého počtu kódů, byla by nemusela
být závada odhalena a k výpadku systému by bylo mohlo
dojít až v plném provozu. To by závažným způsobem zasáhlo
do dostupnosti léků pro pacienty a současně mělo své
ekonomické konsekvence pro všechny zainteresované. 
Za NOOL MUDr. Marta Šimůnková