Ověřování pravosti léčiv v českém prostředí
Sto procent připojených lékáren a velmi nízký počet generovaných výstrah řadí Českou republiku k naprosté evropské špičce. Report z dubna 2021, který vydala Evropská organizace pro ověřování pravosti léčiv (European Medicines Verification Organisation, EMVO), uvádí 0,02% podíl generovaných výstrah z celkového počtu transakcí (ověření). Výstraha však neznamená výskyt padělku, v současnosti jde spíše o nesoulad nahraných dat do systému nebo chybu v nastavení softwaru. Nízký počet výstrah je známkou dobře nastaveného a fungujícího systému. Ověřovat pravost léků je i v současnosti v době urychlené distribuce vakcín důležité, protože padělané vakcíny již byly údajně zachyceny i na území Evropské unie.
Sto procent připojených lékáren
a velmi nízký počet generovaných výstrah řadí Českou
republiku k naprosté evropské špičce. Report z dubna
2021, který vydala Evropská organizace pro ověřování pravosti
léčiv (European Medicines Verification Organisation, EMVO), uvádí
0,02% podíl generovaných výstrah z celkového počtu
transakcí (ověření). Výstraha však neznamená výskyt padělku,
v současnosti jde spíše o nesoulad nahraných dat
do systému nebo chybu v nastavení softwaru. Nízký počet
výstrah je známkou dobře nastaveného a fungujícího
systému. Ověřovat pravost léků je i v současnosti
v době urychlené distribuce vakcín důležité, protože
padělané vakcíny již byly údajně zachyceny i na území
Evropské unie.
Původně jsem chtěla článek nazvat Ověřování pravosti léčiv v českých lékárnách. Avšak přestože jsou lékárníci velmi podstatnou složkou celého systému, jsou pouze částmi soukolí evropského systému EMVS (European Medicines Verification System), do něhož spadá český Národní systém pro ověřování pravosti léčiv (NSOL).
Systém verifikace se budoval několik let a 9. února 2019 byl po pilotním testovacím projektu spuštěn do ostrého provozu v celé EU. V České republice a v několika dalších státech EU však bylo stanoveno určité období, kdy již platila povinnost ověřovat lék, ale byla li generována výstraha/alert, mohl lékárník v dobré víře, že nejde o padělek, pacientovi balení léku vydat. Dobrou vírou se rozumělo, že léčivo bylo do lékárny dodáno oficiálním ověřeným distributorem. Toto období již skončilo. Přes vygenerovanou výstrahu již nelze léčivý přípravek vydat a alert je nutné vyšetřit a uzavřít. Potvrzené podezření na padělek je pak nutné hlásit Státnímu ústavu pro kontrolu léčiv (SÚKL).
Z tohoto pravidla existují
výjimky: prokáže li výrobce, že balení léčivého
přípravku bylo propuštěno před 9. 2. 2019 nebo udělilo li
ministerstvo zdravotnictví na základě žádosti držitele
rozhodnutí o registraci léčivého přípravku výjimku pro
určité konkrétní šarže přípravků. V současnosti má
(kromě jiných) výjimku společnost Pfizer pro distribuci vakcíny
Comirnaty, kterou distribuuje svými prostředky. Data ostatních
vakcín jsou již nahrána do systému a ověřují se
(u distributorů, v nemocničních lékárnách).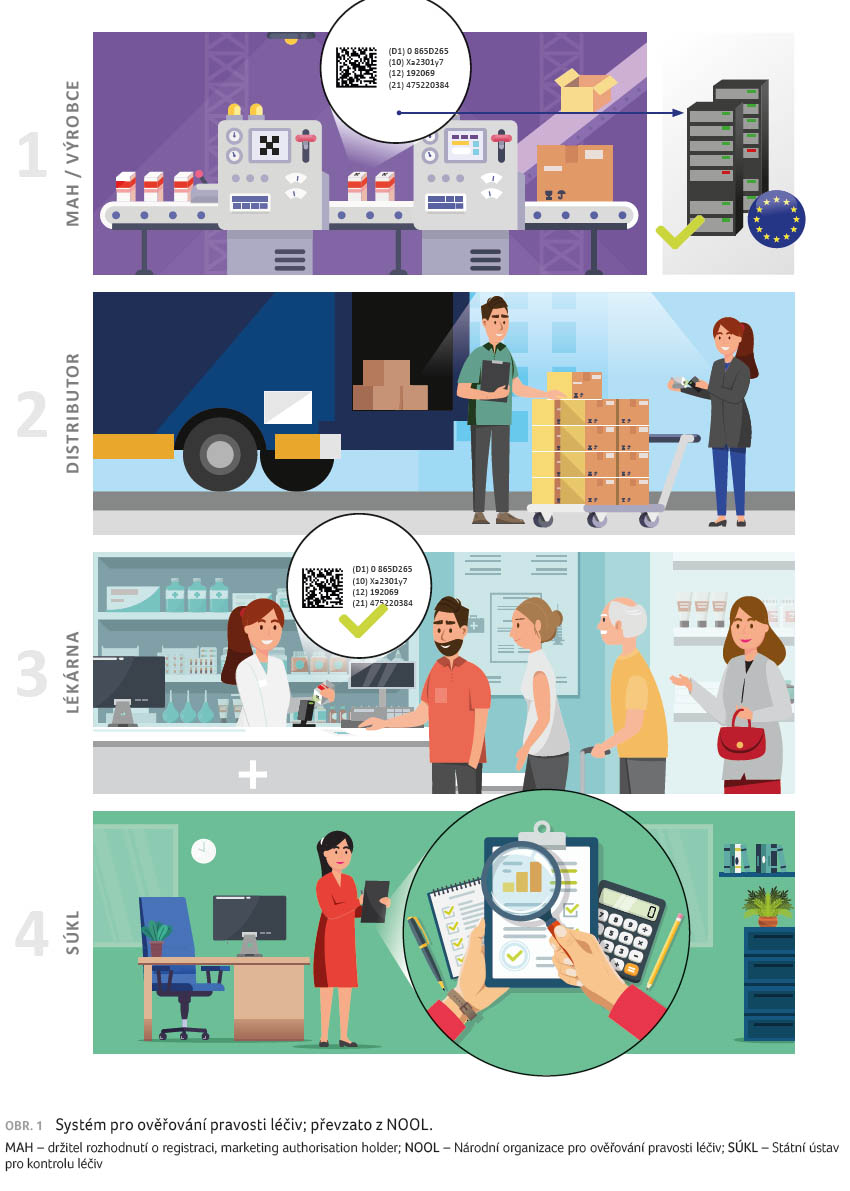
Co se ověřuje
Ověřují se všechny léčivé přípravky vydávané na lékařský předpis s výjimkou léků uvedených na tzv. white listu Nařízení (viz dále; např. homeopatika, speciální přípravky) a volně prodejné léčivé přípravky uvedené na tzv. black listu Nařízení. Z nařízení Evropské komise musejí balení propuštěná na trh obsahovat identifikační prvky − unikátní 2D kód, v němž jsou zakódovány informace (zpravidla jsou vytištěny vedle kódu): číslo produktu, sériové číslo, číslo šarže, datum použitelnosti (exspirace). Povinností před vydáním léku pacientovi je také ověřit zabezpečení proti manipulaci s obsahem balení léčivého přípravku (neporušenost přelepky).
Celý proces od nahrání dat do systému přes distribuci až po ověření a vyřazení léčiva znázorňuje infografika (obr. 1).
Legislativní podklady
Projekt ochrany legálního dodavatelského řetězce před nebezpečím výskytu padělaných léčiv v oficiální distribuční síti byl vyvinut v rámci iniciativy Evropské komise. Principy shrnuje SMĚRNICE EVROPSKÉHO PARLAMENTU A RADY 2011/62/EU ze dne 8. června 2011 (zkráceně FMD, Falsified Medicine Directive). Dne 9. února 2019 nabylo účinnosti Nařízení Komise v přenesené pravomoci (EU) 2016/161, kterým se doplňuje směrnice Evropského parlamentu a Rady 2001/83/ES stanovením podrobných pravidel pro ochranné prvky uvedené na obalu humánních léčivých přípravků. V ČR je ověřování léčivých přípravků zakotveno v zákoně 44/2019 Sb., o léčivech.
Národní organizace pro ověřování
pravosti léčiv
V ČR zodpovídá za implementaci FMD Národní organizace pro ověřování pravosti lé
čiv (NOOL), což je národní neziskový právní subjekt, který vytvořil a spravuje regionální úložiště dat – NSOL. Činnost NOOL je velmi různorodá a kromě technické správy systému spočívá v jednáních a komunikaci se všemi zúčastněnými, tedy s EMVO, zástupci výrobců (držitelů rozhodnutí o registraci léčivého přípravku), koncovými uživateli – lékárnami a distributory, státními institucemi (Ministerstvem zdravotnictví ČR, SÚKL), společnostmi spravujícími software (na evropské i české úrovni).
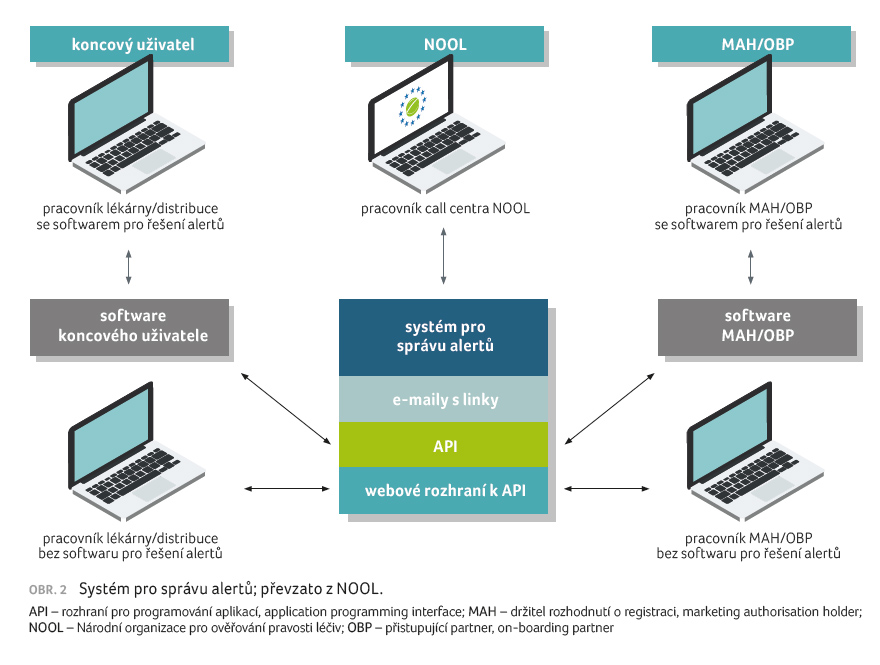
Národní organizace pro ověřování pravosti léčiv se svým Centrem pro správu alertů napomáhá v řešení alertů, k čemuž vytvořila jedinečný Systém pro správu alertů (Alert Management System, AMS) – viz obrázek 2.
Alert Management System
Jde o jedinečné řešení, které zabezpečuje maximálně automatizované zpracování a výměnu datových informací, tj. umožňuje koncovým uživatelům a držitelům rozhodnutí o registraci:
- okamžitý přístup k aktuálnímu stavu alertů,
- zjednodušenou a zcela anonymní výměnu zpráv mezi držiteli rozhodnutí o registraci léčivého přípravku, NOOL a koncovým uživatelem (resp. provozovnou, místem, kde daný alert vznikl),
- zjišťování a měnění stavu alertů automaticky či manuálně,
- datovou integraci s aplikacemi držitelů rozhodnutí o registraci léčivého přípravku a koncových uživatelů.
Existují signály, že mnohé evropské země by rády napodobily český AMS. Připojením do AMS se uživatel zbavuje nutnosti odpovídat na „klikací“ maily, protože AMS nabízí předdefinovaná řešení a odpovědi. Připojit se lze přes rozhraní pro programování aplikací (API) nebo webové rozhraní.
Více informací na www.czmvo.cz
Redakčně zpracovala MUDr. Marta Šimůnková