Paliperidon palmitát: praktické aspekty
Paliperidon palmitát je depotní forma paliperidonu, z níž se vlastní účinná látka hydrolýzou pomalu uvolňuje do krevního řečiště. Jedná se o vodnou
suspenzi paliperidonu palmitátu vyrobenou pomocí inovativní technologie nanokrystalů. Paliperidon je 9-hydroxyrisperidon, což je hlavní aktivní
metabolit risperidonu. Podobně jako jeho mateřská molekula risperidon je silným antagonistou dopaminových receptorů D2 a serotoninových receptorů 5-HT2A. Paliperidon je rovněž antagonistou adrenergních receptorů ?1 a ?2 a histaminových receptorů H1. Paliperidon palmitát je díky svým vlastnostem předurčen pro roli ideálního dlouhodobě působícího injekčního antipsychotika 2. generace. Perorální suplementace není nutná, paliperidon palmitát je aplikován pomocí malých jehel, v malém objemu a v měsíčních intervalech. Širšímu využití paliperidonu palmitátu v klinické praxi brání zejména systém úhrady v České republice.
Úvod
Paliperidon palmitát představuje depotní přípravek. Jedná se o ester paliperidonu, ze kterého se účinná látka pomalu uvolňuje do krevního řečiště. Paliperidon palmitát je vodná suspenze vyrobená pomocí inovativní technologie nanokrystalů [1]. Dostupné injekce obsahují 39 mg, 78 mg, 117 mg, 156 mg a 234 mg paliperidonu palmitátu. Po aplikaci ester hydrolyzuje na aktivní paliperidon v dávkách 25 mg, 50 mg, 75 mg, 100 mg a 150 mg [2].
Paliperidon je 9-hydroxyrisperidon, což je hlavní aktivní metabolit risperidonu. Paliperidon je podobně jako jeho mateřská molekula risperidon silným antagonistou dopaminových receptorů D2 a serotoninových receptorů 5-HT2A. Paliperidon je rovněž antagonistou adrenergních receptorů ?1 a ?2 a histaminových receptorů H1, jejichž obsazenost může souviset s nárůstem tělesné hmotnosti, ortostatickou hypotenzí či sedací [1, 3]. Paliperidon nevykazuje žádné anticholinergní působení, má tedy nízký potenciál způsobovat anticholinergní nežádoucí účinky, ať již centrální nebo periferní [3].
Metabolismus
Paliperidon palmitát je ve vodě prakticky nerozpustný, a proto se po intramuskulární aplikaci jen minimálně uvolňuje, než je hydrolyzován na paliperidon a absorbován do krevního oběhu. Z tohoto důvodu se prakticky žádný paliperidon palmitát nedostává do krve, aniž by byl hydrolyzován na paliperidon [4, 5]. Po jednorázovém podání paliperidonu palmitátu je jeho maximální koncentrace v plazmě dosaženo 13. den [2]. Paliperidon se uvolňuje od prvního dne podání do zhruba 126. dne po aplikaci [2]. Maximální koncentrace paliperidonu v séru je při aplikaci do deltoidního svalu přibližně o 28 % vyšší než při podání do svalu gluteálního. Vysvětlení spočívá v odlišném složení svalové hmoty, rozdílné vaskularizaci a vyšším obsahu tukové tkáně v gluteálním svalu [4, 6]. Rozdílná absorpce paliperidonu v deltoidním a gluteálním svalu vedla k doporučení, aby pro rychlé dosažení terapeutické koncentrace byly první dvě injekce paliperidonu palmitátu aplikovány v týdenním intervalu do deltoidního svalu [7].
Paliperidon je primárně vylučován ledvinami, není metabolizován jaterním enzymatickým systémem. Neexistuje proto vztah mezi genotypem enzymů CYP 450 a farmakokinetickými parametry paliperidonu [5]. Délka poločasu eliminace paliperidonu palmitátu se udává v rozmezí 25 až 49 dnů [2]. Z analýzy farmakokinetických parametrů z provedených studií vyplynulo, že farmakokinetika paliperidonu je nejvíce ovlivněna indexem tělesné hmotnosti (body mass index, BMI), kreatininovou clearance, místem vpichu, velikostí aplikované dávky a velikostí injekční jehly. Plazmatické koncentrace paliperidonu jsou nižší u osob s BMI ? 25, ale tento efekt nemusí při opakovaných aplikacích paliperidonu palmitátu přetrvávat [8]. Pozorované rozdílné koncentrace paliperidonu v plazmě vedly ke specifickým doporučením, která se týkají použití injekčních jehel různých velikostí v závislosti na BMI [9], podrobněji níže.
Paliperidon má potenciálně jen velmi málo lékových interakcí. V podmínkách in vitro podstatně neinhibuje ani neindukuje metabolismus léků transformovaných prostřednictvím jaterních izoenzymů CYP 450. Ve vysokých koncentracích je paliperidon slabým inhibitorem P-glykoproteinu. Opatrnosti je však třeba při kombinaci paliperidonu palmitátu s centrálně působícími tlumivými látkami (jako jsou např. alkohol, sedativa) a s léky, které mohou potencovat ortostatickou hypotenzi (antagonisté adrenergních receptorů). Určité opatrnosti při kombinacích s paliperidonem palmitátem je třeba na základě zkušeností s perorálním paliperidonem. Kombinace perorálního paliperidonu s karbamazepinem snižuje množství paliperidonu přibližně o 37 %, naopak kombinace s valproátem (tablety s pozvolným uvolňováním) vedou přibližně k 50% zvýšení koncentrace paliperidonu v séru [2]. Tento nález ale nebyl potvrzen ve studii s perorálním risperidonem, kde kombinace s valproátem nevedla ke změně plazmatických hladin risperidonu ani paliperidonu [10].
Protože je paliperidon v omezeném rozsahu metabolizován prostřednictvím CYP 450 2D6, byla u zdravých dobrovolníků provedena interakční studie, v níž byl současně podán perorální paliperidon a paroxetin jako silný inhibitor CYP 450 2D6. I když se hladina paliperidonu zvýšila u CYP 450 2D6 excesivních metabolizátorů přibližně o 16 %, tato hodnota nebyla považována za klinicky významnou [2, 9, 11].
Aplikace a stanovení optimální dávky
Optimální dávka
U pacientů, kteří v minulosti neužívali perorální paliperidon, perorální či injekční risperidon, je doporučeno před aplikací paliperidonu palmitátu ověřit subjektivní snášenlivost paliperidonu [2]. Předchozí perorální antipsychotická medikace by měla být ukončena při zahájení léčby paliperidonem palmitátem [2]. Oproti předchozím zkušenostem s jinými antipsychotiky nezahajujeme léčbu nejnižší dávkou, ale je naopak doporučeno aplikovat injekci o síle 150 mg a po týdnu (± 2 dny) injekci o síle 100 mg paliperidonu, obě do deltoidního svalu [2].
Doporučená udržovací měsíční (±7 dnů) dávka paliperidonu je 75 mg, avšak tato dávka může být upravena dle individuální snášenlivosti či účinnosti v rozmezí 25 mg až 150 mg paliperidonu. Tyto udržovací dávky (od třetí injekce včetně) mohou být již aplikovány do deltoidního či gluteálního svalu dle preference pacienta. I když dávka paliperidonu palmitátu může být měněna při každé měsíční aplikaci, vzhledem k dlouhému eliminačnímu poločasu bude však rovnovážného stavu paliperidonu dosaženo až v řádu několika měsíců [9]. Denní dávce 12 mg perorálního paliperidonu odpovídá přibližně injekce s množstvím 150 mg paliperidonu (234 mg paliperidonu palmitátu) aplikovaná jednou za čtyři týdny. Podobné korelace platí mezi 9 mg perorálního paliperidonu a 100 mg
injekčního paliperidonu (156 mg paliperidonu palmitátu), 6 mg perorálního paliperidonu a 75 mg injekčního paliperidonu (117 mg paliperidonu palmitátu) či 3 mg perorálního paliperidonu a 25 mg až 50 mg injekčního paliperidonu (39 mg až 78 mg paliperidonu palmitátu). Všechny injekce paliperidonu palmitátu se aplikují jednou za měsíc [9].
 I když je v současnosti obtížné říci, jaká dávka paliperidonu palmitátu bude v podmínkách běžné klinické praxe nejvíce užívána, z provedených studií vyplývá, že se bude spíše jednat o dávky 100 mg a 150 mg. Nižší dávky (50 mg anebo 75 mg) budou používány spíše při příznivém průběhu onemocnění či v počátečních stadiích schizofrenie [7, 9].
I když je v současnosti obtížné říci, jaká dávka paliperidonu palmitátu bude v podmínkách běžné klinické praxe nejvíce užívána, z provedených studií vyplývá, že se bude spíše jednat o dávky 100 mg a 150 mg. Nižší dávky (50 mg anebo 75 mg) budou používány spíše při příznivém průběhu onemocnění či v počátečních stadiích schizofrenie [7, 9].
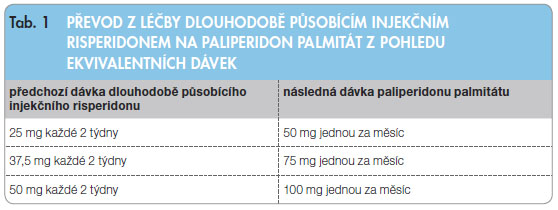
Pokud pacienta převádíme na paliperidon palmitát z léčby jiným depotním či dlouhodobě působícím injekčním antipsychotikem, paliperidon palmitát by měl být podán v termínu další plánované aplikace předchozího antipsychotika. Dále se pokračuje v měsíčních aplikacích bez nutnosti podání dvou deltoidních injekcí v týdenním intervalu [2]. Převod z léčby dlouhodobě působícím injekčním risperidonem na léčbu paliperidonem palmitátem zobrazuje tab. 1.
Specifické populace
Velikost aplikované dávky je také nezbytné zvažovat s ohledem na specifickou populaci, jíž je paliperidon palmitát podáván. Pro pacienty s mírným stupněm renálního selhávání (pro pacienty se středním či závažným stupněm renálního selhávání není paliperidon palmitát doporučen vůbec) je doporučeno zahájit léčbu injekcí o dávce 100 mg paliperidonu (156 mg paliperidonu palmitátu) a po týdnu aplikovat injekci o síle 75 mg paliperidonu (117 mg paliperidonu palmitátu), následné měsíční udržovací dávky by měly obsahovat 50 mg paliperidonu (78 mg paliperidonu palmitátu). Pro pacienty s mírnou nebo středně závažnou jaterní poruchou či seniory bez ledvinné poruchy není úprava dávek paliperidonu palmitátu nijak stanovena. Rovněž ve vztahu k rase, pohlaví či nikotinismu neexistuje ohledně úpravy doporučené dávky žádné specifické doporučení [2, 9].
Opomenutí/vynechání dávky
Pokud pacient zmešká termín podání následné udržovací injekce do doby 6 týdnů od poslední aplikace, měl by mu být aplikován co nejdříve paliperidon v injekční dávce, na níž byl dlouhodobě stabilizován. Není tedy nutné dávku injekce zvyšovat či měnit zavedené schéma aplikací, další injekci obdrží ve čtyřtýdenním intervalu. Pokud však zpoždění mezi dvěma injekcemi přesáhne dobu 6 týdnů, potom musí být aplikovány dvě injekce v týdenním intervalu do deltoidního svalu. Dávka těchto injekcí má být shodná s dávkou, na které byl pacient dlouhodobě stabilizován. Pouze pokud byl pacientův zdravotní stav stabilizován dávkou 150 mg paliperidonu, bude dávka prvních dvou injekcí 100 mg paliperidonu. V případě, že pacient vynechal v udržovací terapii paliperidonem palmitátem více než 6 měsíců, měla by být léčba zahájena shodně jako v případě nového pacienta [2, 9].
Velikost jehly
Doporučená velikost jehly pro aplikaci paliperidonu palmitátu do deltoidního svalu závisí na tělesné hmotnosti pacienta. Pro pacienty s tělesnou hmotností alespoň 90 kg je doporučena jehla o délce 11 palce, 22G (38,1 × 0,72 mm), zatímco pro pacienty s hmotností do 90 kg postačí jehla o délce 1 palce, 23G (25,4 × 0,64 mm). Pro aplikace do gluteálního svalu je bez ohledu na hmotnost pacienta doporučena jehla o délce 11 palce, 22G (38,1 × 0,72 mm). Při opakovaných aplikacích do stejné svalové skupiny by se místa vpichu měla pravidelně střídat [2, 7, 9].
Závěr
Paliperidon palmitát je díky svým vlastnostem předurčen pro roli ideálního dlouhodobě působícího injekčního antipsychotika 2. generace – nevyžaduje perorální suplementaci, je aplikován pomocí malých jehel, v malém objemu a v měsíčních intervalech. Není ani nutné pacienta v období po aplikaci injekce speciálně monitorovat. Paliperidon palmitát je dodáván v injekcích, které před aplikací nevyžadují žádnou speciální přípravu ani skladování v mrazicím boxu. Širšímu využití paliperidonu palmitátu v klinické praxi brání zejména systém úhrady v České republice [9]. Tato skutečnost však nic nemění na postavení paliperidonu palmitátu jako prototypu moderního injekčního dlouhodobě působícího antipsychotika 2. generace.
Tato práce vznikla díky projektu “CEITEC – Středoevropský technologický institut” (CZ.1.05/1.1.00/02.0068), byla financována z Evropského fondu regionálního rozvoje a podpořena projektem (Ministerstva zdravotnictví ČR) koncepčního rozvoje výzkumné organizace 65269705 (FN Brno).
Seznam použité literatury
- [1] Alkermes. http://www.alkermes.com/
- [2] Janssen, Division of Ortho-McNeil-Janssen Pharmaceuticals, Inc. Invega Sustenna (paliperidone palmitate) Extended-Release Injectable Suspension. Dostupné na http://www.invegasustenna.com/important-product-information (datum poslední revize – září 2011).
- [3] Shayegan DK, Stahl SM. Atypical antipsychotics: matching receptor profile to individual patient’s clinical profile. CNS Spectr 2004; 9 (Suppl. 11): 6–14.
- [4] Samtani MN, Vermeulen A, Stuyckens K. Population pharmacokinetics of intramuscular paliperidone palmitate in patients with schizophrenia: a novel once-monthly, long-acting formulation of an atypical antipsychotic. Clin Pharmacokinet 2009; 48: 585–600.
- [5] Johnson & Johnson. A Randomized, Double-Blind, Placebo-Controlled Study to Evaluate the Efficacy and Safety of 50 and 100 mg eq. of Paliperidone Palmitate in Subjects With Schizophrenia. http://download.veritasmedicine.com/PDF/CR004357_CSR.pdf (accessed September 2009).
- [6] Hough D, Lindenmayer JP, Gopal S, et al. Safety and tolerability of deltoid and gluteal injections of paliperidone palmitate in schizophrenia. Prog Neuropsychopharmacol Biol Psychiatry 2009; 33:1022–1031.
- [7] Švestka J. Paliperidon palmitát – dlouhodobě působící injekční antipsychotikum 2. generace s novou nanotechnologií. Psychiatrie 2011; 15: 224–232.
- [8] Johnson & Johnson. A Randomized, Double-Blind, Placebo-Controlled, Parallel-Group, Dose-Response Study to Evaluate the Efficacy and Safety of 3 Fixed Doses (25 mg eq., 100 mg eq., and 150 mg eq.) of Paliperidone Palmitate in Subjects With Schizophrenia. http://download.veritasmedicine.com/PDF/CR012550_CSR.pdf (accessed September 2009).
- [9] Citrome L. Paliperidone palmitate – review of the efficacy, safety and cost of a new second-generation depot antipsychotic medication. Int J Clin Pract 2010; 64: 216–239.
- [10] Spina E, Avenoso A, Facciola G, et al. Plasma concentrations of risperidone and 9-hydroxyrisperidone: effect of comedication with carbamazepine or valproate. Ther Drug Monit 2000; 22: 481–485.
- [11] Berwaerts J, Cleton A, Herben V, et al. The effects of paroxetine on the pharmacokinetics of paliperidone extended-release tablets. Pharmacopsychiatry 2009; 42: 158–163.