Pembrolizumab – další úspěch imunoterapie v léčbě melanomu
Souhrn:
Melanom se nachází ve středu zájmu imunoterapie již několik desítek let. Za průlom na poli imunomodulační léčby melanomu lze považovat blokádu kontrolního bodu CTLA-4 ipilimumabem. Vyšší četnost léčebných odpovědí a menší toxicitu než ipilimumab má pembrolizumab, což je monoklonální protilátka antiPD-1.
Key words: melanoma – immunotherapy – pembrolizumab – ipilimumab.
Summary:
Intensive attempts at melanoma immunotherapy have taken place for decades now. A breakthrough occurred at this field after the blockade of a key regulatory point, CTLA-4, was achieved with ipilimumab. Pembrolizumab, a monoclonal antibody against PD-1, is associated with higher response rate and lower toxicity than ipilimumab.
Metastazující maligní melanom se řadí mezi nejobtížněji léčitelné diagnózy s mediánem přežití v rozmezí 6–9 měsíců. Přežití pět a více let se uvádí pouze v 1–2 % případů. Ročně umírá v České republice na melanom téměř 400 osob. Na první pohled se toto číslo nezdá dramatické, ale značně nabývá na významu při zjištění skutečnosti, že se obvykle jedná o jedince v produktivním věku.
Ve fázi generalizace představuje melanom jedno z nejobtížněji léčitelných onemocnění. Tento tradiční pohled se s přibývajícími znalostmi o patogenezi melanomu na molekulárněbiologické úrovni začíná měnit příznivým směrem. Nyní je zřejmé, že melanom není homogenní chorobou s jednotnou sadou genetických změn. V rámci personalizované medicíny lze dnes pacientům se specifickou mutací genu BRAF nabídnout inhibitor kinázy BRAF vemurafenib nebo v režimu klinického zkoušení inhibitor kinázy C‑KIT imatinib u osob s mutací C‑KIT.
I když je cílená léčba metastazujícího melanomu účinná, její nevýhodou je, že působí pouze po omezenou dobu. Imunoterapie využívá protinádorovou aktivitu imunitního systému a její účinnost není omezena molekulárním fenotypem nádoru.
Melanom se nachází ve středu zájmu imunoterapie již několik desítek let. V posledních letech tento směr zaznamenal značný pokrok a významně změnil pohled na toto onemocnění. Podařilo se najít konkrétní místa, která lze v imunitním systému aktivovat nebo inhibovat tak, aby pomohla organismu bojovat s nádorem. Hovoříme o tzv. kontrolních bodech (checkpointech).
Inhibitory ch![Obr. 1 Místa působení inhibitorů checkpointů imunitních signálních drah; podle [1–3] – Pardoll, 2012, Ribas, 2012, Topalian, et al., 2012. CTLA-4 – cytotoxic T-lymphocyte-associated protein 4; PD-1 – programmed cell death-1](https://www.remedia.cz/photo-a-30479---.jpg) eckpointů vstupují do komunikace mezi určitými populacemi imunitních buněk a nádorovou buňkou. Jedná se o monoklonální protilátky zaměřené na regulační mechanismy protinádorové imunitní odpovědi. Mezi perspektivní cíle patří molekuly CTLA‑4 (cytotoxic T‑lymphocyte‑associated protein 4) a PD‑1 (programmed cell death‑1). V současnosti jsou lékovými agenturami (FDA a EMA) schváleny pro léčbu u pacientů s pokročilým melanomem (neresekovatelným nebo metastazujícím) dva typy monokloná
eckpointů vstupují do komunikace mezi určitými populacemi imunitních buněk a nádorovou buňkou. Jedná se o monoklonální protilátky zaměřené na regulační mechanismy protinádorové imunitní odpovědi. Mezi perspektivní cíle patří molekuly CTLA‑4 (cytotoxic T‑lymphocyte‑associated protein 4) a PD‑1 (programmed cell death‑1). V současnosti jsou lékovými agenturami (FDA a EMA) schváleny pro léčbu u pacientů s pokročilým melanomem (neresekovatelným nebo metastazujícím) dva typy monokloná![Obr. 2 Místo zásahu pembrolizumabu; podle [1–3] – Pardoll, 2012, Ribas, 2012, Topalian, et al., 2012. MHC – hlavní histokompatibilní komplex, major histocompatibility complex; PD-1 – programmed cell death-1; PD-L1 – programmed cell death ligand- 1; PD-L2 – programmed cell death ligand-2; TCR – T-buněčný receptor, T-cell receptor](https://www.remedia.cz/photo-a-30480---.jpg) lních protilátek na bázi imunoterapie – protilátka anti‑CTLA4 (ipilimumab) a anti‑PD1 (pembrolizumab, nivolumab). Základní rozdíl mezi anti‑CTLA4 a anti‑PD1 spočívá v úrovni jejich působení na imunitní systém. Inhibice CTLA‑4 se odehrává v časných stadiích aktivace T‑lymfocytů převážně v lymfatických uzlinách, zatímco inhibice PD‑1 ovlivňuje T‑lymfocyty v efektorové fázi zejména v mikroprostředí nádoru (obr. 1, 2). Ovlivnění receptoru PD‑1 je účinnější než inhibice CTLA‑4. Výsledky klinických studií ukázaly vyšší četnost léčebných odpovědí, jejich rychlejší nástup a zároveň i nižší toxicitu léčby.
lních protilátek na bázi imunoterapie – protilátka anti‑CTLA4 (ipilimumab) a anti‑PD1 (pembrolizumab, nivolumab). Základní rozdíl mezi anti‑CTLA4 a anti‑PD1 spočívá v úrovni jejich působení na imunitní systém. Inhibice CTLA‑4 se odehrává v časných stadiích aktivace T‑lymfocytů převážně v lymfatických uzlinách, zatímco inhibice PD‑1 ovlivňuje T‑lymfocyty v efektorové fázi zejména v mikroprostředí nádoru (obr. 1, 2). Ovlivnění receptoru PD‑1 je účinnější než inhibice CTLA‑4. Výsledky klinických studií ukázaly vyšší četnost léčebných odpovědí, jejich rychlejší nástup a zároveň i nižší toxicitu léčby.
Pembrolizumab, humanizovaná monoklonální protilátka IgG4 namířená proti receptoru PD‑1, je dnes schválen pro léčbu metastazujícího melanomu ve 25 zemích světa. Zároveň globálně probíhá více než sto klinických studií s více než 16 000 pacienty a třiceti různými typy nádorů léčenými pembrolizumabem v monoterapii nebo v kombinaci.
Mechanismus účinku
Pembrolizumab je protilátka, která se váže na receptor programované buněčné smrti PD‑1 a blokuje jeho interakci s ligandy PD‑L1 a PD‑L2. Receptor PD‑1 je negativním regulátorem aktivity T‑lymfocytů. Pembrolizumab zvyšuje aktivitu T‑lymfocytů včetně protinádorové odpovědi. Ligandy PD‑L1 a PD‑L2 jsou přítomny na antigen prezentujících buňkách a mohou být exprimovány nádorovými nebo jinými buňkami v mikroprostředí nádoru. Receptor PD‑1 je tzv. up‑regulován na aktivovaných T‑lymfocytech v průběhu efektorové fáze imunitní odpovědi. Ligandy PD‑L1 a PD‑L2 využívají tento receptor k tzv. down‑regulaci aktivity T‑lymfocytů v efektorové fázi.
Receptor PD‑1 a jeho úloha při nádorovém onemocnění
Díky rozšiřujícím se znalostem imunitního systému roste také naše porozumění jeho mechanismům, kterých se využívá při léčbě nádorového onemocnění. Receptor PD‑1 je považován za primární regulátor aktivity T‑lymfocytů v průběhu efektorové fáze imunitní reakce. Tento receptor může také tlumit aktivitu nádorově specifických T‑lymfocytů v mikroprostředí nádoru. Receptor PD‑1 se za normálních podmínek podílí na tlumení aktivity T‑lymfocytů v periferních tkáních s cílem zabránit poškození kolaterální tkáně během imunitní reakce. K aktivaci PD‑1 dochází jeho vazbou s ligandy PD‑L1 a PD‑L2. Nádorové buňky mohou exprimovat oba tyto ligandy a s jejich pomocí využít dráhu PD‑1 s kontrolními body imunitního systému ke svému úniku před imunitní reakcí. Řada nádorových buněk exprimuje na svém povrchu ligandy PD‑L1, které se mohou v mikroprostředí nádoru vázat na receptory PD‑1 a tím tlumit aktivitu nádorově specifických T‑lymfocytů. Nádorové buňky mohou k úniku před imunitní reakcí využívat také ligand PD‑L2. Bylo zjištěno, že množství exprimovaných molekul ligandu PD‑L1 se u jednotlivých nádorových buněk liší, význam exprese ligandu PD‑L1 zůstává i nadále předmětem onkologického výzkumu. Role PD‑L1 není u melanomu známa, ale až 50 % melanomů tento ligand exprimuje. Blokací vazby PD‑L1 a PD‑L2 na PD‑1 se zvyšuje aktivita T‑lymfocytů včetně protinádorové odpovědi.
Klinické zkušenosti
Přinos léčby pembrolizumabem byl prokázán u dospělých pacientů s pokročilým (neresekovatelným nebo metastazujícím) melanomem, kteří nebyli předléčeni ipilimumabem – tzv. ipilimumab‑naivní (pro celkové přežití – OS, poměr rizik – HR – 0,69, interval spolehlivosti – 95% CI: 0,52–0,90; p < 0,00358; pro dobu přežití bez progrese – PFS, HR 0,58, 95% CI: 0,47–0,72; p < 0,00001 v porovnání s ipilimumabem), a také u podskupiny pacientů, kteří už v minulosti podstoupili léčbu ipilimumabem (PFS HR 0,57, 95% CI: 0,45–0,73; p < 0,0001 v porovnání s chemoterapií).
Klinická studie KEYNOTE‑006
KEYNOTE‑006 byla multicentrická kontrolovaná studie fáze III, která u 834 ipilimumab‑naivních pacientů porovnávala účinnost léčby pembrolizumabem v dávce 10 mg/kg podávané každé dva nebo tři týdny proti ipilimumabu [4]. Z 834 pacientů jich bylo 549 léčeno v první linii léčby; 284 pacientů bylo léčeno ve druhé linii léčby a jeden pacient byl léčen ve třetí linii léčby. Primárními cíli klinického hodnocení bylo přežití bez progrese nemoci (PFS) a celkové přežití (OS). Už v plánované předběžné analýze pembrolizumab prokázal lepší výsledky PFS i OS v porovnání s ipilimumabe![Graf 1 a,b Doba přežití bez progrese (a) a celkové přežití (b) v klinické studii KEYNOTE-006; podle [4] – Robert, et al., 2015.](https://www.remedia.cz/photo-a-30481---.jpg) m.
m.
Odhadovaná míra šestiměsíčního PFS pro pembrolizumab byla 47,3 % (HR 0,58; 95% CI: [0,46; 0,72]; p < 0,00001) v rameni s léčbou podávanou každé 2 týdny (n = 279) a 46,4 % (HR 0,58; 95% CI: [0,47; 0,72]; p < 0,00001) v léčebném rameni s intervalem podávání každé 3 týdny (n = 277), v porovnání s 26,5 % v rameni s ipilimumabem (n = 278). Jednoleté OS v ramenech s pembrolizumabem bylo 74,1 % (každé 2 týdny; HR 0,63; 95% CI [0,47–0,83]; p < 0,0005) a 68,4 % (léčba každé 3 týdny; HR 0,69; 95% CI [0,52–0,90]; p = 0,0036), v porovnání s 58,2 % v rameni s ipilimumabem (graf 1a, b). Podávání pembrolizumabu každé 3 týdny v porovnání s ipilimumabem vedlo k 31% snížení počtu úmrtí v léčebném rameni (HR 0,69) a k 37% snížení rizika úmrtí v léčebném rameni s léčbou každé 2 týdny (HR 0,63). Míra odpovědí na léčbu v rameni s pembrolizumabem podávaným každé 2 týdny byla 33,7 % (p < 0,001 vs. ipilimumab); v rameni s pembrolizumabem každé 3 týdny 32,9 % (p < 0,001 vs. ipilimumab) a v rameni s ipilimumabem 11,9 %.
Nejčastějšími nežádoucími účinky spojenými s léčbou jakéhokoliv stupně, které se vyskytly v léčebných ramenech s monoterapií pembrolizumabem podávaným každé dva týdny ve srovnání s podáváním pembrolizumabu každé tři týdny, byly únava (20,9 % vs. 19,1 %), průjem (16,9 % vs. 14,4 %), exantém (14,7 % vs. 13,4 %) a pruritus (14,4 % vs. 14,1 %). Nežádoucí příhody 3. a 4. stupně se celkově vyskytly u méně než 1 % pacientů, s výjimkou průjmu (2,5 % vs. 1,1 %). V rameni s léčbou ipilimumabem byl nejčastěji se vyskytujícím nežádoucím účinkem pruritus (25,4 %), průjem (22,7 %), slabost (15,2 %) a exantém (14,5 %); tyto události se vyskytly ve stupni závažnosti 3–4 u méně než 1 % pacientů, s výjimkou průjmu (3,1 %) a únavy (1,2 %).
Mezi nežádoucí události zvláštního zájmu patřily autoimunitní anebo imunitně podmíněné reakce. Při léčbě pembrolizumabem to byla nejčastěji hypotyreóza (10,1 % vs. 8,7 %) a hypertyreóza (6,5 % vs. 3,2 %). Mezi události stupně závažnosti 3–4, které byly hlášeny u více než 1 % pacientů léčených pembrolizumabem, patřila kolitida (1,4 % vs. 2,5 %) a hepatitida (1,1 % vs. 1,8 %). V rameni s ipilimumabem byla jako událost zvláštního zájmu nejčastěji hlášena kolitida (8,2 % pacientů). Mezi události 3. a 4. stupně, které byly hlášeny u více než 1 % pacientů léčených ipilimumabem, patřila kolitida (7 %) a hypofyzitida (1,6 %). Hypotyreóza a hypertyreóza tak byla nejčastěji hlášenou událostí u pacientů léčených pembrolizumabem a kolitida a hypofyzitida nejčastější událostí u pacientů léčených ipilimumabem.
Klinické studie KEYNOTE‑001 a KEYNOTE‑002
KEYNOTE‑001
V klinickém hodnocení KEYNOTE‑001 byl pembrolizumab podáván v rozdílných dávkách 411 pacientům, a to jak pacientům předléčeným ipilimumabem (a BRAF V600‑pozitivním, předléčeným inhibitory BRAF a MEK), tak také pacientům, kterým léčba ipilimumabem podána nebyla [5,6]. Na základě výsledků z randomizované fáze studie u 173 pacientů porovnávající dávku pembrolizumabu 2 mg/kg s dávkou 10 mg/kg při léčbě každé 3 týdny byla stanovena dávka pro budoucí indikaci v léčbě maligního melanomu.
KEYNOTE‑002
V multicentrickém randomizovaném klinickém hodnocení fáze II KEYNOTE‑002 byl pembrolizumab porovnáván ![Graf 2 Přežití bez progrese onemocnění v jednotlivých ramenech klinické studie KEYNOTE-002 s pacienty léčenými pembrolizumabem vs. chemoterapií; podle [7] – Ribas, et al., 2015. CI – confi dence interval, interval spolehlivosti; HR – hazard ratio, poměr rizik](https://www.remedia.cz/photo-a-30482---.jpg) s chemoterapií zvolenou pro danou studii u 540 pacientů s pokročilým melanomem, kteří byli v minulosti předléčeni ipilimumabem (a u BRAF‑pozitivních i pacientů předléčených inhibitory BRAF a MEK). Primárními cílovými ukazateli byly PFS a OS [7] (graf 2).
s chemoterapií zvolenou pro danou studii u 540 pacientů s pokročilým melanomem, kteří byli v minulosti předléčeni ipilimumabem (a u BRAF‑pozitivních i pacientů předléčených inhibitory BRAF a MEK). Primárními cílovými ukazateli byly PFS a OS [7] (graf 2).
Souhrn závěrů z klinických studií
Ve studii KEYNOTE‑001 prokázal pembrolizumab účinnost u pacientů předléčených i nepředléčených ipilimumabem, a to bez ohledu na dávku (2 mg/kg každé 3 týdny vs. 10 mg/kg každé 3 týdny), v obou skupinách bylo dosaženo dlouhodobé léčebné odpovědi. Ve studii KEYNOTE‑002 dosáhl pembrolizumab vyšší četnosti léčebných odpovědí ve srovnání s chemoterapií u pacientů předléčených ipilimumabem, signifikantního prodloužení PFS napříč všemi podskupinami bez ohledu na dávku (2 mg/kg každé 3 týdny vs. 10 mg/kg každé 3 týdny) a nižší toxicity léčby.
Ve studii KEYNOTE‑006 dosáhl pembrolizumab vyšší četnosti léčebných odpovědí, signifikantního prodloužení PFS a OS oproti ipilimumabu u pacientů nepředléčených ipilimumabem‚ včetně nepředléčených pacientů s mutací genu BRAF, a nižší toxicity léčby.
Ve všech třech s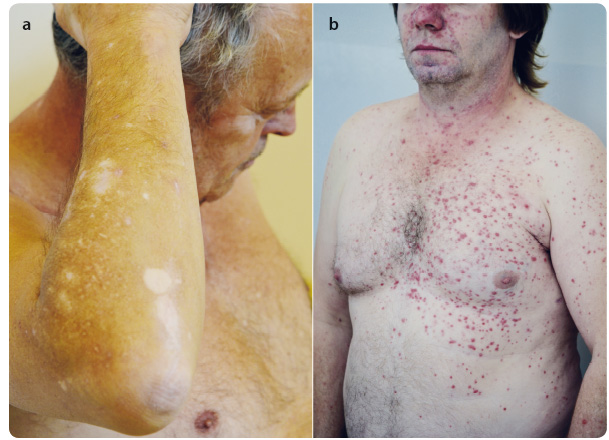 tudiích se ukázalo, že pembrolizumab je účinný jak v první, tak ve druhé linii léčby a že má smysl léčit i pacienty, u kterých došlo při podávání ipilimumabu k selhání léčby. V rameni s pembrolizumabem byly dokumentovány významně lepší výsledky v počtu léčebných odpovědí i v mediánu doby do progrese onemocnění.
tudiích se ukázalo, že pembrolizumab je účinný jak v první, tak ve druhé linii léčby a že má smysl léčit i pacienty, u kterých došlo při podávání ipilimumabu k selhání léčby. V rameni s pembrolizumabem byly dokumentovány významně lepší výsledky v počtu léčebných odpovědí i v mediánu doby do progrese onemocnění.
Četnost léčebných odpovědí na léčbu pembrolizumabem je statisticky signifikantně vyšší u melanomů, které exprimují PD‑L1. Na léčbu odpovídají ale i pacienti s PD‑L1‑negativním tumorem a účinnost je vyšší než u pacientů léčených chemoterapií. Léčebné odpovědi nesouvisely s mutací genu BRAF.
Většina zaznamenaných nežádoucích účinků je stupně 1–2 a jejich závažnost je mírnější než při léčbě ipilimumabem. Nejčastěji se setkáváme s únavou, s průjmem nebo s kožním exantémem [8] (obr. 3a, b). Zvláštní pozornost by měla být věnována imunitně zprostředkovaným nežádoucím účinkům. Většina z nich, včetně těžkých reakcí, byla vyřešena po zahájení příslušné léčby nebo po ukončení léčby pembrolizumabem.
Kasuistika
Léčba pembrolizumabem u pacienta s metastazujícím melanomem
Pacientovi ve věku 64 let byl v květnu 2015 excidován maligní melanom v parietální části kalvy. Histologicky se jednalo o nodulární maligní melanom s ulcerací, se suspektní nádorovou angiopatií, mitózy > 5 mm2, Breslow 3,1 mm a se 4 satelitními metastázami. Sentinelová uzlina znázorněná na krku vlevo subaurikulárně obsahovala mikrometastázu maligního melanomu.
Během 14 dnů po operaci – v červnu 2015 – došlo k rozsevu kožních metastáz na kalvě. Rychlá progrese mnohočetných lividně zbarvených nodosit pokračovala směrem ventrálním i kaudálním a v téže době se objevila i hmatná rezistence na krku preaurikulárně vlevo o velikosti 3 cm × 2 cm (obr. 4a, b). Další rezistence byla hm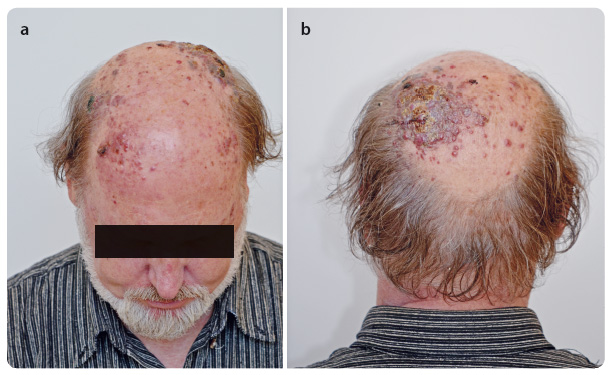 atná během několika dalších dnů i na pravé straně krku před m. sternocleidomastoideus.
atná během několika dalších dnů i na pravé straně krku před m. sternocleidomastoideus.
V osobní anamnéze pacient uvedl, že od čtyřiceti let trpí epilepsií a sedm let se léčí s arteriální hypertenzí. Patologické hodnoty v odběrech krve byly v červnu 2015 tyto: laktátdehydrogenáza (LDH) 5,18 µkat/l, C‑reaktivní protein (CRP) 25,2 mg/l a leukocyty 12,8 × 109/l ‚ ostatní hodnoty byly v normě. Stagingová vyšetření odhalila patologicky zvětšené lymfatické uzliny na krku bilaterálně, více vlevo. Ostatní nálezy zjištěné při vyšetření počítačovou tomografií byly bez patologie.
Pacient byl vzhledem k neresekovatelnému stadiu IIIC a vzhlede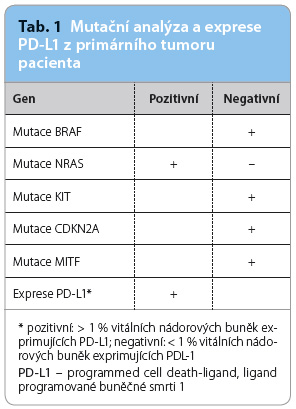 m k negativní mutaci BRAF indikován k léčbě ipilimumabem (tab. 1). Při imunoterapii zároveň probíhala radioterapie kožních metastáz na kalvě. Pacient absolvoval 4 infuze ipilimumabu v dávce 3 mg/kg podávané ve třítýdenních intervalech a radioterapii dávkou 39 Gy aplikovanou ve 13 frakcích 60Co pomocí přístroje Teragam od června do srpna 2015.
m k negativní mutaci BRAF indikován k léčbě ipilimumabem (tab. 1). Při imunoterapii zároveň probíhala radioterapie kožních metastáz na kalvě. Pacient absolvoval 4 infuze ipilimumabu v dávce 3 mg/kg podávané ve třítýdenních intervalech a radioterapii dávkou 39 Gy aplikovanou ve 13 frakcích 60Co pomocí přístroje Teragam od června do srpna 2015.
Zhodnocení léčebné odpovědi jsme prová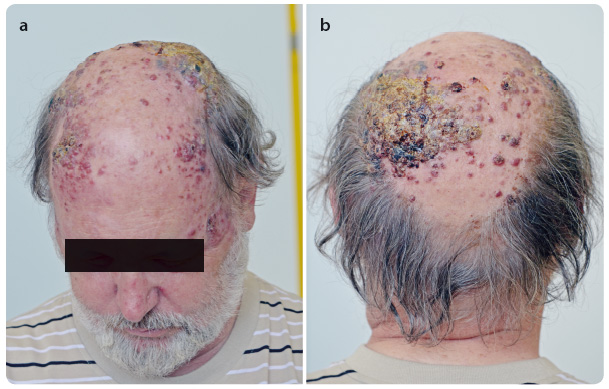 děli ve 12. týdnu, resp. v 16. týdnu léčby ipilimumabem. U pacienta došlo jak ke klinické progresi, tak i ke zvětšení lymfatických uzlin na krku (obr. 5a, b). Nález byl hodnocen jako progrese onemocnění dle irRC (immune‑related response criteria).
děli ve 12. týdnu, resp. v 16. týdnu léčby ipilimumabem. U pacienta došlo jak ke klinické progresi, tak i ke zvětšení lymfatických uzlin na krku (obr. 5a, b). Nález byl hodnocen jako progrese onemocnění dle irRC (immune‑related response criteria).
Pacient byl následně v říjnu 2015 zařazen do specifického léčebného programu s pembrolizumabem. Léčba pembrolizumabem probíhala intravenózně ve třítýdenních intervalech v dávce 2 mg/kg. Po dobu aplikace se u pacienta neprojevily vážnější nežádoucí účinky, jen únava v souvislosti s infuzí.
Již po čtvrté infuzi pembrolizumabu jsme pozorovali významnou regresi metastáz na kalvě, postupné vymizení otoku a palpační vymiz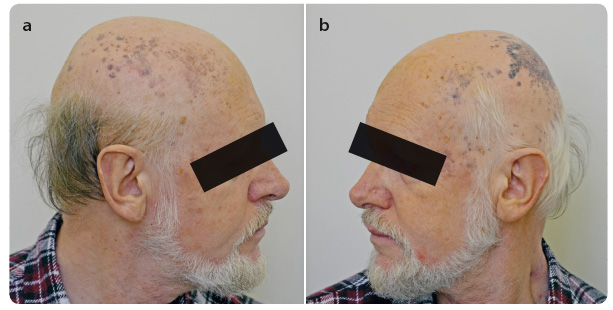 ení rezistencí na krku (obr. 6a, b). Ve třetím měsíci léčby pembrolizumabem zobrazovací metody ukázaly významnou regresi velikosti lymfatických uzlin na krku bez dalších nových ložisek (obr. 7a, b). V laboratorním vzorku odebrané krve jsme zaznamenali již fyziologické hodnoty LDH, CRP, leukocytů i ostatních parametrů. Tmavé hyperpigmentované makuly na kalvě jsme bioptovali a bylo provedeno histologické a imunohistochemické vyšetření (obr. 8a, b). Při barvení hematoxyl
ení rezistencí na krku (obr. 6a, b). Ve třetím měsíci léčby pembrolizumabem zobrazovací metody ukázaly významnou regresi velikosti lymfatických uzlin na krku bez dalších nových ložisek (obr. 7a, b). V laboratorním vzorku odebrané krve jsme zaznamenali již fyziologické hodnoty LDH, CRP, leukocytů i ostatních parametrů. Tmavé hyperpigmentované makuly na kalvě jsme bioptovali a bylo provedeno histologické a imunohistochemické vyšetření (obr. 8a, b). Při barvení hematoxyl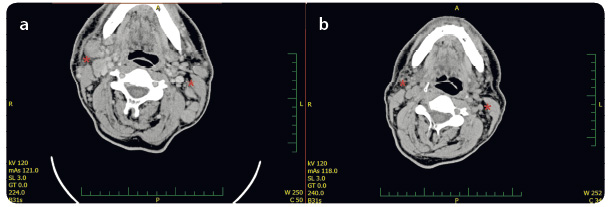
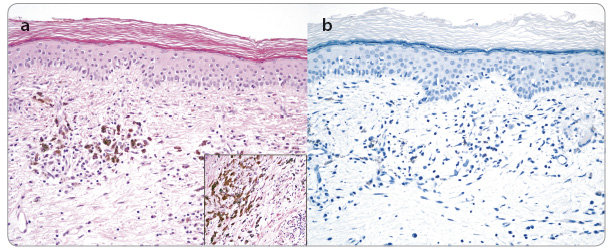 inem‑eosinem nebyly prokázány vitální nádorové melanocyty. Byl detekován výrazný kulatobuněčný zánětlivý infiltrát v mírně fibrózním koriu s kolekcemi melanofágů. Vitální nádorové melanocyty nebyly prokázány ani imunohistochemickým vyšetřením (protilátka proti HMB45, S100 proteinu a Melan A).
inem‑eosinem nebyly prokázány vitální nádorové melanocyty. Byl detekován výrazný kulatobuněčný zánětlivý infiltrát v mírně fibrózním koriu s kolekcemi melanofágů. Vitální nádorové melanocyty nebyly prokázány ani imunohistochemickým vyšetřením (protilátka proti HMB45, S100 proteinu a Melan A).
Diskuse
V této kasuistice uvádíme příklad pacienta, který zareagoval na léčbu pembrolizumabem výraznou regresí nádorové hmoty i navzdory předchozímu selhání léčby ipilimumabem. Již ve studiích KEYNOTE‑001 a KEYNOTE‑002 byla prokázána účinnost pembrolizumabu u pacientů neléčených i předléčených ipilimumabem. U pacienta se neobjevily výraznější nežádoucí účinky spojené s léčbou, pouze únava stupně 1/2. Pozitivními prediktivními ukazateli byla pozitivita exprese PDL‑1 a jistě i synergismus radioterapie a imunoterapie.
Závěr
Pembrolizumab je dle schválení Evropské komise ze dne 17. 7. 2015 indikován k monoterapii pokročilého (neresekovatelného nebo metastazujícího) melanomu u dospělých. Doporučená dávka je 2 mg/kg podávaná intravenózně po dobu 30 minut každé tři týdny. Pacienty je nutno přípravkem léčit do progrese nemoci nebo do vzniku nepřijatelné toxicity. Přibližně u 7 % pacientů byly při léčbě pembrolizumabem pozorovány atypické odpovědi (tj. počáteční přechodné zvětšení nádoru nebo vznik nových malých lézí během prvních několika měsíců následované zmenšením nádoru). U klinicky stabilních pacientů s počátečními známkami progrese nemoci se doporučuje pokračovat v léčbě, dokud se progrese nepotvrdí.
Doporučení Evropské společnosti pro klinickou onkologii (European Society for Medical Oncology, ESMO) z roku 2015 [9] definují současné postavení pembrolizumabu mezi ostatními léčivy; přípravek anti‑PD1 je upřednostňovanou první linií léčby u pacientů s onemocněním bez mutace genu BRAF; přípravky anti‑PD1 jsou doporučeny také jako léčba druhé linie po selhání ipilimumabu.
Kinázové inhibitory, ipilimumab a/nebo přípravky anti‑PD1 mohou být bezpečně použity také u pacientů se symptomatickými mozkovými metastázami (účinek byl u těchto pacientů potvrzen).
Fotografie v článku: archiv autorky.
Seznam použité literatury
- [1] Pardoll DM. The blockade of immune checkpoints in cancer immunotherapy. Nat Rev Cancer 2012; 12: 252–264.
- [2] Ribas A. Tumor Immunotherapy Directed at PD 1. N Engl J Med 2012; 366: 2517–2519.
- [3] Topalian SL, Drake CG, Pardoll DM. Targeting the PD 1/B7 H1(PD L1) pathway to activate anti tumor immunity. Curr Opin Immunol 2012; 24: 207–212.
- [4] Robert C, Schachter J, Long GV, et al. Pembrolizumab versus Ipilimumab in Advanced Melanoma. N Engl J Med 2015; 372: 2521–2532.
- [5] Hamid O, Robert C, Daud A, et al. Safety and tumor responses with lambrolizumab (anti PD 1) in melanoma. N Engl J Med 2013; 369: 134–144.
- [6] Robert C, Ribas A, Wolchok JD, et al. Anti programmed death receptor 1 treatment with pembrolizumab in ipilimumab refractory advanced melanoma: a randomised dose comparison cohort of a phase 1 trial. Lancet 2014; 384: 1109–1117.
- [7] Ribas A, Puzanov I, Dummer R, et al. Pembrolizumab versus investigator choice chemotherapy for ipilimumab refractory melanoma (KEYNOTE 002): a randomised, controlled, phase 2 trial. Lancet Oncol 2015; 16: 908–918.
- [8] Sanlorenzo M, Vujic I, Daud A, et al. Pembrolizumab Cutaneous Adverse Events and Their Association With Disease Progression. JAMA Dermatol 2015; 151: 1206–1212.
- [9] Dummer R, Hauschild A, Lindenblatt N, et al. Cutaneous melanoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow up. Ann Oncol 2015; 26: 126–132.