Pembrolizumab v první linii léčby nemalobuněčného karcinomu plic
Souhrn:
Skřičková J, Kadlec B. Pembrolizumab v první linii léčby nemalobuněčného karcinomu plic. Remedia 2019; 29: 315–318.
Karcinom plic patří mezi nejčastěji diagnostikované druhy karcinomu u nás i ve světě a zůstává i hlavní příčinou úmrtí na nádorové onemocnění. Přibližně u 85 % bronchogenních karcinomů se jedná o nemalobuněčný karcinom (non‑small cell lung cancer, NSCLC). Tradiční léčbou většiny pacientů s pokročilým NSCLC zůstává kombinovaná chemoterapie založená na platinovém derivátu. Imunoterapie je považována za novou účinnou metodu léčby pokročilého NSCLC. Z druhé linie léčby začíná pronikat do linie první. Pembrolizumab v první linii indikujeme u pacientů s nádory s expresí PD‑L1 50 % a vyšší.
Summary:
Skrickova J, Kadlec B. Pembrolizumab in the first line treatment of non‑small cell lung carcinoma. Remedia 2019; 29: 315–318.
Lung carcinoma belongs to the group of most often diagnosed types of carcinoma here as well as worldwide and remains the leading cause of death from cancer. Approximately 85% of bronchogenic carcinomas are non‑small cell carcinomas (NSCLC). Traditional treatment for the majority of patients with advanced NSCLC remains to be combined chemotherapy based on platinum derivates. Immunotherapy is considered to be a new effective treatment modality in advanced NSCLC. It is shifting from second line of treatment to the first. Pembrolizumab in the first line of treatment is indicated in patients with tumors expressing PD‑L1 in more than 50% rate.
Key words: non‑small‑cell lung carcinoma, immunotherapy, PD‑L1 expression , pembrolizumab.
Úvod
Karcinom plic patří mezi nejčastěji diagnostikované druhy karcinomu u nás i ve světě a zůstává jednou z hlavních příčin úmrtí na nádorové onemocnění. Zhruba u 85 % bronchogenních karcinomů se jedná o nemalobuněčný karcinom (non small cell lung cancer, NSCLC) a u 15 % o malobuněčný karcinom (small cell lung cancer, SCLC). Histologicky rozlišujeme NSCLC na adenokarcinom, skvamózní karcinom, velkobuněčný karcinom, kombinovaný NSCLC, který obsahuje složku adenokarcinomu i skvamózního karcinomu, a blíže nespecifikovaný NSCLC (not otherwise specified, NOS). V posledních letech vzrůstá zejména incidence adenokarcinomu. V souvislosti s kouřením se častěji vyskytuje skvamózní typ karcinomu, adenokarcinom je nejčastějším histologickým typem u nekuřáků [1,2].
I přes neustále se rozšiřující možnosti cílené léčby, z níž má prospěch v bělošské populaci pouze menší část pacientů (10‒15 %), zůstává tradiční terapií většiny nemocných trpících NSCLC kombinovaná chemoterapie založená na platinovém derivátu [3].
Léčba pacientů s pokročilým NSCLC je paliativní a má za cíl prodloužit přežití a zachovat kvalitu života po co nejdelší dobu při co nejmírnějších nežádoucích účincích protinádorové terapie. Novým přístupem k léčbě pokročilého nádorového onemocnění plic je imunoterapie. Tato léčba není zaměřena na nádor samotný, ale na imunitní systém pacienta. Cílem léčby je podpořit imunitní systém tak, aby mohl odstranit nádorové buňky. Klíčovou roli hrají antigen prezentující buňky, které pohlcují antigeny a ty potom předkládají T lymfocytům, jež po aktivaci opouštějí lymfatické uzliny a destruují nádorové buňky. Imunitní systém je přísně regulován, aby nedošlo k destrukci vlastních tkání. Na regulaci imunitního systému se podílí řada molekul a mechanismů. V poslední době je věnována největší pozornost povrchovým molekulám, které efektivně omezují proliferaci T lymfocytů a jejich destrukční kapacitu. Tyto molekuly se nazývají kontrolní body imunitní reakce. Receptor programované buněčné smrti 1 (programmed cell death protein 1, PD 1) je exprimován na aktivovaných T a B lymfocytech a je znakem „vyčerpanosti“ těchto buněk. V nádorovém mikroprostředí je aktivován vazbou na ligandy PD L1 a PD L2. Tyto se fyziologicky vyskytují na T a B lymfocytech, makrofázích, NK buňkách, dendritických a žírných buňkách, ale i na nádorových buňkách. Vazba ligandu s PD 1 na povrchu T lymfocytů vede k jejich inaktivaci či smrti, proto vazba monoklonální protilátky na PD 1 či na jeho ligand znamená obnovení aktivity T lymfocytů [4].
Pembrolizumab
Jedním z přípravků
imunoonkologické léčby, který je účinný v léčbě NSCLC,
je pembrolizumab. Jedná se o humánní monoklonální
protilátku, která se váže na PD 1 a blokuje tak
jeho interakci s PD L1 a PD L2. Receptor PD 1
je negativním regulátorem aktivity T lymfocytů a za fyziologických
podmínek slouží k potlačení jejich aktivity v periferní
tkáni a zmírňuje poškození okolní tkáně zánětlivou
odpovědí. Stejného efektu může dosáhnout i nádor, a to
v případě, kdy nádorové buňky nebo buňky mikroprostředí
na svém povrchu exprimují PD L1/PD L2. Tyto ligandy
svou vazbou na receptor PD 1 potlačí aktivitu T lymfocytů
a nádor tak může uniknout imunitnímu dozoru a nekontrolovaně
růst. Zablokování receptoru PD 1 pembrolizumabem znemožní
vazbu příslušných ligandů a tím dochází k posílení
T lymfocytární imunitní odpovědi organismu a síla
imunitního systému může být použita i v boji proti
samotnému nádoru (obr. 1)
[5‒7].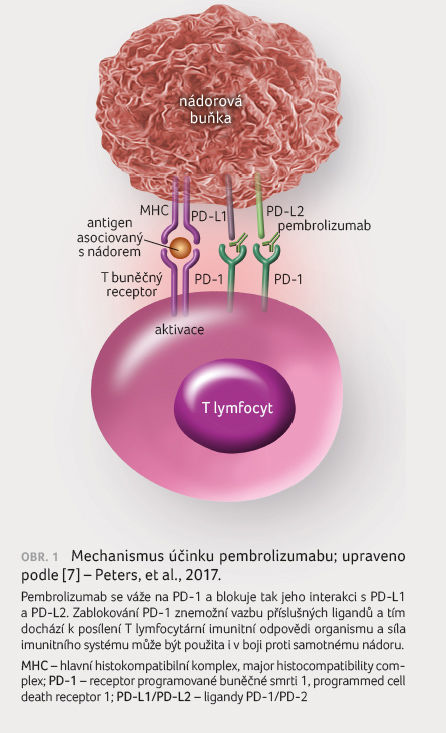
První registrace pro léčbu NSCLC byla udělena Evropskou lékovou agenturou (EMA) v srpnu 2016 pro léčbu pacientů s lokálně pokročilým nebo metastatickým NSCLC s pozitivní expresí PD L1 (TPS [tumor proportion score] ≥ 1 %), u kterých došlo k progresi po léčbě minimálně jedním chemoterapeutickým režimem na bázi platiny a v případě přítomnosti aktivační mutace EGFR (receptor pro epidermální růstový faktor)/translokace ALK (anaplastická lymfomová kináza) také při léčbě příslušným tyrozinkinázovým inhibitorem. Registrace proběhla na základě výsledků dat ze studie KEYNOTE 010 [8].
Pembrolizumab v první linii léčby metastatického NSCLC v monoterapii u nemocných s NSCLC a s vysokou expresí PD L1
V lednu 2017 byl pembrolizumab v zemích Evropské unie registrován také pro léčbu NSCLC v první linii léčby NSCLC. Léčba pembrolizumabem v monoterapii v první linii je určena nemocným s metastatickým NSCLC s vysokou expresí PD L1 (TPS ≥ 50 %), u kterých nebyla prokázána mutace EGFR/translokace ALK. Registrace byla podpořena výsledky studie KEYNOTE 024 [9].
KEYNOTE 024 byla multicentrická kontrolovaná, randomizovaná otevřená studie fáze III, která porovnávala účinnost a bezpečnost pembrolizumabu v první linii léčby ve srovnání s chemoterapií na bázi platiny dle volby investigátora u pacientů s NSCLC, jejichž nádory vykazovaly silnou expresi PD L1 (TPS ≥ 50 %) a u nichž nebyla prokázána nádorová aktivační mutace EGFR nebo translokace ALK [9].
Celkem 305 pacientů bylo ve studii KEYNOTE 024 randomizováno (1 : 1) do skupiny léčené pembrolizumabem ve fixní dávce 200 mg každé tři týdny (n = 154) nebo chemoterapií obsahující platinu dle volby zkoušejícího (n = 151). Pacienti s neskvamózním karcinomem zařazení do skupiny léčené chemoterapií mohli dostávat udržovací léčbu pemetrexedem. Léčba pembrolizumabem probíhala maximálně po dobu 24 měsíců nebo do nezvládnutelné toxicity nebo progrese nemoci, přičemž ale terapie mohla pokračovat i po progresi nemoci, pokud byl pacient klinicky stabilní a měl dle úsudku zkoušejícího nadále z léčby klinický přínos. Ze studie byli vyřazeni pacienti s aberacemi nádorového genomu kódujícího EGFR nebo ALK, s autoimunitní chorobou s nutností systémové léčby v průběhu dvou let, se zdravotním stavem vyžadujícím imunosupresi nebo kteří v předchozích 26 měsících byli v oblasti hrudníku ozářeni dávkou větší než 30 Gy. Vyhodnocení stavu nádoru se provádělo každých devět týdnů. Pacienti léčení chemoterapií, u kterých došlo k nezávisle ověřené progresi nemoci, mohli přejít v rámci tzv. crossoveru na léčbu pembrolizumabem [9].
Výchozí charakteristiky pacientů
byly následující: medián věku 65 let (54 % ve věku
65 let nebo vyšším), 61 % muži, 82 % běloši,
15 % Asiaté a stav výkonnosti dle škály ECOG
(Eastern Cooperative Oncology Group) 0 u 35 % a 1
u 65 % pacientů. Celkem 18 % pacientů trpělo
skvamózním karcinomem, 82 % neskvamózním karcinomem;
metastatické stadium M mělo 99 % pacientů a 9 % mělo
metastázy v mozku (tab. 1) [9].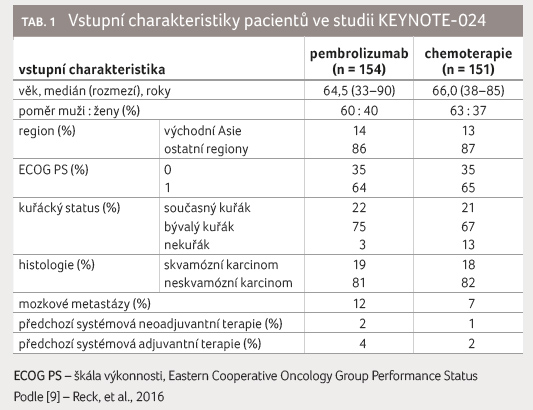
Primárním měřítkem hodnocení účinnosti bylo přežití bez progrese nemoci (progression free survival, PFS) hodnocené pomocí BICR (Blinded Independent Central Review) za využití kritérií RECIST (Response Evaluation Criteria in Solid Tumors) 1.1. Sekundárními měřítky hodnocení účinnosti bylo celkové přežití (overall survival, OS) a objektivní míra odpovědi (objective response rate, ORR) hodnocené pomocí BICR za využití RECIST 1.1 [9].
V době analýzy dat (květen 2016) bylo 74/154 (48 %) pacientů léčeno ve skupině s pembrolizumabem oproti 15/150 (10 %) pacientům ve větvi léčené chemoterapií. Celkem 44 % pacientů, kteří progredovali při chemoterapii, bylo následně léčeno pembrolizumabem v rámci takzvaného crossoveru [9].
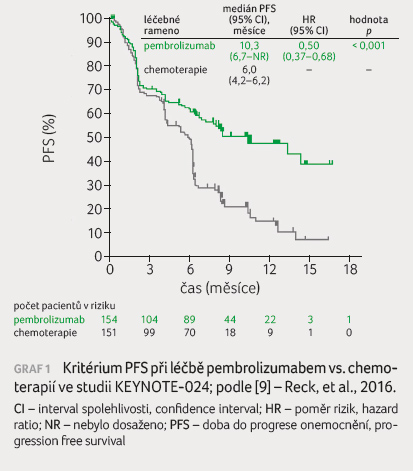
Medián přežití bez progrese
onemocnění byl v rameni s pembrolizumabem 10,3 měsíce
(95% CI [interval spolehlivosti] 6,7‒NR) oproti 6,0 měsíce (95%
CI 4,2‒6,2) v rameni léčeném chemoterapií, což
představuje 50% redukci rizika progrese či smrti při léčbě
pembrolizumabem (HR [poměr rizik] 0,50; p < 0,001)
(graf 1). Vyšší
účinnost pembrolizumabu ve smyslu signifikantního prodloužení
PFS byla zřetelná napříč všemi podskupinami pacientů (graf 2) [9].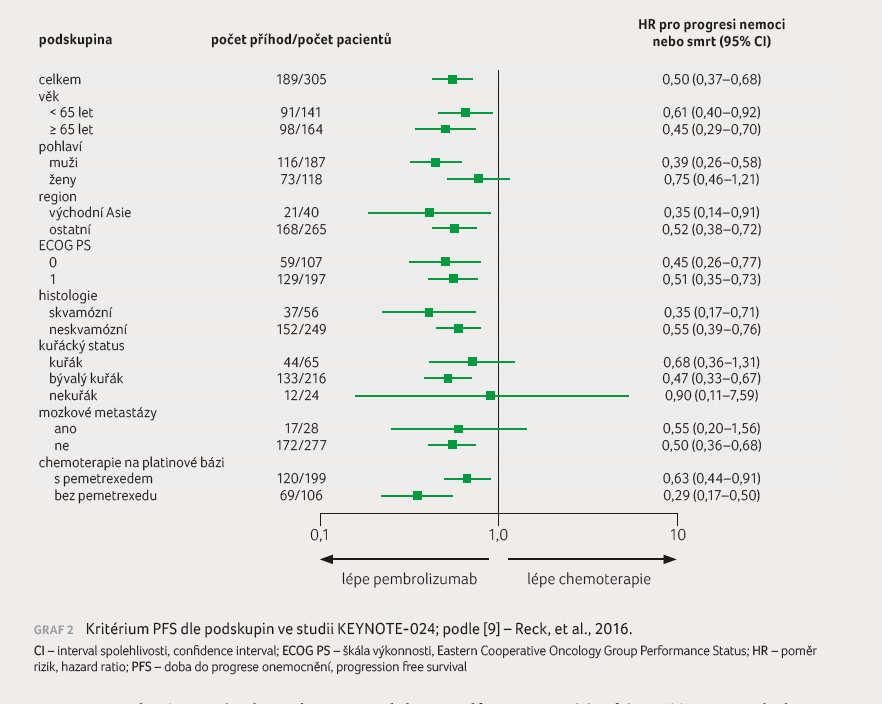
Mediánu OS nebylo dosaženo ani v jedné skupině, nicméně podle analýzy příhod v jednotlivých skupinách byl zjištěn statisticky signifikantní prospěch ve smyslu prodloužení OS při léčbě pembrolizumabem oproti chemoterapii s 40% redukcí rizika úmrtí (HR 0,60; p = 0,005), graf 3 [9].
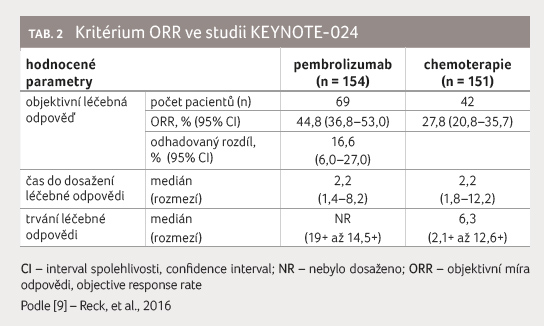
Léčebné odpovědi hodnocené dle
kritérií RECIST bylo dosaženo u 44,8 % (95% CI 36,8‒53,0)
pacientů ve skupině léčené pembrolizumabem oproti 27,8 %
(95% CI 20,8‒35,7) ve skupině s chemoterapií.
U pacientů léčených pembrolizumabem bylo pozorováno šest
kompletních remisí. Léčebné odpovědi bylo dosaženo v mediánu
za 2,2 měsíce v obou studijních větvích. Tak jako
v předchozích klinických studiích byly léčebné odpovědi
na pembrolizumab dlouhotrvající – mediánu délky
trvání terapie nebylo dosaženo (95% CI 1,9+ až 14,5+),
zatímco ve skupině s chemoterapií činil 6,3 měsíce
(95% CI 2,1+ až 12,6+), graf 4, tab. 2
[8].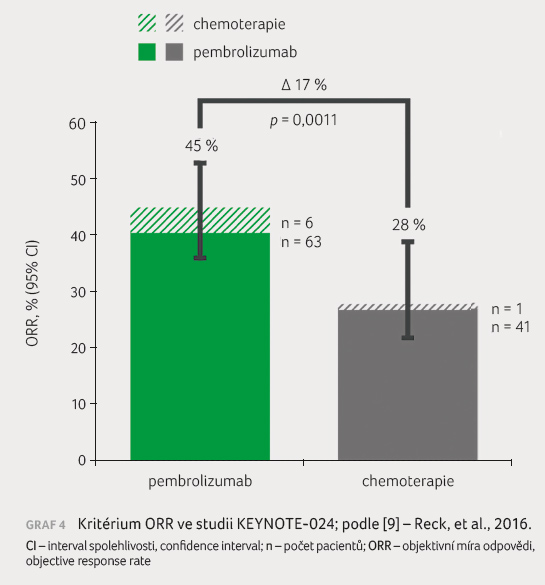
Pro indikaci pembrolizumabu v první linii léčby NSCLC je třeba znát stav nádorové exprese PD L1, a to u všech NSCLC bez ohledu na histologický typ. Vyšetření provádějí všechny referenční laboratoře v České republice reflexně, tedy ihned po stanovení diagnózy. Toto vyšetření je indikováno u všech typů NSCLC. Pro validní výsledek je třeba mít k dispozici dostatečně velký vzorek nádorové tkáně, tes
tování nelze provést z cytologického nátěru, ve zprávě od patologa musí být vždy uvedeno TPS (%) v nádoru, což umožní klinikovi rozhodnutí o indikaci pembrolizumabu [10‒12].
Pembrolizumab se podává intravenózní infuzí po dobu 30 minut každé tři týdny. V první linii léčby NSCLC se pembrolizumab podává ve fixní dávce 200 mg.
Závěr
U pacientů s diagnózou pokročilého NSCLC bez prokázaných řídících mutací stanovujeme rutinně před zahájením systémové léčby expresi PD L1, která rozhoduje o začlenění imunoterapie do léčebného schématu. Monoterapii pembrolizumabem v první linii indikujeme u pacientů s nádory s expresí PD L1 více než 50 %.
Seznam použité literatury
- [1] Howlader N, Noone AM, Krapcho M, et al. (eds.). SEER Cancer Statistics Review 1975–2008. Bethesda (MD): National Cancer Institute, 2010. Dostupné na: http://seer.cancer.gov/csr/1975_2008/
- [2] www.svod.cz
- [3] Skřičková J, Kadlec B, Venclíček O. Nemalobuněčný karcinom plic. Vnitř Lék 2017; 63: 861‒874.
- [4] Koubková L. Imunoterapie karcinomu plic. Postgraduální medicína 2015; 17(Suppl 1): 51‒54.
- [5] Quezada SA, Peggs KS. Exploiting CTLA‑4, PD‑1 and PD‑L1 to reactivate the host immune response against cancer. Br J Cancer 2013; 108: 1560‒1565.
- [6] Ribas A. Tumor immunotherapy directed at PD‑1. N Engl J Med 2012; 366: 2517‒2519.
- [7] Peters S, Stahel R, Kerr KM. PD‑1 blockade in advanced NSCLC: A focus on pembrolizumab. Cancer Treat Rev 2017; 62: 39‒49.
- [8] Herbst RS, Baas P, Kim DW, et al. Pembrolizumab versus docetaxel for previously treated, PD‑L1‑positive, advanced non‑small‑cell lung cancer (KEYNOTE‑010): A randomised controlled trial. Lancet 2016; 387: 1540‒1550.
- [9] Reck M, Rodríguez‑Abreu D, Robinson AG, et al. Pembrolizumab versus chemotherapy for PD‑L1‑positive non–small‑cell lung cancer. N Engl J Med 2016; 375: 1823‒1833.
- [10] Roach C, Zhang N, Corigliano E, et al. Development of a companion diagnostic PD‑L1 immunohistochemistry assay for pembrolizumab therapy in non–small‑cell lung cancer. Appl Immunohistochem Mol Morphol 2016; 24: 392‒397.
- [11] Lopes G, Wu Y‑L, Kudaba I, et al. Pembrolizumab (pembro) versus platinum‑based chemotherapy (chemo) as first‑line therapy for advanced/metastatic NSCLC with a PD‑L1 tumor proportion score (TPS) ≥ 1 %: Open‑label, phase 3 KEYNOTE‑042 study. J Clin Oncol 2018; 36(Suppl; Abstr LBA4).
- [12] Langer CJ, Gadgeel SM, Borghaei H, et al. Carboplatin and pemetrexed with or without pembrolizumab for advanced, non‑squamous non‑small‑cell lung cancer: A randomised, phase 2 cohort of the open‑label KEYNOTE‑021 study. Lancet Oncol 2016; 17: 1497‒1508.