Perindopril arginin: nová sůl inihibitoru ACE perindoprilu a její přínos
Angiotenzin konvertující enzym (ACE) zaujímá důležité postavení v renin-angiotenzinovém systému. Současná generace inhibitorů ACE se používá v léčbě kardiovaskulárních onemocnění včetně vysokého krevního tlaku, infarktu myokardu, u pacientů s diabetem, s onemocněním ledvin, s městnavým srdečním selháním a po mozkové příhodě. Účinnost léčby inhibitorem ACE perindoprilem při hypertenzi, ischemické chorobě srdeční a srdečním selhání je dobře známá. Snaha zvýšit chemickou stabilitu perindoprilu (doposud používán ve formě soli perindopril erbumin) za extrémních klimatických podmínek byla podnětem k vývoji mnohem stabilnější soli. Výsledkem je nová sůl – perindopril arginin – se zdokonalenou lékovou formou, která je bioekvivalentní s perindopril erbuminem a která je v novém balení podstatně stabilnější, což může mít pozitivní vliv na adherenci pacientů k léčbě přípravky obsahujícími perindopril arginin.
Úvod
Jednou z efektivních alternativ antihypertenzní terapie je možnost blokovat renin-angiotenzinový systém [1]. Pokroky v molekulární biologii umožnily identifi-kovat a izolovat angiotenzin konvertující enzym (ACE), který se ukázal jako důležité místo působení samostatné farmakologické skupiny antihypertenziv – inhibitorů angiotenzin konvertujícího enzymu. Metodami racionálního projektování nových léčiv se na základě analogie mezi ACE a hovězí karboxypeptidázou A podařilo vyvinout první vysoce účinný inhibitor ACE kaptopril, který byl zaveden do klinické praxe v roce 1981 [1–4]. Jeho nepříznivé vedlejší účinky (vyrážky, ztráta chuti) byly připisovány thiolové skupině. Později se zjistilo, že ztráta receptorové afinity způsobená nahrazením –SH skupiny za karboxylový zbytek se dá kompenzovat pomocí dodatečné hydrofobní interakce. Vědci z farmaceutické společnosti Merck takto vyvinuli enalaprilát, který má srovnatelnou aktivitu jako kaptopril. Enalaprilát však nebyl vhodný pro perorální použití, a proto se uplatnil jako komerční produkt jeho ethylester (enalapril). Na příkladu vývoje enalaprilátu i dalších inhibitorů ACE se ukázalo, že v počátečním stadiu procesu vývoje nových léčiv se zpravidla nevěnuje dostatečná pozornost výběru optimální formy testované sloučeniny (např. parentní léčivo, prodrug nebo sůl). Potenciální léčivo, jehož biologická aktivita se testuje in vitro a in vivo, je nejčastěji také léčivem, které se dá snadno připravit v čistém stavu. Takoví kandidáti na léči-vo však někdy nemají optimální fyzikálně-chemické a analytické vlastnosti, tedy vhodný farmakokinetický profil, jako je vysoká rozpustnost ve vodě, perorální biologická dostupnost, nízká hygrosko-picita, stabilita a snadná zpracovatelnost. Z těchto důvodů se v oblasti výzkumu a vývoje vhodných lékových forem inhi-bitorů ACE iniciovaly nové výzkumné programy s cílem určit optimální lékovou formu léčiva (sůl, prodrug). Dobrá léková forma by měla zabezpečit také optimální farmakokinetické vlastnosti (absorpce, distribuce, metabolismus, exkrece, toxicita) nově vyvinutého léku [1, 5, 6].
Inhibitory ACE ve formě proléčiva (prodrug)
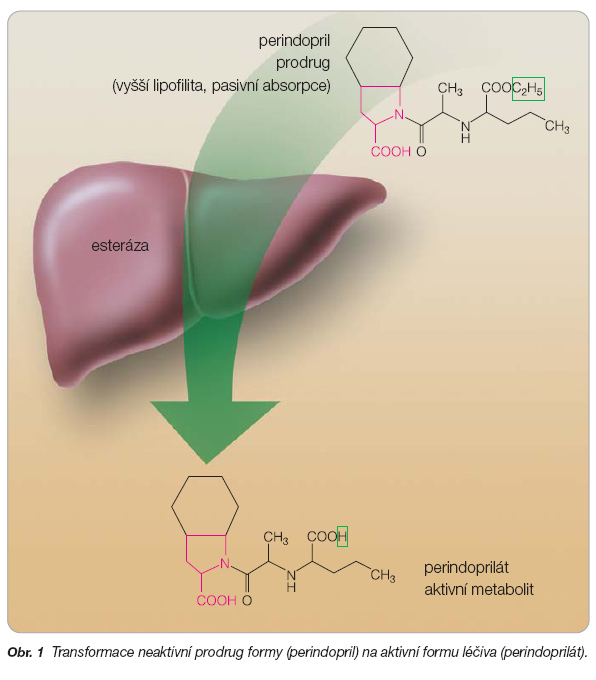
Příkladem vývoje, kdy se koncepce prodrug léčiv hromadně použila k vývoji léků, jsou inhibitory ACE [7]. Vývoj prodrug formy inhibitoru ACE znamená optimalizaci jeho farmakokinetických charakteristik, kdy neaktivní prodrug forma se v organismu transformuje na aktivní formu léčiva (obr. 1).
Výhodou takového postupu je zjevná transparentnost změny fyzikálně-chemických vlastností a farmakologického profilu léčiva [5, 7]. Původní léčivo se v organismu uvolňuje z prodrug formy. Navíc je možné uskutečnit množství nestálých chemických modifikací, a tím připravit prodrug formy s různými fyzikálně-chemickými vlastnostmi. Hlavními překážkami při přípravě lékových forem, které vyplývají z fyzikálně-chemických vlastností léčiv, jsou špatná rozpustnost ve vodě, nízká lipofilita a chemická nestabilita. Hlavními bariérami terapeutického uplatnění léčiva ve farmakokinetické fázi jsou neúplné absorpce při prostupu biologickou membránou, jako je tomu např. u sliznice gastrointestinálního traktu, nízká a proměnlivá biologická dostupnost způsobená masivním metabolismem (first-pass efekt), velmi rychlá absorpce nebo vylučování při požadované delší době účinku a neexistence specificity vůči místu účinku léčiva. Jako tzv. proskupiny se vybírají také substituenty, které jsou relativně chemicky stabilní, ale v místě účinku se enzymaticky štěpí. „Ochranná skupina" musí být stabilní vůči žaludeční kyselině a enzymům, ale po absorpci dostatečně labilní, aby nastalo uvolnění aktivní formy léčiva. Existuje více důvodů pro používání prodrug forem léčiv. Nejčastějším z nich je zlepšení absorpce po perorálním podání. V České republice jsou kromě kaptoprilu a lisinoprilu ostatní terapeuticky používané inhibitory ACE proléčivy, které se musí v játrech deesterifikovat na aktivní metabolity. Jednotlivé inhi-bitory ACE a jejich aktivní metabolity se liší svými fyzikálně-chemickými i farmakokinetickými vlastnostmi [1, 3, 6], což je zřejmě hlavní příčinou jejich rozdílných terapeutických charakteristik. Například Pilotová a kol. [8] v rámci medicíny založené na důkazech zkoumali mortalitu pacientů v pokročilém věku po akutním infarktu myokardu, kteří užívali různé inhibitory ACE. Z této studie vyplynulo, že roční mortalitu po překonání infarktu myokardu nesnižují všechny inhibitory ACE stejnou měrou. Zjistilo se, že jednoletá mortalita byla statisticky významně vyšší u pacientů užívajících enalapril, fosinopril, kaptopril a chinapril než u pacientů, kteří byli léčeni ramiprilem. Nejnižší mortalita se přitom zjis-tila u pacientů užívajících perindopril. Tato retrospektivní studie představovala první přímé srovnání klinické účinnosti inhibitorů ACE a vedla k závěru, že perindopril má mezi inhibitory ACE výjimečné postavení a patří mezi nejúčinnější léčiva v kardiovas-kulární medicíně [9–13]. Je indikován při arteriální hypertenzi, ischemické chorobě srdeční, městnavém srdečním selhání a po mozkové příhodě. Perindopril patří v České republice mezi nejčastěji předepisované inhibitory ACE. Je to prodrug (ethylester) aktivní dikyseliny perindoprilátu (obr. 1). Perindoprilát a aktivní metabolity jiných dikarboxylových inhibitorů ACE se z gastrointestinálního traktu špatně absorbují. Esterifikací se jejich absorpce podstatně zlepší. Vedle farmakokinetických vlastností inhibitorů ACE jsou z hlediska výroby a použití důležité také jejich vhodné lékové formy.
Lékové formy perindoprilu
Už dávno je známo, jaký význam pro vývoj léčiva (soli) má výběr vhodné lékové formy. Proto se postupům, které umožňují rychlý výběr optimální soli nebo jiné chemické formy potenciálního kandidáta na léčivo, věnuje v současnosti mimořádná pozornost. Klinicky používané inhibitory ACE se v lékových formách mohou vyskytovat jako soli s kyselinou maleinovou, kyselinou chlorovodíkovou, dále jako erbumin a sodné soli. Perindopril se v původní lékové formě vyskytuje jako sůl s erbuminem. Je to bílý krystalický prášek, který se dobře rozpouští ve vodě, ethanolu a chloroformu. Léková forma potenciálního léčiva rozpustná ve vodě se upřednostňuje z více příčin. Při preklinickém hodnocení toxicity a biologické dostupnosti léčiva je třeba připravit parenterálně aplikovatelný roztok, který často obsahuje vysokou koncentraci aktivní sloučeniny, a to s cílem vyvolat maximální toxicitu a určit referenční intravenózní farmakokinetický profil pro biologickou dostupnost. Soli rozpustné ve vodě mohou být vhodné také v případech, kdy se budou potenciální léčiva podávat perorálně, protože per-orální biologická dostupnost může být řízena rychlostí rozpouštění se léčiva, která závisí na jeho rozpustnosti ve vodě. Dobrá rozpustnost léčiva ve vodě není jediným požadavkem na vyvíjené potenciální léčivo. Existuje množství dalších kritérií, jež je třeba vzít v úvahu při vývoji optimální formy potenciálního léčiva. Velmi důležitou úlohu má také dostatečná stabilita lékové formy.
Stabilita lékových forem perindoprilu
Tzv. shelf-life chemického léčiva je doba, po kterou se jeho farmakologická aktivita nesníží pod určitou stanovenou hodnotu. Obvykle se za přijatelnou hranici považuje 10 % rozkladu léčiva. Vedle různých faktorů, jako je vzdušná vlhkost a účinek světla, má na reaktivitu léčiva v dané lékové formě vliv hlavně teplota. Teploty skladování vyšší než 30 °C se kvůli nízké stabilitě u dosud používaných inhibitorů ACE nedoporučují. Z tohoto důvodu vyvinula a do klinické praxe zavedla far- maceutická společnost Servier novou lékovou formu – perindopril arginin (obr. 2).
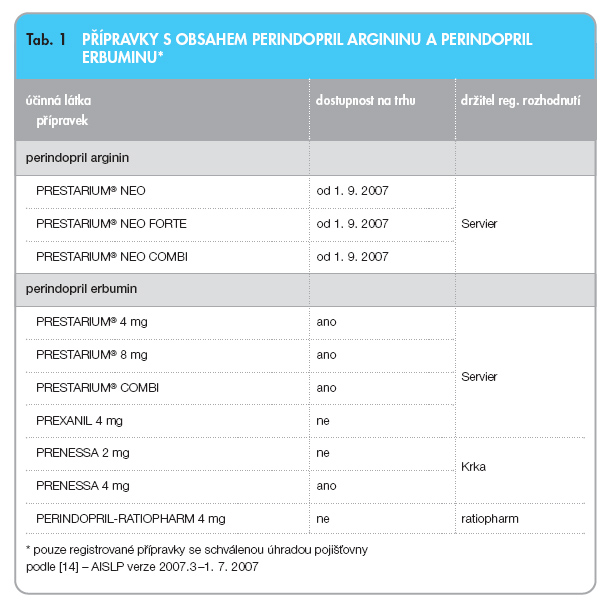
Perindopril se ve starších přípravcích a ve fixních kombinacích nacházel ve formě soli s erbuminem, viz tab. 1 [14].
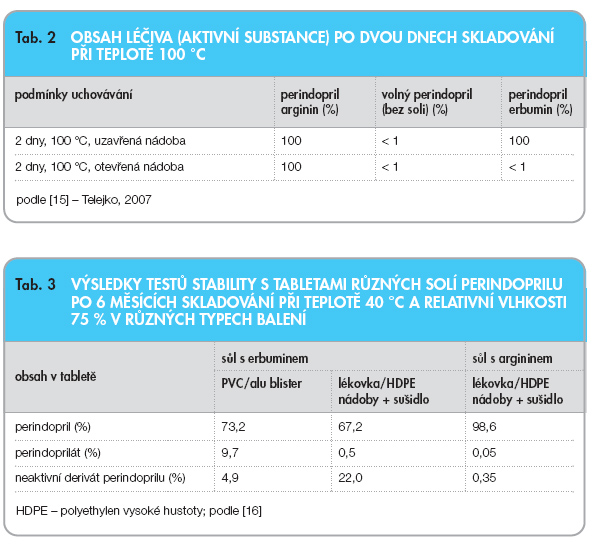
Sůl perindoprilu s erbuminem je výhodná z hlediska výroby čisté substance. V tab. 2 jsou porovnány hodnoty stability pro práškové formy perindoprilu a jeho solí perindopril argininu a perindopril erbuminu, které byly uchovávány po 2 dny při teplotě 100 °C v uzavřených i v otevřených nádobách [15]. Výsledky jednoznačně ukázaly, že argininová sůl perindoprilu je stabilní v uzavřených i v otevřených nádobách. Naproti tomu erbuminová sůl je stabilní jen v uzavřených nádobách.
Neméně výhodným se ukázal také rozdíl v stabilitě lékových forem perindoprilu při uchovávání v různých typech balení. Nahrazení erbuminové soli perindoprilu stabilnější solí perindoprilu s argininem umožnilo totiž připravit univerzální balení tohoto léku, které je vhodné pro všechny klimatické zóny. V tab. 3 je porovnána stabilita tablet obsahujících argini-novou a erbuminovou sůl perindoprilu se stejným složením lékové formy. Obsah jednotlivých degradačních produktů se stanovil po 6 měsících uchovávání při 40 °C a 75% relativní vlhkosti v různých typech balení. Tyto a další studie stability různých solí perindoprilu [15, 16] ukázaly, že nahrazení erbuminu argininem v lékových formách perindoprilu má následující výhody:
– ‑používání jednotného průmyslově dostupného balení pro všechny klimatické zóny, které chrání tablety před vlhkostí a účinkem zvýšené teploty;
– ‑zvýšení tzv. shelf-life, tj. stability léku pro všechny klimatické zóny (I–IV), což umožní prodloužení exspirační doby ze dvou na tři roky;
– ‑vysoká spolehlivost, pacient má zajištěnou stejnou dávku léčivé látky ve všech klimatických pásmech od začátku do konce exspirační doby.
Přípravky obsahující perindopril arginin i perindopril erbumin jsou uvedeny v tab. 1 [14].
Závěr
Vzhledem k uvedeným výhodám nové soli perindoprilu argininu se dá očekávat, že pacienti budou mít větší přínos z nových léčivých přípravků se zdokonalenou lékovou formou obsahující tuto sůl (perindopril arginin) v nové tabletě potažené filmem a v novém balení, což může mít rovněž pozitivní vliv na jejich adherenci k léčebnému režimu.
Seznam použité literatury
- [1] Souček M, Kára T, et al. Klinická patofyziologie hypertenze. Praha, Grada Publishing 2002.
- [2] Timmermans PBMWM, Smith RD. Antihypertensive Agents, In M. E. Wolff (Ed.) Burger´s Medicinal Chemistry and Drug Discovery, Volume I: Principles and Practice, 297–300, J. Wiley and Sons, New York 1996.
- [3] Opie LH. Angiotensin Converting Enzyme Inhibitors, 2nd Edition. Wiley-Liss, New York 1994.
- [4] Remko M. Angiotenzín konvertujúci enzým, nový cieľ štruktúrne riadeného projektovania liečiv. Farm Obzor 2006; 75: 107–112.
- [5] Remko M. Základy medicínskej a farmaceutickej chémie. SAP Bratislava 2005.
- [6] Remko M. Acidity, Lipophilicity, Solubility, Absorption, and Polar Surface Area of Some ACE Inhibitors. Chem Papers 2007; 61: 133–141.
- [7] Stella V, Borchardt R, Hageman M, et al., Eds., Prodrugs, Springer Heidelberg, 2007.
- [8] Pilote L, Abrahamowicz M, Rodrigues E, et al. Mortality Rates in Elderly Patients Who Take Different Angiotensin-Converting Enzyme Inhibitors after Acute Myocardial Infarction: A Class Effect? Ann Intern Med 2004; 141: 102–112.
- [9] PROGRESS Collaborative Group. Randomised trial of a perindopril-based blood-pressure-lowering regimen among 6,105 individuals with previous stroke or transient ischaemic attack. Lancet 2001; 358: 1033–1041.
- [10] Fox KM. Efficacy of perindopril in reduction of cardiovascular events among patients with stable coronary artery disease: randomised, double-blind, placebo-controlled, multicentre trial (the EUROPA study). Lancet 2003; 362: 782–788.
- [11] Ferrari R. Effects of angiotensin-converting enzyme inhibition with perindopril on left ventricular remodeling and clinical outcome: results of the randomized Perindopril and Remodeling in Elderly with Acute Myocardial Infarction (PREAMI) Study. Arch Intern Med 2006; 166: 659–666.
- [12] Dahlöf B, Sever PS, Poulter NR, et al. Preven-tion of cardiovascular events with an antihypertensive regimen of amlodipine adding perindopril as required versus atenolol adding bendroflumethiazide as required, in the Anglo-Scandinavian Cardiac Outcomes Trial-Blood Pressure Lowering Arm (ASCOT-BPLA): a multicentre randomised controlled trial. Lancet 2005; 366: 895–906.
- [13] Cleland JG, Tendera M, Adamus J, et al. The perindopril in elderly people with chronic heart failure (PEP-CHF) study. Eur Heart J 2006; 27: 2338– 2345.
- [14] AISLP verze 2007.3–1. 7. 2007.
- [15] Telejko E, Perindopril arginine: benefits of a new salt of the ACE inhibitor perindopril. Curr Med Res Opin 2007; 23: 953–960.
- [16] Data on file.