Plicní postižení u systémové sklerodermie – nová indikace antifibrotické léčby nintedanibem
Souhrn:
Soukup T, Jansová A. Plicní postižení u systémové sklerodermie ‒ nová indikace antifibrotické léčby nintedanibem. Remedia 2020; 30: 435–439.
Systémová sklerodermie (SSc) je progresivní orgány poškozující onemocnění způsobené autoimunitním zánětem, vaskulopatií a fibrózou. Intersticiální plicní onemocnění (ILD) je zjištěno u většiny pacientů se SSc a je hlavní příčinou úmrtí na SSc. Klinické projevy a závažnost ILD u pacientů se liší. Plicní funkce obvykle klesají během prvních 3–4 let po nástupu onemocnění. Včasná detekce ILD poskytuje příležitost k terapeutickému zásahu, který by mohl zlepšit prognózu pacienta. Počítačová tomografie s vysokým rozlišením je nejúčinnější diagnostickou metodou ILD u pacientů se SSc; umožňuje detekci i mírných změn v plicní tkáni a hraje důležitou roli při sledování progrese onemocnění. Cyklofosfamid a mykofenolát mofetil jsou nejčastěji indikovanou léčbou pro intersticiální plicní onemocnění přidružené k systémové sklerodermii (SSc‑ILD). Americký Úřad pro kontrolu potravin a léčiv (FDA) a Evropská léková agentura (EMA) nedávno schválily k léčbě SSc‑ILD novou látku s antifibrotickým účinkem – nintedanib. Lék je indikován ke zpomalení rychlosti poklesu plicních funkcí u dospělých se SSc‑ILD.
Summary:
Soukup T, Jansova A. Lung damage in systemic sclerosis – new indication of antifibrotic treatment with nintedanib. Remedia 2020; 30: 435–439.
Systemic sclerosis (SSc) is a progressive organ‑damaging disease caused by an autoimmune inflammation, vasculopathy and fibrosis. Interstitial lung disease (ILD) is diagnosed in most patients with SSc and is the main cause of death in SSc. Clinical presentation and severity of ILD varies in patients. Lung functions usually decrease during the first 3‒4 years after disease onset. Early detection of ILD offers an opportunity to the therapeutic intervention that could improve patient prognosis. Computer tomography with high resolution is the most efficacious diagnostic method of ILD in patients with SSc; it enables the detection of even tiny changes in lung tissue and plays an important role in disease progression monitoring. Cyclophosphamide and mycophenolate mofetil are the most frequently indicated treatment of ILD adjunct to SSc (SSc‑ILD). American Food and Drug Administration agency and European Medicines Agency (EMA) have recently approved new drug with antifibrotic effect for the treatment of SSc‑ILD – nintedanib. The medicinal product is indicated in lung function decrease deceleration in adults with SSc‑ILD.
Key words: systemic sclerosis, interstitial lung disease, antifibrotic treatment, nintedanib
Úvod k systémové sklerodermii
Systémová sklerodermie (systemic sclerosis, SSc) je chronické autoimunitní onemocnění, které postihuje cévy, útroby a kůži. Nejčastěji se SSc vyvíjí ve věku mezi 30 a 50 lety, ale lze ji diagnostikovat prakticky v jakémkoliv věku. Častěji se vyskytuje u žen, naopak u mužů má horší prognózu. Pokud jde o postižení kůže, rozlišujeme dvě hlavní formy ‒ difuzní a kožně limitovanou. Dělení na tyto formy má klinický význam v rozdílné manifestaci postižení orgánů a v prognóze. Difuzní forma SSc je spojena s častějším výskytem plicního postižení a vyskytuje se zde častěji progredující forma postižení plic. Etiopatogeneze SSc je stále nejasná. Zjednodušená patogenetická představa předpokládá, že mikrovaskulární postižení je následováno imunologickou aktivací, následně depozicí kolagenu a extracelulární matrix, a nakonec fibrózou. Zánět a posléze převažující fibróza jsou patognomické pro postižení plic.
Epidemiologie plicního postižení
Plicní postižení asociované se systémovou sklerodermií (SSc ILD) je nejčastější příčinou mortality u SSc. Objevuje se ve formě intersticiálního plicního postižení (interstitial lung disease, ILD). Ve 12 % případů se objevuje vaskulární postižení plicní arterie způsobující plicní arteriální hypertenzi (PAH). Onemocnění SSc ILD spojené s PAH představuje až 60 % úmrtnosti v souvislosti se SSc [1,2].
Největší riziko rozvoje ILD je
v prvních pěti letech onemocnění. Někdy je ILD prvním
diagnostikovaným projevem SSc. Nejběžnější příznaky
představují progresivní dušnost a neproduktivní kašel.
Počáteční klinický obraz SSc ILD se však u pacientů
liší, což může diagnózu komplikovat. Pacienti s mírným
ILD mohou být v časných stadiích onemocnění
asymptomatičtí.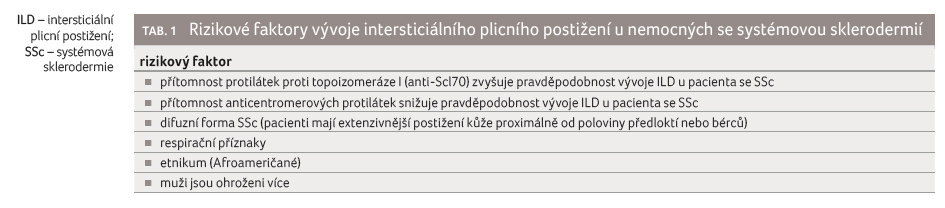
Zhruba 40–75 % pacientů se SSc má snížené plicní funkce [3,4]. Onemocnění SSc ILD má tendenci vyskytovat se se zvýšenou závažností a/nebo zvýšeným rizikem progrese u pacientů s protilátkami Scl70 (anti topoizomeráza I) [2,5], u mužského pohlaví [6] a u afroamerického etnika [7]. U nemocných se sklerodermickým i nesklerodermickým srdečním postižením je vyšší pravděpodobnost zhoršení plicních funkcí [7]. Výraznější postižení kůže sklerózou je průvodním jevem snížené plicní funkce [7,8]. Tento fakt není způsoben pouhým sevřením hrudníku tuhými tkáněmi. Vedle toho rozsah kožního postižení se jeví jako nezávislý prediktor úmrtnosti [9], tabulka 1.
Diagnostika plicního postižení
Diagnostika se provádí pomocí
zobrazovacích metod a testů plicních funkcí. Difuzní
kapacita plic pro oxid uhelnatý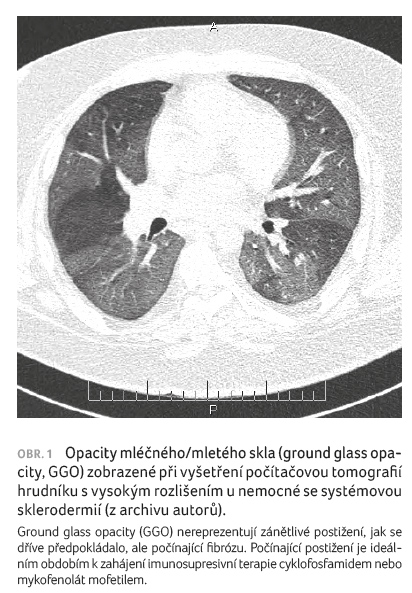 (DLCO) je prediktorem úmrtnosti
u SSc ILD včetně časné SSc ILD. Onemocnění
SSc ILD je nejčastěji provázeno histologickým obrazem
neobvyklé intersticiální pneumonie (nonspecific interstitial
pneumonia, NSIP), zatímco obvyklá intersticiální pneumonie (usual
interstitial pneumonia, UIP) a jiné histologické vzorce jsou
pozorovány méně často [10‒12].
(DLCO) je prediktorem úmrtnosti
u SSc ILD včetně časné SSc ILD. Onemocnění
SSc ILD je nejčastěji provázeno histologickým obrazem
neobvyklé intersticiální pneumonie (nonspecific interstitial
pneumonia, NSIP), zatímco obvyklá intersticiální pneumonie (usual
interstitial pneumonia, UIP) a jiné histologické vzorce jsou
pozorovány méně často [10‒12].
Histologické vyšetření v rozlišení postižení plic nemá velký přínos, ale histologické obrazy NSIP a UIP dobře odpovídají obrazům při počítačové tomografii.
Počítačová tomografie s vysokým
rozlišením (high resolution computed tomography, HRCT) je
nejúčinnější metodou identifikace ILD u pacientů se SSc
(obr. 1‒3). Umožňuje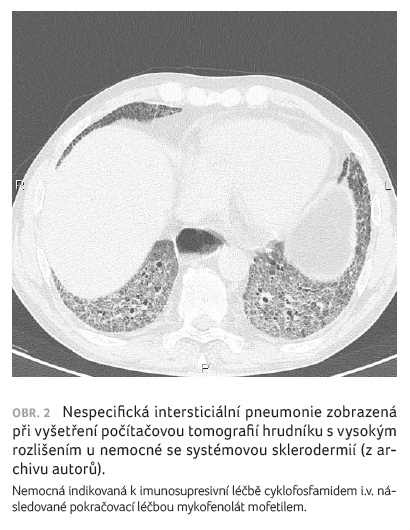 detekci i mírných změn plic a hraje důležitou roli při
sledování progrese onemocnění. Rozsah nemoci na výchozím
HRCT nezávisle předpovídá progresi ILD a mortalitu [13].
Pokles usilovné vitální kapacity (forced vital capacity, FVC),
DLCO a vyšší věk jsou rovněž nezávislými prediktory
úmrtnosti [9].
detekci i mírných změn plic a hraje důležitou roli při
sledování progrese onemocnění. Rozsah nemoci na výchozím
HRCT nezávisle předpovídá progresi ILD a mortalitu [13].
Pokles usilovné vitální kapacity (forced vital capacity, FVC),
DLCO a vyšší věk jsou rovněž nezávislými prediktory
úmrtnosti [9].
Prostřednictvím správného přístupu ke screeningu a spolupráce revmatologa, pneumologa a radiologa mohou být pacienti diagnostikováni včas a účinněji. Doporučuje se opakované každoroční provádění plicních funkčních testů a v úvodu nemoci či při zhoršení klinického nálezu nebo plicních funkcí vyšetření HRCT. To pomůže optimalizovat péči a povede ke zlepšení klinických výsledků.
Léčba plicního postižení
Pro terapii SSc není k dispozici
univerzální lék. Jednotlivé manifestace jsou léčeny odděleně
podle postižení určitého orgánu. Vaskulární projevy jsou
léčeny vazodilatačními léky, zánětlivé projevy protizánětlivě
a imunosupresivy. Fibrotické postižení tkání a orgánů
doposud nemělo účinné léčivo. Vzhledem ke složitosti
a heterogenní povaze SSc ILD by léčebné přístupy měly
být přizpůsobeny jednotlivci, s přihlédnutím ke stadiu
onemocnění a ke komplikacím specifických orgánů [14].
orgánu. Vaskulární projevy jsou
léčeny vazodilatačními léky, zánětlivé projevy protizánětlivě
a imunosupresivy. Fibrotické postižení tkání a orgánů
doposud nemělo účinné léčivo. Vzhledem ke složitosti
a heterogenní povaze SSc ILD by léčebné přístupy měly
být přizpůsobeny jednotlivci, s přihlédnutím ke stadiu
onemocnění a ke komplikacím specifických orgánů [14].
Zatímco včasná léčba SSc ILD má velký význam pro snížení míry poškození plic a úmrtnosti [15], ne každý pacient se SSc ILD vyžaduje léčbu. Ta je často vyhrazena pro nemocné s určitým objemem reverzibilně postižené plicní tkáně (obvyklá hranice je 20‒25 % plicního parenchymu), s progresivním onemocněním v čase, klinickým poškozením souvisejícím s ILD nebo pro nemocné s vysokým rizikem progrese ILD (tab. 2).
Přes zlepšení celkové míry přežití
u pacientů se SSc jsou současné terapeutické prostředky
schopny pouze zpomalit progresi plicního postižení [16‒18].
Klinická hodnocení prokázala, že použití imunosupresivní
terapie je jistou šancí ke zlepšení funkčních parametrů
plic u pacientů se SSc ILD, avšak u některých
nemocných ILD progreduje navzdory této léčbě [19]. Podávání
léčby na začátku SSc ILD může vést ke zlepšení
terapeutických výsledků [20]. V jedné studii, bez ohledu
na použité léčivo, bylo časné zahájení léčby faktorem,
který ovlivňoval výrazné zlepšení plicních funkcí [15].
Cyklofosfamid a mykofenolát mofetil jsou v současnosti
nejčastěji indikovanou léčbou pro SSc ILD, další
terapeutickou možnost představují biologické léky. Klinická
hodnocení s tocilizumabem prokázala zpomalení progrese ILD.
Ještě konzistentnější jsou údaje o rituximabu ve vztahu
ke zlepšení fibrózy plic, zejména v časných stadiích
onemocnění.
funkcí [15].
Cyklofosfamid a mykofenolát mofetil jsou v současnosti
nejčastěji indikovanou léčbou pro SSc ILD, další
terapeutickou možnost představují biologické léky. Klinická
hodnocení s tocilizumabem prokázala zpomalení progrese ILD.
Ještě konzistentnější jsou údaje o rituximabu ve vztahu
ke zlepšení fibrózy plic, zejména v časných stadiích
onemocnění.
Nintedanib
Nintedanib je inhibitor tyrozinkinázy, který působí na signální dráhy receptorového růstového faktoru destiček, růstového faktoru fibroblastů a vaskulárního endoteliálního růstového faktoru. Výsledkem je, že inhibuje cytokinem indukovanou aktivaci fibroblastů a na myších modelech SSc prokázal silné antifibrotické účinky [21]. Nintedanib je již nějakou dobu úspěšně používán k léčbě dospělých s idiopatickou plicní fibrózou (IPF).
Nedávno se nintedanib stal historicky prvním lékem schváleným americkým Úřadem pro kontrolu potravin a léčiv (Food and Drug Administration, FDA) v indikaci SSc ILD. Nintendanib je indikován ke zpomalení rychlosti poklesu plicní funkce u dospělých pacientů se SSc ILD [22] na základě výsledků randomizované, dvojitě zaslepené, placebem kontrolované studie fáze III hodnotící bezpečnost a účinnost nintedanibu u SSc (SENSCIS; NCT02597933) [23]. Do studie SENSCIS byla zahrnuta široká populace 580 pacientů se SSc ILD. Na začátku studie, před zahájením studijní léčby, dostávali pacienti po dobu šesti měsíců mykofenolát mofetil. Zařazení nemocní trpěli různě těžkými poruchami plicních funkcí. Při analýze primárního cílového ukazatele studie byl zjištěn významný rozdíl ve změně roční míry poklesu FVC mezi nintedanibem a placebem (41,0 ml/rok; 95% interval spolehlivosti [CI] 2,9–79,0; p = 0,04) v průběhu jednoho roku. Exploratorní analýza údajů od randomizace až do 100 týdnů (maximální délka léčby v klinickém hodnocení SENSCIS) naznačila, že účinek léku na zpomalení progrese SSc ILD přetrval 52 týdnů po ukončení léčby.
Rozdíly ve změně oproti výchozímu stavu v modifikovaném Rodnanově kožním skóre a celkovém skóre v dotazníku zaměřeném na dýchání nebyly významné. Nežádoucí účinky byly podobné mezi skupinami užívajícími nintedanib a placebo. V souladu se známým bezpečnostním profilem nintedanibu u léčby IPF byl průjem nejčastějším nežádoucím účinkem. Mezi pacienty léčenými nintedanibem byly hlášeny průjmové příhody, které byly maximálně mírné nebo střední závažnosti u 49,5 %, resp. 45 % osob [23]. Nyní probíhá otevřená prodloužená studie pro posouzení trvalé účinnosti nintedanibu a rovněž pro posouzení jeho dlouhodobé bezpečnosti (NCT03313180). Aktuálně je v České republice možná preskripce, avšak o úhradu léku je nutné žádat u zdravotní pojišťovny pouze s odvoláním na §16.
Evropský konsenzus léčby plicního
postižení u sklerodermie
V lednu roku 2020 byl publikován Evropský konsenzus k managementu a léčbě pacientů se SSc ILD. Tým 27 evropských pneumologů, revmatologů a internistů s odbornými znalostmi v oblasti SSc ILD se zúčastnil tříkolového jednání. Po něm následovala dvě doplňující kola analýzy za použití delfské metody s cílem vytvořit konsenzus a definovat algoritmus postupu. Byla postulována konsenzuální vyjádření založená na vědeckých důkazech. Konsenzuální dohody bylo dosaženo a bylo formulováno šest postulátů. Zajímavostí je, že prohlášení týkající se tocilizumabu konsenzu nedosáhlo. V případě, že mykofenolát mofetil a cyklofosfamid nejsou vhodné k léčbě, panovala shoda v tom, že rituximab může být alternativou terapie [24].
Na závěr se konsorcium shodlo na tom, že nintedanib (jako monoterapie nebo v kombinaci s mykofenolát mofetilem) může být účinnou alternativou pro zahájení nebo eskalaci léčby v závislosti na dostupnosti v jednotlivých zemích. Přístup k možnosti léčby nintedanibem bude jistě v jednotlivých zemích různou měrou regulován. Přesto bylo vydáno také usnesení, že mykofenolát mofetil nebo cyklofosfamid, či oba léky, jsou odborníky považovány za alternativu terapie v případech, kdy nintedanib není pro pacienty vhodnou volbou [24]. To ukazuje na to, že konsorcium nepovažuje žádné z léků (cyklofosfamid, mykofenolát mofetil, nintedanib) za medicínsky nadřazené.
Závěr
Přes dobrý příslib léčby nintendanibem u nemocných s progredujícím plicním fibrotickým postižením přetrvává potřeba vývoje další účinné a dobře tolerované terapie modifikující onemocnění. Probíhající studie hodnotí další antifibrotika a nové látky, včetně biologických léků. Je zřejmé, že včasná detekce plicního postižení spojená s objevením a zavedením nových léčebných možností přispěje ke zlepšení terapeutických výsledků u pacientů se SSc ILD.
Seznam použité literatury
- [1] Steen VD, Medsger TA. Changes in causes of death in systemic sclerosis, 1972–2002. Ann Rheum Dis 2007; 66: 940–944.
- [2] Tyndall AJ, Bannert B, Vonk M, et al. Causes and risk factors for death in systemic sclerosis: a study from the EULAR Scleroderma Trials and Research (EUSTAR) database. Ann Rheum Dis 2010; 69: 1809–1815.
- [3] Steen VD, Conte C, Owens GR, Medsger TA Jr. Severe restrictive lung disease in systemic sclerosis. Arthritis Rheum 1994; 37: 1283–1289.
- [4] Steen VD, Owens GR, Fino GJ, et al. Pulmonary involvement in systemic sclerosis (scleroderma). Arthritis Rheum 1985; 28: 759–767.
- [5] Walker UA, Tyndall A, Czirjak L, et al. Clinical risk assessment of organ manifestations in systemic sclerosis: a report from the EULAR scleroderma trials and research group database. Ann Rheum Dis 2007; 66: 754–763.
- [6] Peoples C, Medsger TA Jr., Lucas M, et al. Gender differences in systemic sclerosis: relationship to clinical features, serologic status and outcomes. J Scleroderma Relat Disord 2016; 1: 177–240.
- [7] McNearney TA, Reveille JD, Fischbach M, et al. Pulmonary involvement in systemic sclerosis: associations with genetic, serologic, sociodemographic, and behavioral factors. Arthritis Rheum 2007; 57: 318–326.
- [8] Jaeger VK, Wirz EG, Allanore Y, et al. Incidences and risk factors of organ manifestations in the early course of systemic sclerosis: a longitudinal EUSTAR study. PLoS One 2016; 11: e0163894.
- [9] Volkmann ER, Tashkin DP, Sim M, et al. Short‑term progression of interstitial lung disease in systemic sclerosis predicts long‑term survival in two independent clinical trial cohorts. Ann Rheum Dis 2019; 78: 122–130.
- [10] Bouros D, Wells AU, Nicholson AG, et al. Histopathologic subsets of fibrosing alveolitis in patients with systemic sclerosis and their relationship to outcome. Am J Respir Crit Care Med 2002; 165: 1581–1586.
- [11] Savarino E, Bazzica M, Zentilin P, et al. Gastroesophageal reflux and pulmonary fibrosis in scleroderma: a study using pH‑impedance monitoring. Am J Respir Crit Care Med 2009; 179: 408–413.
- [12] Sharp C, Dodds N, Mayers L, et al. The role of biologics in treatment of connective tissue disease‑associated interstitial lung disease. QJM 2015; 108: 683–688.
- [13] WinstoneTA, Assayag D, Wilcox PG, et al. Predictors of mortality and progression in scleroderma‑associated interstitial lung disease: a systematic review. Chest 2014; 146: 422–436.
- [14] Cossu M, Beretta L, Mosterman P, et al. Unmet needs in systemic sclerosis understanding and treatment: the knowledge gaps from a scientist’s, clinician’s, and patient’s perspective. Clin Rev Allergy Immunol 2018; 55: 312–331.
- [15] Steen VD, Lanz JK Jr., Conte C, et al. Therapy for severe interstitial lung disease in systemic sclerosis. A retrospective study. Arthritis Rheum 1994; 37: 1290–1296.
- [16] Glasser SW, Hagood JS, Wong S, et al. Mechanisms of lung fibrosis resolution. Am J Pathol 2016; 186: 1066–1077.
- [17] Poudel DR, Derk CT. Mortality and survival in systemic sclerosis: a review of recent literature. Curr Opin Rheumatol 2018; 30: 588–593.
- [18] Tashkin DP, Roth MD, Clements PJ, et al. Mycophenolate mofetil versus oral cyclophosphamide in scleroderma‑related interstitial lung disease (SLS II): a randomised controlled, double‑blind, parallel group trial. Lancet Respir Med 2016; 4: 708–719.
- [19] Volkmann ER, Tashkin DP. Treatment of systemic sclerosis‑related interstitial lung disease: a review of existing and emerging therapies. Ann Am Thorac Soc 2016; 13: 2045–2056.
- [20] Schoenfeld SR, Castelino FV. Evaluation and management approaches for scleroderma lung disease. Ther Adv Respir Dis 2017; 11: 327–340.
- [21] Huang J, Beyer C, Palumbo‑Zerr K, et al. Nintedanib inhibits fibroblast activation and ameliorates fibrosis in preclinical models of systemic sclerosis. Ann Rheum Dis 2016; 75: 883–890.
- [22] Boehringher Ingelheim. Ofev (nintedanib) US Prescribing Information. September 2019. Dostupné na: https://www.accessdata.fda.gov/drugsatfda_docs/label/2019/205832s012lbl.pdf
- [23] Distler O, Highland KB, Gahlemann M, et al. Nintedanib for systemic sclerosis‑associated interstitial lung disease. N Engl J Med 2019; 380: 2518–2528.
- [24] Hoffmann‑Vold AM, Maher TM, Philpot EE, et al. The identification and management of interstitial lung disease in systemic sclerosis: evidence‑based European consensus statements. Lancet 2020; 2: e71‒e83.