Postavení docetaxelu v terapii karcinomu prostaty
Incidence zhoubných nádorů prostaty v posledních 30 letech stále stoupá. V roce 2003 dosáhla 75,3 nově nemocných na 100 000 a zařadila karcinom prostaty na třetí místo za bronchogenní karcinom a karcinom kolorekta ve výskytu malignit v mužské populaci. Aktivní přístup k vyhledávání onemocnění vede k většímu záchytu karcinomu v časnějších stádiích. Přesto nemalá část mužů přichází s generalizací onemocnění v době diagnózy. Přibližně u třetiny mužů onemocnění progreduje i přes časnou diagnózu a radikálně provedenou léčbu a část z nich přirozeným průběhem onemocnění dospěje ke generalizaci. Stále více se tak zaměřujeme na rizikové faktory karcinomu prostaty při radikální léčbě a na možnosti snížení rizika progrese onemocnění. Zařazení taxanů do armamentaria léčby karcinomu prostaty rozšiřuje možnosti léčebného ovlivnění progrese tohoto nádorového onemocnění.
Karcinom prostaty
Léčebné ovlivnění v posledních desetiletích zvolna přesouvá karcinom prostaty mezi onemocnění chronická. Významným dílem se na situaci podílí i biologické chování samotného nádoru s pomalým růstem a dlouhým trváním odpovědi vůči léčbě.
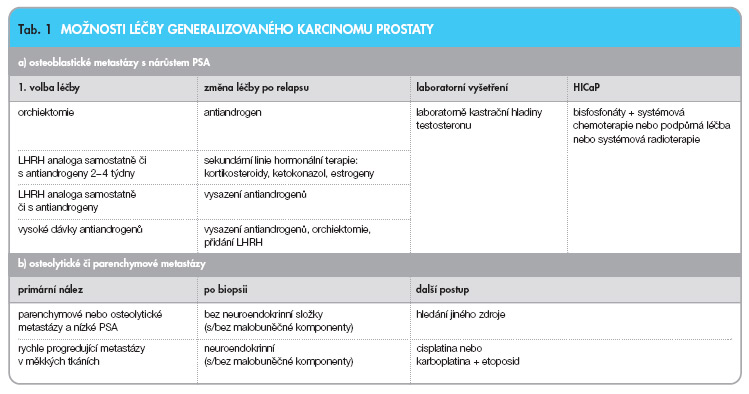
Léčba zhoubného onemocnění prostaty závisí především na stadiu onemocnění. Karcinom prostaty ohraničený na žlázu (T1-2 N0 M0) hodnotíme jako lokalizovaný karcinom. Předpokládaná doba přežití, histopatologický nález a preference pacienta jsou vodítky při stanovení léčebného postupu u lokalizovaného karcinomu prostaty. U nemocných s dobře diferencovaným karcinomem a nízkým Gleasonovým skóre, a to i u mladých jedinců, můžeme zvolit tzv. watchful waiting, tedy přísné sledování, a léčbu odložit až na období, kdy se zhorší parametry nádorového onemocnění. Stejný postup je možné zvolit u mužů vyššího věku. Nepochybně část těchto nádorů představují incidentální karcinomy, které nemocného neohrozí na životě. Mužům, u nichž rozsah a stav nádorového onemocnění vyžaduje aktivní přístup, navrhujeme radikální řešení, tedy radikální prostatektomii nebo radiální radioterapii. Lokálně pokročilý karcinom, tedy nádor, který přestoupil pouzdro prostaty, již není možné považovat za kurabilní. U části nemocných lokálně pokročilým karcinomem T3a předpokládáme benefit z radikální chirurgické léčby, ta však jen předchází nezbytnou adjuvantní léčbu, ať už radiační, farmakologickou nebo kombinovanou. U ostatních nemocných s pokročilým karcinomem prostaty volíme po dohodě s pacientem opět mezi přísným sledováním, radioterapií či hormonální léčbou, event. jejich kombinací. Generalizované formy onemocnění (Tx Nx M1) léčíme primárně hormonální supresí či ablací. V době diagnózy je přibližně 80 % karcinomů prostaty hormonálně dependentních. Doba trvání odpovědi je rozdílná. U generalizovaného onemocnění dosahuje medián trvání odpovědi vůči hormonální léčbě 12 měsíců. Pokud přestane karcinom prostaty reagovat na hormonální monoterapii, můžeme léčbu rozšířit na tzv. maximální androgenní blokádu (MAB), která prolonguje dobu odpovědi průměrně o dalších šest měsíců. Možnosti změny terapie ukazuje tab. 1.
Progreduje-li karcinom prostaty při kastračních hladinách testosteronu (1,73 nmol/l, resp. nověji 0,7 nmol/l), přechází onemocnění do hormonálně independentní formy. Moderní farmakoterapie, resp. cytotoxická léčba a event. aplikace bisfosfonátů, umožňuje pacientům s hormonálně independentním karcinomem (HICaP) prodloužit přežití a zajistit uspokojivou kvalitu života, úmrtí však zabránit nedokáže.
Docetaxel
Docetaxel blokuje na buněčné úrovni přechod z G2 do mitotické fáze buněčného cyklu. Vede ke stabilizaci mikrotubulů dělicího vřeténka a brání depolymerizaci, tak narušuje nitrobuněčnou mikrotubulární síť nezbytnou k buněčnému dělení [4]. Docetaxel tlumí expresi onkogenu bcl2, který kóduje membránové proteiny inhibující apoptózu. Tím pak indukuje buněčnou smrt.
Docetaxel a karcinom prostaty
Z historických literárních pramenů získáme data, která dokládají malou úspěšnost a špatnou prognózu pacientů léčených chemoterapií. Jednotlivé cytotoxické přípravky nedosahovaly odpovědi vyšší než 30 %. Jednou z možných příčin neúspěchu chemoterapie bylo pozdní podávání léčby pacientům s výraznými subjektivními obtížemi a velmi vysokými hladinami PSA. Špatný performance status znemožňoval adekvátní podání cytotoxické léčby. Zlomem v přístupu k chemoterapii karcinomu prostaty se stala kombinace mitoxantronu s kortikosteroidy [3, 6, 8, 15, 17] s účinným ovlivněním algického syndromu při kostním postižení (tab. 2).
Vliv na přežití však nebyl významný.
Současný výzkum se orientuje na proteiny regulující apoptózu a na látky, které apoptózu ovlivňují. Estramustin (inhibice mikrotubulů) a taxany (fosforylace bcl-2) mají vysokou aktivitu u hormonálně independentního karcinomu prostaty.
Léčba kombinací EMP (estramustin fosfát) s docetaxelem dosahuje vyšší odpovědi než docetaxel v monoterapii. Současně však s kombinovanou léčbou vzrůstá množství nežádoucích účinků jako nauzea, zvracení, metabolický rozvrat a tromboembolické komplikace, které nelze ovlivnit antikoagulační profylaxí. Kombinovaná léčba vyžaduje redukci dávky EMP.
Srovnání léčebných režimů podávajících mitoxantron s prednisonem a docetaxel s EMP u mužů s HICaP v rámci trialu SWOG 99–16 zhodnotil na ASCO 2004 Petrylac v souboru 770 pacientů [14, 15]. Studie porovnávala podávání docetaxelu 60 mg/m2 každých 21 dní s estramustinem 1.–5. den v dávce 280 mg 3x denně s kombinovanou léčbou mitoxantronem 12 mg/m2 a prednisonem 5 mg denně. Mitoxantron byl podáván do kumulativní toxicity 144 mg/m2, docetaxel maximálně 12 cyklů. Režim docetaxelu s EMP vedl k signifikantnímu prodloužení přežití, k prodloužení doby do progrese a ke zlepšení odpovědi jak biochemické, tak i objektivní. Počet úmrtí se v důsledku toxicity ve větvi docetaxel plus estramustin nezvýšil.
Studie TAX 327, prezentovaná na ASCO 2004 de Wittem [3], randomizuje pacienty do tří větví: 1. docetaxel 75 mg/m2 + prednison 5 mg každé tři týdny; 2. docetaxel 30 mg/m2 + prednison 5 mg týdně; 3. mitoxantron 12 mg/m2 + prednison 5 mg každé 3 týdny. Závěry dokládají zlepšení přežití u pacientů léčených třítýdenní aplikací docetaxelu oproti větvi s mitoxantronem (18,9 v. 16,4 měsíce, p = 0,009), a 24% snížení rizika smrti. Neutropenická reakce byla nejnižší ve větvi s týdenní aplikací docetaxelu, nejvyšší s třítýdenním podáním. Třítýdenní aplikace docetaxelu vychází jako optimální.
Pokud podáváme kombinace po sobě, pak se PSA odpověď při léčbě docetaxelem po podávání mitoxantronu dostavíve 38 %, je-li pořadí léků opačné, odpověď dosáhneme pouze ve 12 %.
Kombinace VIN-DOX [2] s podáním docetaxelu 25 mg/m2 a vinorelbinu 20 mg/m2 vede ke zmírnění klinických obtíží, nikoliv však ke zlepšení přežití. Montgomery [13] dokládá 75% odpověď na léčbu kombinací docetaxel plus diethylstibestrol.
Management sledování a léčby hormonálně independentního karcinomu prostaty a racionální místo taxanů v něm shrnuje tab. 3 [9].
Perspektivy docetaxelu v léčbě karcinomu prostaty
Recentní studie se zaměřují na možnost ovlivnit vývoj nádorového procesu v jeho jednotlivých stupních (iniciace, proliferace, angiogeneze, invaze, metastazování). Příznivý efekt u HICaP bývá spojován s léčbou kombinacemi některých biologických látek, jako jsou např. inhibitory receptoru pro epidermální růstový faktor (EGFR) a jeho signální kaskády (cetuximab, trastuzumab či erlotinib), antagonisté receptoru endotelinu A (atrasentan), inhibitory angiogeneze (thalidomid) a další. V klinických studiích např. ECOG 1839, SWOG 0111 a jiných jsou kombinace studovány. První výsledky z letošního ASCO předkládají kombinace docetaxel + ipilimumab [16], docetaxel + oral capicetabine [10] či docetaxel a ABT-751 (sulfonamide antimicrotubule agent [12]) s přijatelnou toxicitou. Naopak kombinace s imatinibem [11] nezlepšuje účinnost docetaxelu a zvyšuje toxicitu léčby. Výsledky dvojitě zaslepené randomizované studie ASCENT s docetaxelem a kalcitriolem dokládají lepší přežití a lepší odpověď ve větvi s kalcitriolem, avšak intermitentní podávání je vhodné pouze u 18 % pacinetů [1]. Stejně tak není prokázan signifikantní vliv na prodloužení období [5] bez kostních komplikací u nemocných s kostní generalizací ve studii ASCENT. Naopak dobrou odpověď v léčbě kostní patologie s odezvou v PSA můžeme očekávat při kombinaci docetaxelu se samariem [7].
Nové studie se zaměřují na časnou adjuvantní léčbu pacientů s rizikovými faktory při radikální léčbě (Gleasonovo skóre > 7, při pozitivních chirurgických okrajích), iPSA > 20 ng/ml). RTOG-9902 porovnává hormonální léčbu s chemohormonální terapií (EMP, paklitaxel a etoposid) po zevní radiaci. Velmi rizikové nemocné po radikální prostatektomii sleduje ve dvou ramenech studie SWOG 9921, a to při léčbě goserelinem s bicalutamidem ve srovnání s léčbou goserelinem s mitoxantronem. Studie AUO randomizuje rizikové pacienty po radikální prostatektomii do tří ramen se sledováním po dobu tří let. Srovnává hormonální léčbu v monoterapii a v kombinaci s ibandronatem; posledním ramenem je hormonální léčba kombinací ibandronat plus docetaxel. Do studie TAX 3501 zaměřené na rizikové pacienty léčené radikální prostatektomií s časnou či odloženou hormonální léčbou leuprorelinem s docetaxelem nebo monoterapií leuprorelinem jsou zatím pacienti zařazováni. Na její první výsledky budeme ještě dlouho čekat. Progression free survival je cílem také ve III. fázi Cooperative VA study 553. Tato studie srovnává adjuvantní léčbu rizikových pacientů po radikální prostatektomii ve dvou větvích léčených docetaxelem s prednisonem v. přísné sledování. Zde již bylo předpokládané množství pacientů zařazeno, nicméně na výsledky je ještě brzy. Radiační léčba v kombinaci s docetaxelem (RTOG 0521 a D2 Amico study) u vysoce rizikových pacientů s lokalizovaným či lokálně pokročilým karcinomem prostaty čeká na možnost hodnocení.
Závěr
Na konci minulého století jsme zaznamenali první úspěšné pokusy v léčbě nemocných s hormonálně independentním karcinomem. Kombinace mitoxantronu s prednisonem znamenala významný obrat v pohledu na možnost léčebného ovlivnění nádoru, o kterém se soudilo, že není vůči chemoterapii senzitivní. Prodloužení přežití proti přirozenému průběhu onemocnění a zlepšení klinického stavu vedlo k zařazení cytotoxických režimů do klinické praxe. Začátek našeho století pak do schématu léčby hormonálně independentního karcinomu prostaty vložil docetaxel v různých kombinacích. Standardem se stala kombinace docetaxelu s prednisonem. Další využití, především v časné adjuvanci lokalizovaného či lokálně pokročilého onemocnění, je závislé na závěrech probíhajících studií.
Seznam použité literatury
- [1] Beer TM, et al. Initial results from ASCENT study. Prom Am Soc Clin Oncol 2006; abstr. 4518.
- [2] Di Lorenzo G, Pizza C, Autorino R, et al. Weekly docetaxel and Vinorelbine (VIN-DOX) at first line treatment in patients with hormone refractory prostate cancer. Eur Urol 2004; 46: 712–716.
- [3] Eisenberger MA, de Witt R, Berry W, et al. A multicenter phase III comparison of docetaxel (D) + prednison (P) and mitoxantron (MTZ) + P in patients with hormone-refractory prostate cancer (HRPC). Prom Am Soc Clin Oncol 2004; 23 (abstr. 4).
- [4] Foldyna M. Docetaxelum. Remedia 2005; 15: 345–354.
- [5] Chan JS, et al. RCT comparing incidence of skeletal-related event (SRE) in pts treated with docetaxel + calcitriol to pts on docetaxel + placebo in ASCENT study. Prom Am Soc Clin Oncol 2006, abstr. 4614.
- [6] Kantoff PW, Halabi S, Conaway M, et al. Hydrocortisone with or without mitoxantrone in men with hormone refractory prostate cancer: results of the cancer and leukaemia group B 9182 study. J Clin Oncol 1999; 17: 2506–2013.
- [7] Laplanche A, et al. Phase II trial of docetaxel + samarium as consolidation treatment after docetaxel-estramustine in 30 pts. Prom Am Soc Clin Oncol 2006; abstr. 4608.
- [8] Matoušková M, Hanuš M. Mitoxantron v léčbě hormonálně independentního karcinomu prostaty. Urológia 2000; 6: 35–36.
- [9] Matoušková M, Fínek J. Management sledování a terapie hormonálně independentního karcinomu prostaty. Edukační sborník BOD 2005; 213–214.
- [10] Marur S, et al. Phase II trial with docetaxel + oral capicetabine in 21 chemotherapy-naive pts with mHRPC. Prom Am Soc Clin Oncol 2006; abstr. 4636.
- [11] Mathew P, et al. Docetaxel in combination with imatinib in mHRPC. Prom Am Soc Clin Oncol 2006; abstr. 4562.
- [12] Michels JE, et al. Phase I trial of docetaxel and ABT-751 (sulphonamide antimicrotubule agent) in pts with mHRPC. Prom Am Soc Clin Oncol 2006; abstr. 4651.
- [13] Montgomery B, et al. Phase II trial of diethylstilbestrol (DES) + D in 29 pts with metastatic HRPC (mHRPC). Prom Am Soc Clin Oncol 2006; abstr. 4627.
- [14] Petrylac DP, Tangen C, Hussain M, et al. SWOG 99–16: Randomised phase III trial of docetaxel (D)/Estramustin (E) versus mitoxantron (M)/prednison (P) in men with androgen-independent prostate cancer (AIPCA). Prom Am Soc Clin Oncol 2004; 23: (abstr. 3).
- [15] Petrylac DP, Tangen C, Hussain M, et al. Docetaxel and estramustin compared with mitoxantron and prednison for advanced refractory prostate cancer. N Engl J Med 2004; 351: 1513–1520.
- [16] Small E, et al. Phase II trial comparing docetaxel + ipilimumab (N = 20) to ipilimumab (N = 23) only in 43 chemotherapy-naive pts with mHRPC. Prom Am Soc Clin Oncol 2006; abstr. 4609.
- [17] Tannock JF, de Wit R, Berry WJ, et al. Docetaxel plus prednison or mitoxantrone plus prednison for advanced cancer. N Engl J Med 2004; 351: 1502–1512.