Regorafenib v léčbě kolorektálního karcinomu Studie CORRECT a vlastní zkušenosti s léčbou regorafenibem v Masarykově onkologickém ústavu
Léčba metastatického kolorektálního karcinomu (mCRC) prodělala v posledních dvou dekádách významnou změnu a chemoterapie v kombinaci s cílenou léčbou vedla k zásadnímu prodloužení celkového přežití pacientů. V současnosti dosahuje medián celkového přežití (median overall survival, mOS) okolo 29 měsíců. Regorafenib je léčebnou alternativou pro pacienty s mCRC s vyčerpanou onkologickou léčbou. Ve studii CORRECT prokázal přínos jak v prodloužení času do progrese – 1,9 měsíce versus 1,7 měsíce (poměr rizik, hazard ratio – HR = 0,49; interval spolehlivosti, confidence interval – 95% CI: 0,42–0,58; p < 0,0001), tak i v prodloužení celkového přežití – 6,4 měsíce versus 5 měsíců ve skupině s placebem (HR = 0,79 ve finální analýze 95% CI: 0,66–0,94; p = 0,0038) u všech predefinovaných skupin bez závislosti na stavu mutace genu KRAS. Nežádoucí účinky jsou podobné jako při podávání jiných multikinázových inhibitorů. Jejich výskyt je nejčastější v úvodu léčby, proto je také doporučována pečlivá monitorace pacienta v průběhu prvních dvou cyklů. Právě včasným zásahem, léčbou nežádoucích účinků, případně přerušením terapie a úpravou dávky můžeme významně ovlivnit kvalitu života pacienta. Nejčastějším nežádoucím účinkem stupně 3 a více byl hand-foot syndrom, únava, průjem, hypertenze a rash. Článek shrnuje závěry studie CORRECT, management nežádoucích účinků léčby regorafenibem a vlastní zkušenosti s léčbou.
Úvod
Léčba metastatického kolorektálního karcinomu (metastatic colorectal cancer, mCRC) prodělala v posledních dvou dekádách významnou změnu a vedla k zásadnímu prodloužení celkového přežití pacientů [1, 2]. V současnosti dosahuje medián celkového přežití (median overall survival, mOS) okolo 29 měsíců [3]. Standardní chemoterapeutický režim zahrnuje fluoropyrimidiny, dále oxaliplatinu a irinotekan. Pokroky v molekulární cílené terapii přinesly začlenění monoklonálních protilátek do léčebného schématu mCRC. Bevacizumab, protilátka proti vaskulárnímu endoteliálnímu faktoru (anti-VEGF), a cetuximab nebo panitumumab, protilátky proti epidermálnímu růstovému faktoru (anti-EGFR), jsou nedílnou součástí léčby, v případě bevacizumabu v kombinaci s chemoterapií, v případě anti-EGFR léčiv v kombinaci nebo i samostatně u RAS-nemutovaných nádorů [4–8]. Po vyčerpání shora uvedených modalit systémové léčby zbývá bohužel pouze kvalitní paliativní symptomatická terapie.
Regorafenib rozšiřuje možnosti léčby mCRC. Jedná se o perorální multikinázový inhibitor, který selektivně ovlivňuje onkogenezi, angiogenezi a nádorové mikroprostředí [9]. Regorafenib inhibuje signální proteiny zahrnuté do onkogeneze, jako je BRAF a RAF1, dále tyrosinkinázy zahrnuté do angiogeneze, kam náleží receptor VEGF (VEGFR) 1, 2 a 3 a klíčový regulátor angiogeneze – tyrosinkináza s homologní doménou 2 pro imunoglobulinový a epidermální růstový faktor (TIE-2). V neposlední řadě regorafenib inhibuje stromální kinázy ovlivňující nádorové mikroprostředí, kam řadíme receptor pro destičkový růstový faktor (platelet-derived growth factor receptor, PDGFR-β) a receptor pro fibroblastový růstový faktor (fibroblast growth factor receptor, FGFR).Protinádorový efekt u pokročilých solidních tumorů včetně kolorektálního karcinomu prokázala studie fáze I [10], která stanovila denní dávku 160 mg podávanou po dobu 21 dní s následující týdenní pauzou. V expanzní kohortě dosáhli vysoce předléčení pacienti s mCRC parciální remise ve 4 % a až v 70 % stabilizace onemocnění, jak ukázalo hodnocení podle kritérii RECIST (Response Evaluation Criteria in Solid Tumors), verze 1.1. Úspěch ve studii fáze I vedl k realizaci studie CORRECT, která hodnotila účinnost a bezpečnost regorafenibu u skupiny pacientů progredujících do tří měsíců po ukončení standardní terapie [11].
Studie CORRECT
CORRECT (Colorectal Cancer Treated with Regorafenib or Placebo After Failure of Standard Therapy) je mezinárodní multicentrická, randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie fáze III, do níž se zapojilo 114 center z 16 zemí. Podmínkou pro zařazení bylo vyčerpání všech standardních léčebných modalit mCRC, včetně anti-EGFR léčby pacientů s tzv. divokým typem (wild‑type) mutace genu KRAS. Ve studii bylo 760 pacientů randomizovaně rozděleno v poměru 2 : 1 buď k podávání regorafenibu v dávce 160 mg vždy po tři týdny s následnou týdenní pauzou, nebo do kontrolní skupiny s placebem. Primárním cílem studie bylo celkové přežití (overall survival, OS), sekundárními cíli pak doba přežití bez progrese onemocnění (progression-free survival, PFS), objektivní odpověď (response rate, RR) hodnocená každých 8 týdnů, počet léčebných odpovědí, bezpečnost a kvalita života. Je důležité zdůraznit, že téměř polovina pacientů byla předléčena více než čtyřmi předchozími liniemi chemoterapie/cílené terapie pro metastatické onemocnění. Stratifikačními kritérii byla předchozí terapie anti-VEGF, doba od stanovení diagnózy (přibližně 18 měsíců), geografický region. Studie použila 90% sílu k průkazu 33,3% prodloužení mediánu mOS s předpokladem 4,5měsíčního mOS pro skupinu dostávající placebo (poměr rizik, hazard ratio – HR = 0,75).
Výsledky
Regorafenib v kombinaci s nejlepší podpůrnou léčbou prokázal statisticky signifikantní přínos v celkovém přežití ve srovnání s placebem, mOS dosahoval 6,4 měsíce ve skupině s regorafenibem oproti 5 měsícům (5,0) ve skupině s placebem při HR = 0,79 ve finální up-datované analýze (konfidenční interval – 95% CI: 0,66–0,94; p = 0,0038). Ve skupině s regorafenibem došlo k 21% redukci rizika úmrtí. Regorafenib předčil placebo i při hodnocení sekundárních cílových ukazatelů – přežití bez progrese onemocnění (median progression-free survival, mPFS, 1,9 měsíce vs. 1,7 měsíce; HR = 0,49; 95% CI: 0,42–0,58; p < 0,0001) a celkové kontroly nemoci (41 % vs. 15 %; p < 0,0001). Tato výhoda oproti placebu byla zaznamenána ve všech podskupinách stratifikovaných podle doby, která uplynula od stanovení diagnózy mCRC, dále podle typu předchozí protinádorové terapie, počtu předchozích linií léčby a také podle přítomnosti mutace KRAS (která nepředstavovala prognostický ani prediktivní faktor ve vztahu k léčbě regorafenibem).V retrospektivní analýze dat 22 pacientů sledovaných v jednom centru [12] se ukázalo, že časná radiologická odpověď, kavitace v plicních metastázách a snížení nádorové denzity signalizuje lepší klinický průběh; tato informace by mohla být cenná v kontextu hledání/predikce skupiny nemocných, kteří mají z léčby regorafenibem maximální přínos.
Bezpečnost
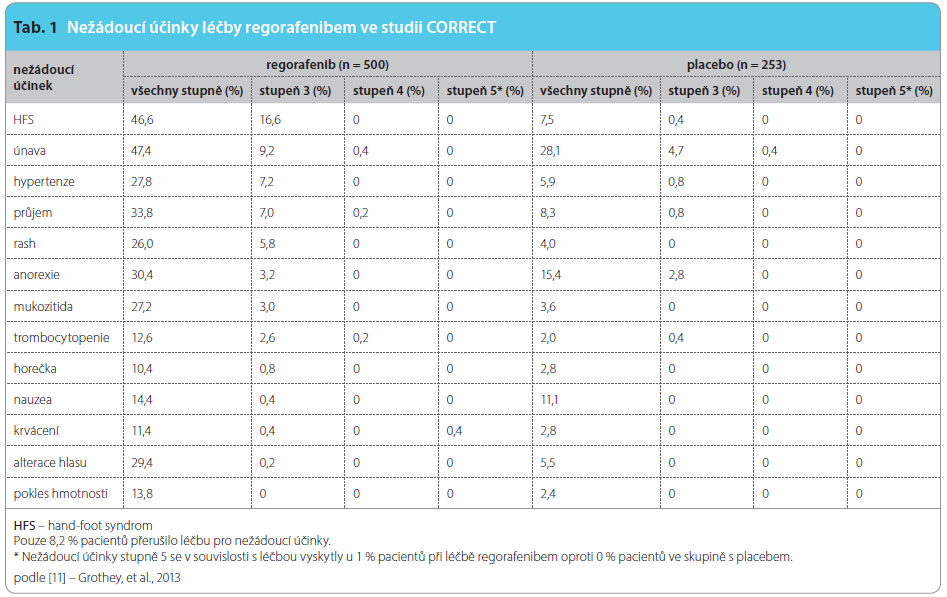
Ve studii CORRECT nebyly pozorovány nové či neočekávané závažné nežádoucí účinky regorafenibu. Nejčastějšími nežádoucími účinky stupně 3 byly hand‑foot syndrom (HFS), únava, astenie, průjem, hypertenze, rash a infekce. Přehled nežádoucích účinků ve studii CORRECT shrnuje tab. 1. Většina nežádoucích účinků se projevuje velmi časně, tedy první a druhý týden terapie, a jejich incidence klesá v následných cyklech. Dále je patrné, že dávka regorafenibu je relativně stabilní po prvních třech cyklech léčby a není zjevná kumulativní toxicita [13]. Časný management nežádoucích účinků vede k lepší toleranci a adherenci pacienta k léčbě. Podle standardizovaných dotazníků regorafenib ve srovnání s placebem nezhoršuje kvalitu života.
Management nežádoucích účinků léčby
Hand-foot syndrom
Ve studii CORRECT byl HFS zaznamenán ve 47 % případů v rameni s regorafenibem, toxicita stupně 3 pak až v 17 % případů. Tento nežádoucí účinek nastupuje velmi časně, tzn. v průběhu prvních dvou až čtyř týdnů terapie, zatímco v průběhu osmého cyklu byla incidence toxicity stupně 1 (grade 1, G1) pouze 5 %. HFS se predilekčně vyskytuje v místech exponovaných tlaku (plosky nohou, dlaně) a typické jsou hyperkeratotické léze s okolním erytémem a dále puchýře. Kožní projevy jsou velmi bolestivé a interferující s kvalitou života. Léčebná opatření by měla být zahájena profylakticky před nástupem samotného nežádoucího účinku. Zahrnují pedikúru, případně manikúru a pečlivé odstranění ztvrdlé pokožky, dále používání měkkých ponožek, případně rukavic jako prevence otlaků, pacienti by měli nosit pohodlnou obuv, vložky do bot a stejně tak ochranné rukavice. K profylaxi HFS dále patří užívání změkčujících krémů, na hyperkeratotické oblasti je pak vhodné aplikovat keratolytické krémy na bázi urey nebo s obsahem kyseliny salicylové [13, 14]. Tato profylaktická a léčebná opatření se týkají managementu toxicity G1, v případě vyšší toxicity – G2 a G3 – je namístě redukce dávky či přerušení léčby.
Hypertenze
Ve studii CORRECT byla hypertenze zaznamenána ve 28 % případů v rameni s regorafenibem. Většina případů se vyskytla stejně jako u HFS v průběhu prvního cyklu. Hypertenze byla definována v souladu s Joint National Comitee on Prevention, Detection, Evalutation and Treatmentof High Blood Pressure Guidelines (JNC7) a zahrnovala tlak 140/90 mm Hg a vyšší. Monitorace tlaku by měla probíhat týdně v průběhu prvních šesti týdnů, eventuálně je doporučován selfmonitoring tlaku pacientem. Doporučená antihypertenzní medikace zahrnuje všechny skupiny antihypertenziv včetně thiazidových diuretik, inhibitorů angiotenzin konvertujícího enzymu, betablokátorů, inhibitorů kalciového kanálu [13, 14]. Vzestup tlaku o 20/10 mm Hg by měl být signálem k zahájení léčby dvojkombinací antihypertenziv s obsahem thiazidového diuretika. V případě trvající hypertenze je samozřejmostí úprava dávkování regorafenibu.
Průjem
Ve studii CORRECT byl zaznamenán průjem stupně 1 a 2 u 34 % pacientů v rameni s regorafenibem. V takovém případě je doporučen standardní postup zahrnující dietní opatření, dostatek tekutin a elektrolytů, medikaci loperamidem, případně tinkturou opii, v případě průjmu stupně 3 je pak nutná substituce iontů, případně parenterální aplikace oktreotidu.
Únava
Únava jako symptom byla zaznamenána až ve 47 % případů ve srovnání s 28% výskytem únavy v rameni s placebem. Management léčby zahrnuje režimová opatření – dostatečnou hydrataci, nutriční opatření, dále dle potřeby podání antidepresiv, úpravu anémie, eventuálně podání hypnotik v případě nespavosti. Samozřejmostí je nastavení analgetické terapie při projevech nedostatečně kontrolovaného algického syndromu jako příčiny únavy.
Abnormální jaterní testy
Zvýšené hodnoty jaterních transamináz AST, ALT a zvýšené hodnoty bilirubinu byly častým nežádoucím účinkem v rameni s regorafenibem. Jejich výskyt byl nejčastější v průběhu prvního a druhého cyklu a většinou se jednalo o změny lehkého až středního stupně. Ovlivnitelné jsou přerušením léčby, případně redukcí dávky. S ohledem na výskyt v úvodu léčby je vhodné monitorovat jaterní funkce v průběhu prvních dvou měsíců ve čtrnáctidenních intervalech, následně pak již jednou měsíčně. Pacienti s elevací jaterních testů by měli být monitorováni jednou týdně tak dlouho, dokud aktivita jaterních enzymů neklesne pod trojnásobek vstupních hodnot.
Dávkování a úprava dávky
Doporučené dávkování regorafenibu je 160 mg podávaných denně (4 tablety po 40 mg užité najednou) ve stejnou dobu po tři týdny s následnou sedmidenní pauzou. Toto čtyřtýdenní období se považuje za jeden léčebný cyklus. Tablety by se měly užívat po lehkém jídle, které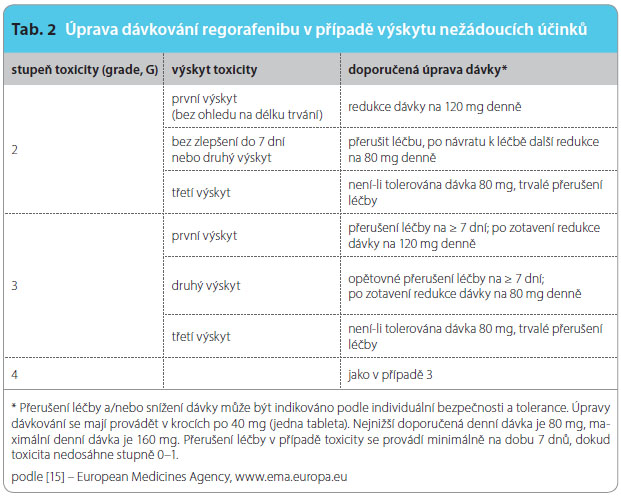 neobsahuje více než 30 % tuku, polykat celé a zapíjet vodou. Úpravu dávkování v případě výskytu nežádoucích účinků shrnuje tab. 2.
neobsahuje více než 30 % tuku, polykat celé a zapíjet vodou. Úpravu dávkování v případě výskytu nežádoucích účinků shrnuje tab. 2.
Vlastní zkušenosti v Masarykově onkologickém ústavu
Od října 2010 do června 2013 jsme v Masarykově onkologickém ústavu zahájili léčbu regorafenibem u 18 pacientů s mCRC. Medián délky léčby byl dvanáct týdnů. Výsledky a průběh léčby stejně jako nutnost úpravy dávky jsou shrnuty v tab. 3.
Doba přežití bez pro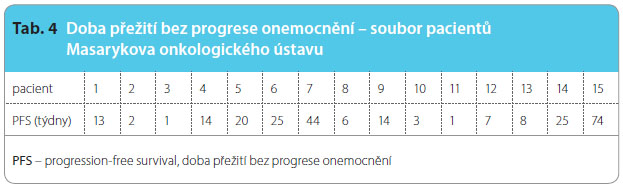 grese onemocnění a nežádoucí účinky léčby byly hodnoceny u 15 pacientů, viz tab. 4, graf 1. Celkově osm pacientů dosáhlo PFS delší než tři měsíce bez ohledu na použitou redukci dávek. Nejvyšší výskyt nežádoucích účinků manifestujících se zejména jako HFS, hypertenze, únava a průjem byl pozorován v prvních týdnech léčby. Proto je v praxi důležité pacienta při léčbě regorafenibem v úvodních čtyřech až osmi týdnech pečlivě sledovat, nejlépe jedenkrát týdně, a včas terapeuticky zasáhnout. Právě časté kontroly v úvodu léčby, včasná léčba nežádoucích úč
grese onemocnění a nežádoucí účinky léčby byly hodnoceny u 15 pacientů, viz tab. 4, graf 1. Celkově osm pacientů dosáhlo PFS delší než tři měsíce bez ohledu na použitou redukci dávek. Nejvyšší výskyt nežádoucích účinků manifestujících se zejména jako HFS, hypertenze, únava a průjem byl pozorován v prvních týdnech léčby. Proto je v praxi důležité pacienta při léčbě regorafenibem v úvodních čtyřech až osmi týdnech pečlivě sledovat, nejlépe jedenkrát týdně, a včas terapeuticky zasáhnout. Právě časté kontroly v úvodu léčby, včasná léčba nežádoucích úč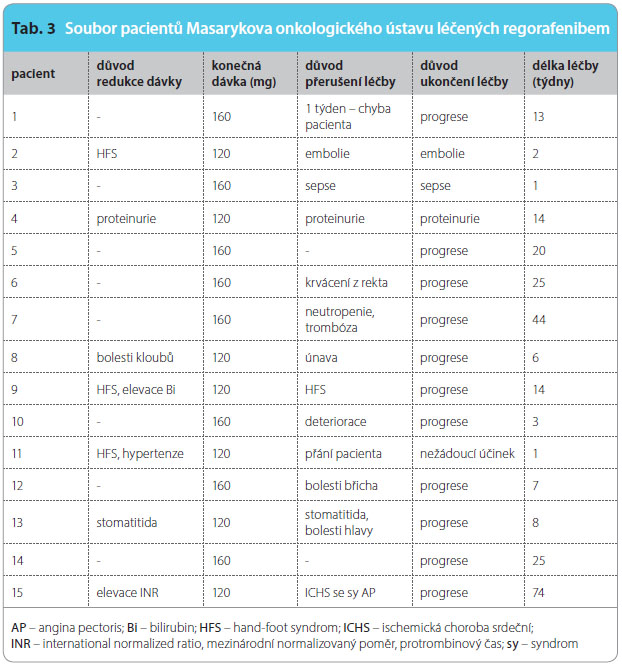 inků, promptní úprava dávky dle individuální toxicity, případné přerušení léčby zlepšují compliance pacientů a umožňují efekt terapie. V našem souboru ukončili léčbu pro výskyt nežádoucích účinků čtyři pacienti. K redukci dávky došlo téměř u
inků, promptní úprava dávky dle individuální toxicity, případné přerušení léčby zlepšují compliance pacientů a umožňují efekt terapie. V našem souboru ukončili léčbu pro výskyt nežádoucích účinků čtyři pacienti. K redukci dávky došlo téměř u![Graf 1 Souhrn nežádoucích účinků – vlastní soubor pacientů MOÚ; podle [13, 14] – Khan, et al., 2014, Wayne, 2012. G1, G2, G3 – nežádoucí účinek stupně 1, 2, 3; MOÚ – Masarykův onkologický ústav](https://www.remedia.cz/photo-a-29971---.jpg) poloviny pacientů. Zdá se, že právě individuální dávkování je důležité v praktickém managementu léčby. S ohledem na výskyt nežádoucích účinků a nutnost redukce dávek se ukazuje, že optimální biologická dávka bude pravděpodobně u části pacientů nižší než 160 mg.
poloviny pacientů. Zdá se, že právě individuální dávkování je důležité v praktickém managementu léčby. S ohledem na výskyt nežádoucích účinků a nutnost redukce dávek se ukazuje, že optimální biologická dávka bude pravděpodobně u části pacientů nižší než 160 mg.
Závěr
Regorafenib je léčebnou alternativou pro pacienty s mCRC s vyčerpanou onkologickou léčbou. Ve studii CORRECT prokázal regorafenib skromný přínos jak v prodloužení doby přežití bez progrese onemocnění, tak i v prodloužení celkového přežití u všech predefinovaných skupin bez závislosti na stavu mutace genu KRAS. Nežádoucí účinky jsou podobné jako u jiných multikinázových inhibitorů. Jejich výskyt je nejčastější v úvodu léčby, proto je také doporučována pečlivá monitorace pacienta v průběhu prvních dvou cyklů. Právě včasným zásahem, léčbou nežádoucích účinků, případně přerušením terapie a úpravou dávky můžeme významně ovlivnit kvalitu života pacienta. Nejčastějším nežádoucím účinkem je hand-foot syndrom, hypertenze, únava, průjem, rash a dysfonie. Do budoucna je nutné definovat skupinu pacientů, která by měla z této léčby největší prospěch. Dle retrospektivní analýzy malé skupiny pacientů se zdá, že časná radiologická odpověď by mohla být stratifikačním signálem k pokračování v terapii.
Práce byla podpořena Evropským fondem pro regionální rozvoj a státním rozpočtem České republiky (OP VaVpI – RECAMO, CZ.1.05/2.1.00/03.0101) a MZ ČR – RVO (MOÚ, 00209805).
Seznam použité literatury
- [1] NCCN guidelines, NCCN Clinical Practice Guidelines in Oncology Colon Cancer. Version 3. Fort Washington, PA, NCCN; 2014.
- [2] Schmoll HJ, et al. ESMO Consensus Guidelines for management of patients with colon and rectal cancer. A personalized approach to clinical decision making. Ann Oncol 2012; 23: 2479–2516.
- [3] Modrá kniha České onkologické společnosti. Zhoubný novotvar kolorekta. 2014.
- [4] Stinzing S, Jung A, Rossius L, et al. Analysis of KRAS/NRAS and BRAF mutations in FIRE-3: A randomized phase III study of FOLFIRI plus cetuximab or bevacizumab as first-line treatment for wild-type (WT) KRAS (exon 2) metastatic colorectal cancer (mCRC) patients. European Cancer Congress, 27 Sep - 01, Oct 2013; Amsterdam, Niederlands. Abstract 17.
- [5] Saltz LB, Clarke S, Diaz-Rubio E, et al. Bevacizumab in combination with oxaliplatin-based chemotherapy as first-line therapy in metastatic colorectal cancer: a randomized phase III study. J Clin Oncol 2008; 26: 2013–2019.
- [6] Giantonio BJ, Catalano PJ, Meropol NJ, et al. Bevacizumab in combination with oxaliplatin, fluorouracil, and leucovorin (FOLFOX4) for previously treated metastatic colorectal cancer: results from the Eastern Cooperative Oncology Group Study E3200. J Clin Oncol 2007; 25: 1539–1544.
- [7] Douillard JY, Oliner KS, Siena S, et al. Panitumumab-FOLFOX4 treatment and RAS mutations in colorectal cancer. N Engl J Med 2013; 369: 1023–1034.
- [8] Cunningham D, Humblet Y, Siena S, et al. Cetuximab monotherapy and cetuximab plus irinotecan in irinotecan-refractory metastatic colorectal cancer. N Engl J Med 2004; 351: 337–345.
- [9] Wilhelm SM, Dumas J, Adnane L, et al. Regorafenib (BAY 73-4506): a new oral multikinase inhibitor of angiogenic, stromal and oncogenic receptor tyrosine kinases with potent preclinical antitumor activity. Int J Cancer 2011; 129: 245–255.
- [10] Mross K, Frost A, Steinbild S, et al. A phase I dose-escalation study of regorafenib (BAY 73-4506), an inhibitor of oncogenic, angiogenic, and stromal kinases, in patients with advanced solid tumors. Clin Cancer Res 2012; 18: 2658–2667.
- [11] Grothey A, Van Cutsem E, Sobrero A, et al. Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT): an international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet 2013; 381: 303–312.
- [12] Ricotta R, Sartore-Bianchi A, Verrioli A, et al. Regorafenib in metastatic colorectal cancer. Lancet 2013; 381: 1537.
- [13] Khan G, Moss RA, Braiteh F, et al. Proactive strategies for regorafenib in metastatic colorectal cancer: implications for optimal patient management. Cancer Manag Res 2014; 6: 93–103.
- [14] Bayer HealthCare Pharmaceuticals Inc. Clinical Study report 14387 (CORRECT). Wayne, NJ: Bayer HealthCare Pharmaceuticals Inc. 2012: 1–179.
- [15] European Medicines Agency, Stivarga (regorafenib) EU Summary of Product Charakteristics. http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_-_Product_Information/human/002573/WC500149164.pdf Navštíveno 3. 9. 2014.