Rivastigmin v léčbě demence u Parkinsonovy nemoci
Parkinsonova nemoc s demencí (PND) patří podobně jako demence s Lewyho tělísky (DLB) mezi tzv. synukleinopatie, tj. proteinopatie, které se vyznačují patologickým ukládáním proteinu alfa-synukleinu v neuronech a v glii ve specifických oblastech kůry a podkoří. PND a DLB sdílejí společné klinické symptomy a patologický substrát, liší se zejména časovou posloupností rozvoje jednotlivých charakteristických příznaků. Ačkoliv deficit dopaminu je příčinou parkinsonismu u pacientů s PND a DLB, cholinergní deficit je hlavní příčinou kognitivní dysfunkce a psychotických symptomů. Otevřené studie poukázaly na možný pozitivní vliv všech inhibitorů acetylcholinesterázy na demenci a další neuropsychiatrické symptomy provázející PND a DLB. Zatímco efekt rivastigminu na kognitivní deficit a behaviorální a psychologické symptomy při demenci (BPSD) u DLB byl prokázán dvojitě slepou studií již před šesti lety, první multicentrická, placebem kontrolovaná studie s rivastigminem potvrdila efekt tohoto léčiva i u pacientů s PND a na základě výsledků této studie byl rivastigmin registrován pro terapii PND.
Úvod
U všech pacientů s Parkinsonovou nemocí (PN) dochází k degeneraci dopaminergních buněk v substantia nigra pars compacta (buněčný komplex A9). S postupnou progresí onemocnění jsou ale v různé míře postiženy i jiné neurotransmiterové systémy a dochází k úbytku dopaminergních buněk ve ventrálním tegmentu (buněčný komplex A10) a degeneraci buněk noradrenergních (locus coeruleus), cholinergních (nucleus basalis Meynerti) a serotoninergních (nuclei dorsales rapheae) [1, 2]. Vedle hlavních motorických symptomů PN se objevují pozdní hybné komplikace a další příznaky, zejména vegetativní, senzitivní a neuropsychiatrické. K posledně jmenovaným patří behaviorální a afektivní symptomy a kognitivní deficit a demence [3].
Demence u Parkinsonovy nemoci
Kognitivní poruchy mírného stupně jsou časté již v časné fázi onemocnění [4, 5] a mohou progredovat do demence u 20–40 % [6], dle recentní studie [7] až u 78,2 % pacientů v pozdním stadiu nemoci. Rozvoj demence u PN snižuje kvalitu života [8], zvyšuje stres pečovatele, zkracuje dobu setrvání pacienta v kruhu rodiny a urychluje jeho umístění do ústavu s ošetřovatelskou péčí. Demence významně zkracuje dobu přežití pacientů s PN (způsobuje dvojnásobný nárůst mortality) [5, 6, 9].
Jak již bylo naznačeno, patofyziologicky se pravděpodobně uplatňuje jednak úbytek dopaminergních buněk, jednak rozsáhlejší degenerativní procesy, zejména degenerace cholinergních buněk a přerušení jejich vzestupných drah [1, 2, 6, 9]. Morfologické studie s použitím nových technik MRI (voxel-based morfometrie, VBM) prokazují zejména atrofii v oblasti předního cingula, hippocampu, thalamu, ncl. caudatus a prefrontálního a okcipitálního kortexu u pacientů s PND oproti pacientům s PN bez demence [10–12]. Z hlediska rozvoje neuropatologických změn popisují Braak a spoluautoři [13] šest stadií progrese PN dle lokalizace Lewyho tělísek a Lewyho neuritů v predilekčních oblastech podkoří a kůry. Zjednodušeně řečeno, na počátku rozvoje onemocnění (stadium 1–3) se podle autorů objevují výše popsané patognomické změny nejdříve v dorzálním motorickém jádru n. vagus a bulbus olfactorius a postupně v dalších oblastech mozkového kmene včetně substantia nigra. Poté jsou zasaženy ncl. basalis Meynerti, temporální kortex a amygdala, naposledy (difuzní typ; stadium 5–6) i asociační neokortex a premotorický kortex. Problémem tohoto „stagingu" je především fakt, že množství Lewyho tělísek nekoreluje s úbytkem nervových buněk v daných oblastech. Zatím se zdá, že neuropatologický staging dle Braaka a spolupracovníků platí u 83 % pacientů se sporadickou PN (problémem je, že se mnohdy vyskytují Lewyho tělíska a Lewyho neurity ve vyšších oblastech kůry a podkoří, aniž by byly zároveň přítomny v nižších etážích mozkového kmene), ale překvapivě funguje v 78 % také u pacientů s progresivní supranukleární paralýzou a v 80 % u pacientů s kortikobazální degenerací. Posledně jmenované jednotky se přitom vyznačují především patologickým ukládáním hyperfosforylovaného tau-proteinu a řadíme je mezi tzv. tauopatie. Recentní studie naznačují, že je to pravděpodobně spíše celkové množství Lewyho tělísek nežli neuropatologický staging dle Braaka a spoluautorů, které koreluje s progresí kognitivního deficitu u pacientů s PND [14, 15].
Z hlediska terapie je významné právě snížení kortikální cholinergní aktivity u pacientů s PND [6, 9]. Deficit kortikální acetylcholintransferázy koreluje s tíží kognitivního deficitu a vizuálních halucinací [6].
Neuropsychologický profil demence u PN je charakterizován progresivním „dysexekutivním" syndromem s paměťovým deficitem a poruchou abstraktního myšlení [5, 16–18]. Riziko rozvoje demence u pacientů s PN je 1,7–5,9krát vyšší než u běžné populace stejného věku, vzdělání a pohlaví. Rizikové faktory zahrnují věk pacienta (spíše nežli věk v počátku onemocnění), tíži parkinsonského syndromu (především akineze a axiální symptomatiky), nízký dosažený stupeň vzdělání, familiární výskyt demence, přítomnost psychotické poruchy navozené medikací, mužské pohlaví a podle některých studií i přítomnost deprese. Pro praxi je navíc důležité si uvědomit, že kognitivní poruchy zvyšují riziko pro rozvoj lékově navozených psychotických stavů (halucinací, bludů a deliria). Psychotický stav se u těchto pacientů může rozvinout spontánně, ale především jako následek zvýšení jakékoliv antiparkinsonské terapie. Demence u PN tedy významně omezuje také možnosti farmakoterapie hybných symptomů PN [5, 6, 18].
Diferenciální diagnostika
Diferenciálně diagnosticky je třeba především odlišit některé motorické symptomy typické pro Parkinsonovu nemoc (jako je hypomimie, hypokineze, hypofonie) a tzv. „pseudodemenci" při depresi. Také některé léky (anticholinergika, amantadin, tricyklická antidepresiva a hypnotika) mohou svým především anticholinergním působením navodit nebo zhoršit symptomy demence, především dezorientaci, poruchy paměti, pozornosti, myšlení a chování [5, 19]. Z recentních studií vyplývá, že pacienti dlouhodobě léčení anticholinergiky mají klinicky významnější poruchy paměti a exekutivních funkcí oproti pacientům neléčeným anticholinergiky [20], navíc dle klinicko-patologických studií koreluje blokáda muskarinových receptorů u PN s nálezem neurofibrilárních klubek a neuritických plak, patognomických pro Alzheimerovu nemoc [21].
Od PND je dále třeba odlišit Alzheimerovu nemoc, některá onemocnění ze skupiny „parkinson plus", v případě časného počátku rozvoje parkinsonské symptomatiky a demence s familiárním výskytem i Westphalovu variantu Huntingtonovy nemoci, Wilsonovu nemoc nebo vzácnější autozomálně dominantně vázané varianty spinocerebelární ataxie (SCA). Z dalších vzácnějších sekundárních příčin parkinsonismu s demencí bychom měli myslet na hypoparatyreózu, komplex AIDS-demence, Creutzfeldtovu-Jakobovu nemoc, cévní onemocnění mozku nebo otravu oxidem uhelnatým [5, 18, 22].
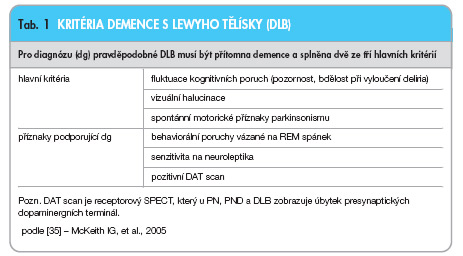
Pro demenci s Lewyho tělísky (DLB) jsou charakteristické fluktuace kognitivních funkcí, spontánní příznaky parkinsonismu a časné vizuální halucinace, viz tab. 1.
Pakliže se objeví parkinsonský syndrom jako první příznak, demence následuje rozvoj hybných příznaků do dvou let. Časový interval je ovšem arbitrární, proto někteří autoři hovoří o jedné biologické jednotce DLB-PND s variabilním klinickým spektrem symptomů v čase a s variabilním množstvím Lewyho tělísek v kortexu a v mozkovém kmeni.
Léčba demence u Parkinsonovy nemoci
Zjistíme-li těžší kognitivní deficit/demenci u pacienta s PN, musíme v prvé řadě postupně ukončit terapii léčivy s anticholinergním účinkem (biperiden, benzatropin, procyklidin, amantadin, tricyklická antidepresiva). V případě nutnosti intenzivnější dopaminergní medikace není indikována terapie agonisty dopaminových receptorů vzhledem k vyššímu riziku navození psychotických komplikací. Vznikne-li dopaminomimetická psychotická porucha, musíme postupně snižovat dávky až ukončit léčbu další antiparkinsonskou medikací v následujícím pořadí: amantadin, selegilin, agonisté dopaminových receptorů. Není dostupná kauzální léčba, a proto je hlavním cílem oddálit deterioraci kognitivních funkcí a snížit rychlost jejího postupu, léčit behaviorální poruchy, depresi, anxietu a zlepšit schopnost pacienta vykonávat běžné denní aktivity. Z rozsáhlé literatury zabývající se léčbou Alzheimerovy nemoci vyplývá, že tato kritéria alespoň částečně splňuje terapie inhibitory acetylcholin-esterázy (iACHE) [19, 22, 23]. Na našem trhu jsou k dispozici tři léčiva z této třídy určená pro léčbu Alzheimerovy nemoci (AN): donepezil, rivastigmin a galantamin. V poslední době bylo provedeno několik otevřených studií s iAChE i u pacientů s PND [6, 9]. Jednalo se o otevřené studie zahrnující vesměs malé počty pacientů. .Arsland a spolupracovníci [24] použili zkřížené uspořádání studie pro hodnocení efektu donepezilu v dávce 5–10 mg/den ve srovnání s placebem a referovali pozitivní efekt donepezilu, ovšem pouze u 14 pacientů s PND.
Zatímco multicentrická, placebem kontrolovaná studie jednoznačně potvrdila efekt rivastigminu v dávce do 12 mg/den na kognitivní a především behaviorální symptomy také u 120 pacientů s pravděpodobnou diagnózou DLB [25] již v roce 2000, na první mezinárodní dvojitě slepou studii s rivastigminem v léčbě PND jsme si museli počkat až do roku 2004.
Klíčová studie
Emre a spolupracovníci [26] zahrnuli do této 24týdenní studie 541 pacientů s PN, u kterých se objevila mírná až středně těžká demence (Mini-Mental State Examination, MMSE = 10–24 bodů, [14]) po minimálně dvou letech od stanovení klinické diagnózy PN.
Cíle a metodika
Pacienti byli randomizováni v poměru 2 : 1 pro užívání rivastigminu v dávce 3–12 mg/den nebo pro užívání placeba.
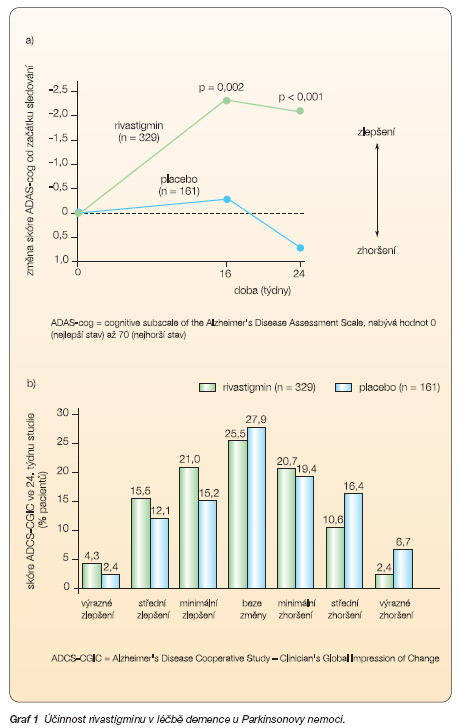
Primárním cílem bylo hodnocení změny v kognitivní škále ADAS-cog (cognitive subscale of the Alzheimer´s Disease Assessment Scale [27]) a ve škále ADCS-CGIC (Alzheimer´s Disease Cooperative Study – Clinician´s Global Impression of Change [28]) před zahájením terapie a po 16 a 24 týdnech od zahájení léčby daným léčivem. Škála ADAS-cog hodnotí orientaci, paměť, řeč, vizuospaciální a praktické funkce a nabývá hodnot od 0 (nejlepší stav) do 70 bodů (nejhorší stav). ADCS-CGIC je sedmibodová škála, která hodnotí globální změnu stavu od vstupu do studie. Skór 1 ukazuje výrazné zlepšení, skór 2 střední a skór 3 minimální zlepšení, skór 4 znamená beze změny stavu, skór 5–7 indikuje postupně minimální, středně těžké a výrazné zhoršení stavu (7 bodů značí nejhorší stav).
K dalším škálám, které byly použity pro hodnocení kognitivního výkonu (zejména exekutivních funkcí), denních aktivit a behaviorálních a psychologických symptomů při demenci (sekundární cíle), patřily následující škály: ADCS-ADL (Alzheimer´s Disease Cooperative Study-Activities of Daily Living scale [29]), NPI (Neuropsychiatric Inventory [30]), MMSE, desetibodový Test hodin [31], Test verbální fluence [32] a některé počítačové neuropsychologické testy, hodnotící především reakční časy [33]. Hybný stav pacientů byl hodnocen pomocí standardizované škály UPDRS, část III (Unified Parkinson´s Disease Rating Scale, part III: Motor Examination [34]). Byly zaznamenávány a hodnoceny nežádoucí efekty léčby, EKG, hmotnost, výsledky běžných laboratorních testů a vitální funkce. Titrace na celkovou denní dávku 3, 6, 9 a 12 mg byla prováděna dle snášenlivosti v čtyřtýdenních intervalech. Léčivo užívali pacienti 2krát denně.
Výsledky
Pacienti v obou skupinách se statisticky signifikantně nelišili v průměrných vstupních hodnotách UPDRS III (34,0 Î 14,6 a 32,2 Î 13,2 ve skupině s rivastigminem a ve skupině s placebem a MMSE (19,4 Î 3,8 a 19,2 Î 4,1), ani v demografických údajích (věkem, pohlavím, délkou vzdělání) a délkou trvání PN či délkou trvání demence. Studii dokončilo 72,7 % pacientů v rivastigminové větvi a 82,1 % pacientů ve větvi s placebem. Průměrná denní dávka rivastigminu po dokončení titrace byla 8,6 mg a zůstala stabilní do konce sledování.
Pacienti léčení rivastigminem se oproti skupině, která dostávala placebo, statisticky významně zlepšili ve škále ADAS-cog (průměrné zlepšení o 2,1 bodu oproti zhoršení ve skupině dostávající placebo o 0,7 bodu v týdnu 24; p < 0,001), viz graf 1a. V ADCS-CGIG škále byl průměrný skór na konci studie 3,8 ve větvi s rivastigminem a 4,3 ve skupině s placebem. Ve srovnání s placebem mělo v rivastigminové skupině signifikantně více pacientů lepší celkový výsledek (p = 0,007), viz graf 1b. Navíc pacienti v rivastigminové skupině vykazovali statisticky signifikantně lepší výsledky ve všech ukazatelích hodnotících sekundární cíle (reakční časy, exekutivní funkce, denní aktivity, BPSD).
Mezi hlavní a nejčastější nežádoucí účinky patřily nauzea (29,0 % ve větvi s rivastigminem a 11,2 % ve větvi s placebem; p < 0,001), zvracení (16,6 % ve větvi s rivastigminem a 1,7 % ve větvi s placebem; p < 0,001) a třes (10,2 % ve větvi s rivastigminem a 3,9 % ve větvi s placebem; p = 0,01). Většina nežádoucích efektů byla mírného nebo středního stupně. Zastoupení závažných nežádoucích účinků (NÚ) bylo srovnatelné v obou skupinách (13,0 % ve skupině s rivastigminem a 14,5 % ve skupině s placebem). Ačkoliv parkinsonismus jako referovaný NÚ léčby byl významněji zastoupen v rivastigminové větvi ve srovnání s placebem (27,3 % a 15,6 %; p = 0,002), nejčastěji se jednalo o samostatný třes a tento NÚ byl příčinou předčasného ukončení studie v rivastigminové větvi pouze u 1,7 % všech případů. Navíc rozdíl v hodnocení motoriky dle škály UPDRS v obou skupinách nebyl statisticky signifikantní, a to ani v podškále hodnotící pouze třes. Nauzea a vomitus byly jediné další NÚ, které se ve velmi malém procentu (0,6–3,6 %) podílely na předčasném ukončení studie v obou skupinách. Ve výsledcích laboratorních testů, EKG a vitálních funkcí nebyly signifikantní rozdíly mezi oběma skupinami.
Závěr
Lze tedy shrnout, že studie jednoznačně prokázala účinnost terapie rivastigminem na kognitivní funkce včetně exekutivních funkcí, na aktivity denního života a na behaviorální projevy demence u Parkinsonovy nemoci. Míra efektu rivastigminu v léčbě PND je srovnatelná s efektem rivastigminu v léčbě Alzheimerovy nemoci (hodnoceno pomocí škál ADAS-cog, ADCS-CGIC). Nejčastějšími nežádoucími účinky byly nauzea, vomitus a třes.
Seznam použité literatury
- [1] Jellinger KA. What is new in degenerative dementia disorders? Wien Klin Wochenschr 1999; 111: 682–704.
- [2] Wolters ECh, Francot CMJE. The Concept of mental dysfunctions in Parkinson´s disease. In: Wolters ECh, Scheltens P and Berendse HW (eds): Mental Dysfunction in Parkinson´s disease II. Academic Pharmaceutical Productions 1999: 35–48.
- [3] Rektorová I, Rektor I. Parkinsonský syndrom. In: Rektor I, Rektorová I, et al.: Centrální poruchy hybnosti v praxi. Movement disorders. Praha, Triton, 2003.
- [4] Lees AJ, Smith E. Cognitive deficits in the early stages of Parkinson´s disease. Brain 1983; 106: 257–270.
- [5] Rektorová I. Kognitivní a behaviorální poruchy u demence při Parkinsonově nemoci a u demence s Lewyho tělísky. Neurologie pro praxi 2004; 1: 15–21.
- [6] Burn DJ, McKeith IG. Current treatment of dementia with Lewy bodies and dementia associated with Parkinson´s disease. Mov Disord 2003; 18 (Supl 6): 72–79.
- [7] Årsland D, Andersen K, Larsen JP, et al. Prevalence and characteristics of dementia in Parkinson´s disease: an 8-year prospective study. Arch Neurol 2003; 60: 387–392.
- [8] Schrag A, Jahanshahi M, Quinn NP. What contributes to quality of life in patients with Parkinson´s disease? J Neurol Neurosurg Psychiatry 2000; 69: 289–290.
- [9] Poewe W. Treatment of dementia with Lewy bodies and Parkinson´s disease dementia. Mov Disord 2005; 20: S77–S82.
- [10] Burton EJ, McKeith IG, Burn DJ, et al. Cerebral atrophy in Parkinson´s disease with and without dementia: a comparison with Alzheimer´s disease, dementia with Lewy bodies and controls. Brain 2004; 127: 791–800.
- [11] Nagano-Saito A, Washimi Y, Arahata Y, et al. Cerebral atrophy and its relation to cognitive impairment in Parkinson disease. Neurol 2005; 64: 224–229.
- [12] Summerfield C, Junque C, Tolosa E, et al. Structural brain changes in Parkinson´s disease with dementia. Arch Neurol 2005; 62: 281–285.
- [13] Braak H, Del Tredici K, Rub U, et al. Staging of brain pathology related to sporadic Parkinson´s disease. Neurobiol Aging 2003; 24: 197–211.
- [14] Åarsland D, Perry R, Brown A, et al. Neuropathology of dementia in Parkinson´s disease: a prospective, community-based study. Ann Neurol 2005; 58: 773–776.
- [15] Braak H, Rub U, Jansen Steur EN, et al. Cognitive status correlates with neuropathologic stage in Parkinson disease. Neurol 2005; 64: 1404–1410.
- [16] Galvin JE, Pollack J, Morris JC. Clinical phenotype of Parkinson disease dementia. Neurol 2006; 67: 1605–1611.
- [17] Janvin CC, Larsen JP, Salmon DP, et al. Cognitive profiles of individual patients with Parkinson´s disease and dementia: comparison with dementia with Lewy bodies and Alzheimer´s disease. Mov Disord 2006; 21: 337–342.
- [18] Rektorová I. Demence u Parkinsonovy nemoci a jiných extrapyramidových onemocnění. In: Růžička E, et al. Diferenciální diagnostika a léčba demencí. Příručka pro praxi. Praha, Galén, 2003.
- [19] Rektorová I. Terapie demencí. Neurologie pro praxi 2002; 4: 260–263.
- [20] Bedard MA, Pillon B, Dubois B, et al. Acute and long-term administration of anticholinergics in Parkinson´s disease: specific effects on the subcorticofrontal syndrome. Brain Cogn 1999; 40: 289–313.
- [21] Perry EK, Kilford L, Lees AJ, et al. Increased Alzheimer pathology in Parkinson´s disease related to antimuscarinic drugs. Ann Neurol 2003; 54: 235–238.
- [22] Rektorová I. Demence. In: Rektor I, et al. Centrální poruchy motoriky a demence. Plzeň, Adéla – grafické studio, 2003.
- [23] Cummings JL. Treatment of Alzheimer´s disease: current and future therapeutic approaches. Rev Neurol Dis 2004; 1: 60–69.
- [24] Årsland D, Laake K, Larsen JP, Janvin C. Donepezil for cognitive impairment in Parkinson´s disease: a randomised controlled study. J Neurol Neurosurg Psychiatry 2002; 72: 708–712.
- [25] McKeith IG, Del Ser T, Spano P, et al. Efficacy of rivastigmine in dementia with Lewy bodies: a randomised, double-blind, placebo-controlled international study. Lancet 2000; 356: 2031–2036.
- [26] Emre M, Aarsland D, Albanese A, et al. Rivastigmine for dementia associated with Parkinson´s disease. N Engl J Med 2004; 351: 1518–2509.
- [27] Rosen WG, Mohs RC, Davis KL. A new rating scale for Alzheimers´s disease. Am J Psychiatry 1984; 141: 1356–1364.
- [28] Schneider LS, Olin JT, Doody RS, et al. Validity and reliability of the Alzheimer´s Disease Cooperative Study – Clinical Global Impression of Change: the Alzheimer´s disease Cooperative Study. Alzheimer Dis Assoc Disord 1997; 11: S22–S32.
- [29] Galasko D, Bennett D, Sano M, et al. An inventory to assess activities of daily living for clinical trials in Alzheimer´s disease. The Alzheimer´s Disease Cooperative Study. Alzheimer Dis Assoc Disord 1997; 11: S33–39.
- [30] Cummings JL, Mega M, Gray K, et al. The Neuropsychiatric Inventory: comprehensive assessment of psychopathology in dementia. Neurol 1994; 44: 2308–2314.
- [31] Manos PJ, Wu R. The ten point clock test: a quick screen and grading method for cognitive impairment in medical and surgical patients. Int J Psychiatry Med 1994; 24: 229–244.
- [32] Delis DC, Kaplan E, Kramer JH. Delis-Kaplan executive function system. San Antonio, Tex: Psychological Corporation, 2001.
- [33] Simpson PM, Surmon DJ, Wesnes KA, Wilcock GK. The cognitive drug research computerized assessment system for demented patients: a validation study. Int J Geriatr Psychiatry 1991; 6: 95–102.
- [34] Fahn S, Elton RL. Members of the UPDRS Development Committee. Unified Parkinson´s disease Rating Scale. In: Fahn S, Marsden CD, Calne DB, Goldstein M, eds. Recent developments in Parkinson´s disease. Florham Park, N.J.: Macmillan Healthcare Information 1987: 153–164.
- [35] McKeith IG, Dickson DW, Lowe J, et al. Diagnosis and management of dementia with Lewy bodies: third report of the DLB Consortium. Neurol 2005; 65: 1863–1872.