Secukinumab v nových revmatologických indikacích
Souhrn:
Secukinumab (Cosentyx®) je nový biologický lék určený k léčbě psoriatické artritidy (PsA) a ankylozující spondylitidy (AS). Jedná se o plně humánní monoklonální protilátku selektivně inhibující IL‑17A (interleukin 17A). V klinických studiích MEASURE 1, 2 a 3 bylo prokázáno, že secukinumab má dobrou účinnost a bezpečnost při léčbě symptomů u ankylozující spondylitidy. Ve studiích FUTURE 1 a 2 byla zjištěna dobrá účinnost v léčbě psoriatické artritidy. Během dvouletého sledování bylo taktéž ověřeno, že u více než 80 % pacientů dochází k zástavě rentgenové progrese sledovaných onemocnění. V těchto studiích byl kromě toho prověřen i dobrý bezpečnostní profil secukinumabu, kdy nebylo prokázáno zvýšené riziko vzniku tuberkulózy a jiných oportunních infekcí, malignit ani autoimunitních onemocnění. Secukinumab tak představuje novou léčebnou alternativu při terapii ankylozující spondylitidy i psoriatické artritidy.
Key words: secukinumab – anti-IL-17 – ankylosing spondylitis – psoriatic arthritis.
Summary:
Secukinumab (Cosentyx®) represents a novel biological therapy of psoriatic arthritis (PsA) and ankylosing spondylitis (AS). It is a fully human monoclonal antibody, selectively inhibiting IL-17A (interleukin-17A). Clinical trials MEASURE 1, 2, and 3 have demonstrated that secukinumab shows good effectiveness and safety with respect to treatment of ankylosing spondylitis symptoms. Trials FUTURE 1 and 2 have confirmed its good effectiveness in the treatment of psoriatic arthritis. During 2 years of follow-up, it was found out that more than 80% patients experience zero radiological progression of their disease while on this treatment. The above trials have also shown good safety profile of secukinumab – there was no increased risk of tuberculosis or other opportunistic infections, malignancies or autoimmune disorders. Secukinumab can thus be seen as a novel alternative treatment for patients with ankylosing spondylitis or psoriatic arthritis.
Úvod
V nejbližší době přivítáme na trhu v České republice nový biologický lék secukinumab (Cosentyx®), který je určen k léčbě psoriatické artritidy (PsA) a ankylozující spondylitidy (AS). Jedná se o plně humánní monoklonální protilátku selektivně inhibující IL 17A (interleukin 17A). Vývoj secukinumabu vycházel přímo z pochopení patofyziologie spondylartropatií. Klíčovou roli v patogenezi psoriázy i PsA hrají lymfocyty CD4+T helper (Th) 17, produkující interleukiny IL 17 a IL 22. Četné studie prokázaly zvýšenou expresi IL 17A u PsA a demonstrovaly současně pozitivní asociaci této zvýšené exprese s tíží onemocnění. V psoriatických kožních lézích byla zjištěna zvýšená exprese Th17 specifického transkripčního faktoru (RORt) a také vyšší výskyt cytokinů indukovaných lymfocyty Th17, jako jsou IL 23, IL 6, IL 1β, a to v porovnání s kůží zdravých dobrovolníků. Rovněž u ankylozující spondylitidy bylo prokázáno, že polymorfismus receptoru pro IL 23 je spojen s vývojem tohoto onemocnění![Obr. 1 Role T buněk v patogenezi spondylartropatií; podle [2] – Lories, McInnes, 2012.](https://www.remedia.cz/photo-a-30900---.jpg) , z čehož bylo odvozeno, že IL 23 a jeho receptor pravděpodobně hrají zásadní roli při rozvoji AS. Interleukin 23 pak ovlivňuje lymfocyty Th17 produkující IL 21, IL 22 a IL 17. Uvedené interleukiny přispívají k vývoji čtyř patologických pochodů u AS a PsA, jako jsou vývoj psoriatických plaků, tvorba pannu v kloubu, vývoj osteitidy a erozí v kloubu i vytváření nových kostních formací [1]. Bylo zjištěno, že zásadní roli v patogenezi spondylartropatií hrají T lymfocyty nacházející se v entezích, tedy v místě spojení mezi šlachou a kostí (obr. 1) [2].
, z čehož bylo odvozeno, že IL 23 a jeho receptor pravděpodobně hrají zásadní roli při rozvoji AS. Interleukin 23 pak ovlivňuje lymfocyty Th17 produkující IL 21, IL 22 a IL 17. Uvedené interleukiny přispívají k vývoji čtyř patologických pochodů u AS a PsA, jako jsou vývoj psoriatických plaků, tvorba pannu v kloubu, vývoj osteitidy a erozí v kloubu i vytváření nových kostních formací [1]. Bylo zjištěno, že zásadní roli v patogenezi spondylartropatií hrají T lymfocyty nacházející se v entezích, tedy v místě spojení mezi šlachou a kostí (obr. 1) [2].
Na základě farmakokinetických studií bylo prokázáno, že po aplikaci je secukinumab jen pomalu absorbován, přičemž systémová expozice je proporcionální s výší podávané látky. Po subkutánní aplikaci 150 mg nebo 300 mg je dosaženo maximální koncentrace po 5–6 dnech, průměrná biologická dostupnost je odhadována na 73 %. Clearance secukinumabu je nezávislá na dávce a čase, přičemž postupně dochází pouze k pomalé systémové eliminaci. Jeho poločas je přibližně 27 dnů [3]. Protože k metabolismu secukinumabu dochází především intracelulárně, pravděpodobnost interakce s jinými léky je minimální. Farmakokinetické vlastnosti nejsou ovlivněny při současném podávání methotrexatu. Nebyl zjištěn ani negativní vliv secukinumabu na odpověď při podání inaktivovaných vakcín, jako jsou meningokokové vakcíny nebo vakcíny influenzy [3]. Vzhledem k velikosti molekuly je secukinumab jako intaktní imunoglobulin filtrován ledvinami pouze zcela minimálně, také exkrece do žluči je velmi nízká, z tohoto důvodu není třeba u osob ve věku nad 65 let ani u pacientů s renálním nebo s hepatálním poškozením upravovat jeho dávku [4].
Ankylozující spondylitida
Účinnost secukinumabu v léčbě AS byla poprvé prokázána ve dvojitě slepé, placebem kontrolované studii fáze II. Ve skupině léčené secukinumabem (n = 24) bylo v šestém týdnu u 59 % pacientů dosaženo 20% zlepšení dle kritérií ASAS (Mezinárodní společnost pro hodnocení spondylartritid, Assessment of SpondyloArthritis international Society), zatímco ve skupině léčené placebem bylo toto zlepšení zjištěno pouze u 24 % jedinců [5]. V extenční studii, která trvala 94 týdnů, byla prokázána redukce zánětlivých lézí na magnetické rezonanci (MRI) u pacientů léčených secukinumabem. Tato redukce změn na MRI korelovala se zlepšením klinických parametrů [6].
Účinek secukinumabu v léčbě AS byl dále prokázán i ve třech studiích fáze III. Tyto studie stále ještě probíhají, k dispozici máme zatím jen dílčí výsledky. MEASURE 1 byla dvouletá studie, u níž nyní probíhá tříletá extenze, MEASURE 2 je pětiletá studie a konečně MEASURE 3 je koncipována jako tříletá studie. Ve studiích MEASURE 1 a 2 byl porovnáván účinek secukinumabu podávaného v dávkách 75 mg a 150 mg podkožně každé 4 týdny a účinek placeba. Ve studii MEASURE 1 byla u pacientů léčených secukinumabem v úvodu podávána zaváděcí dávka intravenózního secukinumabu ve výši 10 mg/kg, a to v týdnu 0, 2 a 4, dále pak následovala terapie 75 mg nebo 150 mg secukinumabu podávaného subkutánně každé 4 týdny. Ve studii MEASURE 2 dostávali pacienti úvodní dávku 75 mg nebo 150 mg secukinumabu v týdnu 0, 1, 2 a 3 a nadále pak každé 4 týdny, a to počínaje čtvrtým týdnem. Ve studii MEASURE 3 byli pacienti léčeni intravenózně zaváděcí dávkou 10 mg/kg v týdnu 0, 2, 4, následovala subkutánní aplikace 150 mg nebo 300 mg secukinumabu každé 4 týdny (týden 4, 8, 12). Ve všech třech studiích dostávala třetina pacientů v prvních 16 týdnech placebo. V 16. týdnu byli tito placebem léčení pacienti tzv. rerandomizováni, přičemž ti, kteří splnili kritéria 20% zlepšení dle ASAS, dostávali ve studii MEASURE 1 nadále placebo až do 24. týdne. Takzvaní non respondeři byli ve studii MEASURE 1 od 16. týdne léčeni secukinumabem v dávce 75 mg nebo 150 mg à 4 týdny. Ve studii MEASURE 2 dostávali všichni jedinci léčení původně placebem od 16. týdne secukinumab 75 mg nebo 150 mg každé 4 týdny. Také ve studii MEASURE 3 byl všem pacientům od 16. týdne aplikován secukinumab v dávce 150 mg nebo 300 mg každé 4 týdny. Primárním cílem sledování bylo dosažení 20% zlepšení dle kritérií ASAS v 16. týdnu.
Při podávání secukinumabu 75 mg s.c. každé 4 týdny bylo signifikantního zlepšení dle kritérií ASAS 20 v porovnání s placebem dosaženo pouze ve studii MEASURE 1 [7], zatímco ve studii MEASURE 2 [8] tento signifikantní rozdíl 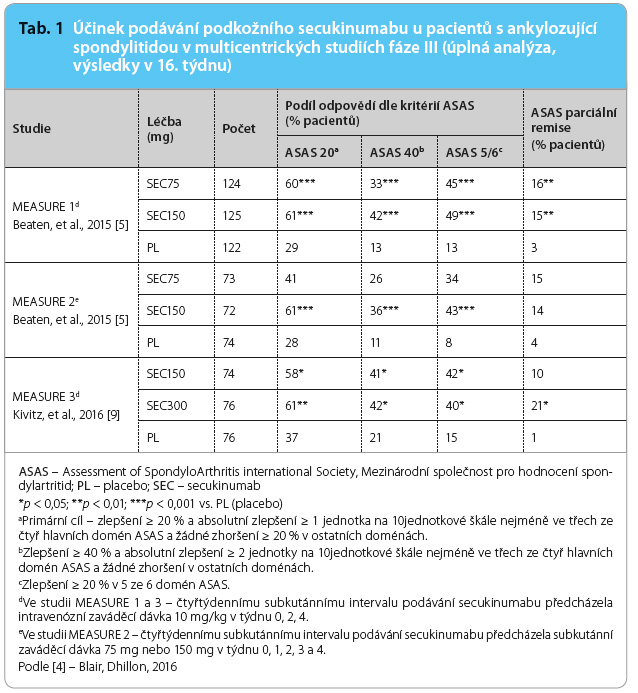 nenastal (tab. 1). Účinek ve studii MEASURE 1 byl dán pravděpodobně velkou zaváděcí intravenózní dávkou secukinumabu. Nicméně jistý rozdíl v účinnosti mezi dávkou 75 mg a 150 mg secukinumabu každé 4 týdny byl ve studii MEASURE 1 zaznamenán i v 52. týdnu [7]. Z výsledků studií vyplynulo, že secukinumab 150 mg aplikovaný subkutánně ve čtyřtýdenních intervalech spolu se zaváděcí dávkou subkutánního secukinumabu v týdnu 0, 1, 2, 3 (jak bylo provedeno ve studii MEASURE 2) je účinný v léčbě ankylozující spondylitidy a v tomto režimu bylo regulačními orgány schváleno jeho podávání.
nenastal (tab. 1). Účinek ve studii MEASURE 1 byl dán pravděpodobně velkou zaváděcí intravenózní dávkou secukinumabu. Nicméně jistý rozdíl v účinnosti mezi dávkou 75 mg a 150 mg secukinumabu každé 4 týdny byl ve studii MEASURE 1 zaznamenán i v 52. týdnu [7]. Z výsledků studií vyplynulo, že secukinumab 150 mg aplikovaný subkutánně ve čtyřtýdenních intervalech spolu se zaváděcí dávkou subkutánního secukinumabu v týdnu 0, 1, 2, 3 (jak bylo provedeno ve studii MEASURE 2) je účinný v léčbě ankylozující spondylitidy a v tomto režimu bylo regulačními orgány schváleno jeho podávání.
Zlepšení při podávání secukinumabu bylo prokázáno ve studiích MEASURE 1 a MEASURE 2 i v 52. týdnu. Léčbu v tomto týdnu dokončilo celkem 86 % (MEASURE 1) a 83 % (MEASURE 2) pacientů. Bylo ověřeno dosažení primárního cíle studie, tedy 20% zlepšení dle kritérií ASAS. Zlepšení dle kritérií ASAS 20 bylo prokázáno v 52. týdnu u 77 % (MEASURE 1) a 74 % (MEASURE 2) pacientů. Současně bylo dosaženo i dalších předdefinovaných sekundárních cílů (zlepšení ASAS 40, ASAS 5/6, ASAS parciální remise, pokles hodnot vysoce pozitivního C reaktivního proteinu [hsCRP] a hodnot BASDAI [Bath Ankylosing Spondylitis Disease Activity Index]) [4]. Byla provedena též subanalýza odpovědi na léčbu mezi skupinami pacientů, kteří nebyli léčeni tumor nekrotizujícím faktorem alfa, tzv. TNFα naivních pacientů, a pacientů, u nichž byla v anamnéze nedostatečně účinná předchozí anti TNFα léčba. U TNFα naivních pacientů bylo v 16. týdnu dosaženo kritérií zlepšení ASAS 20 signifikantně více (p < 0,05) ve skupině léčené secukinumabem v porovnání s placebem (66,3 % vs. 32,6 % ve studii MEASURE 1 [7], 68,2 % vs. 31,1 % ve studii MEASURE 2 [8] a 63,2 % vs. 39,0 % ve studii MEASURE 3 [9]). Rovněž v případě pacientů, u nichž v minulosti selhala anti TNFα léčba, bylo v těchto třech studiích doloženo významně větší zlepšení dle kritérií ASAS 20 u nemocných léčených secukinumabem než u jedinců léčených placebem (45,5 % vs. 18,2 % a 50,0 % vs. 24,1 %, oboje p < 0,05 [7]; 41,2 % vs. 29,4 % [9,4]).
V rámci studie MEASURE 1 byla u 105 pacientů léčených secukinumabem v dávce 150 mg týdně provedena podstudie, která porovnávala MRI obraz sakroiliakálních (SI) kloubů a páteře po 16 týdnech terapie s MRI obrazem u pacientů, kteří byli léčeni placebem. Byl prokázán signifikantní rozdíl ve zlepšení Berlínského skóre hodnocení otoku SI kloubů (průměrné zlepšení skóre 59 % vs. 7 %), stejně tak byla zjištěna významně větší redukce skóre aktivity na páteři (Ankylosing Spondylitis spine MRI activity score, ASspi MRI a) s průměrným zlepšením hodnoty od baseline 42 % oproti 12 %. Snížení zánětlivé aktivity na MRI přetrvávalo u pacientů léčených secukinumabem i v 52. týdnu [10].
V další podstudii studie MEASURE 1 byla hodnocena též rentgenová progrese pomocí modifikovaného Stoke Ankylosing Spondylitis Spine Score (mSASSS). Přibližně 80 % všech pacientů, kteří byli od začátku léčeni secukinumabem v dávce 75 mg a 150 mg týdně, nemělo ve 104. týdnu zjištěnu rentgenovou progresi onemocnění (změna mSASSS ≤ 0), přičemž nebyl větší rozdíl v progresi mezi oběma dávkami. Výraznější změna skóre mSASSS se projevila u mužů, u pacientů s vyšším CRP a u nemocných se syndesmofyty [11].
Psoriatická artritida
Účinnost secukinumabu u pacientů s psoriatickou artritidou byla ověřena ve dvou randomizovaných, dvojitě slepých, placebem kontrolovaných studiích fáze III (FUTURE 1) [12] a FUTURE 2 [13]. Ve studii FUTURE 1 byla u pacientů léčených secukinumabem v úvodu podávána zaváděcí dávka intravenózního secukinumabu ve výši 10 mg/kg, a to v týdnu 0, 2 a 4, dále pak následovala terapie 75 mg nebo 150 mg secukinumabu subkutánně každé 4 týdny, jedna třetina pacientů byla v úvodu léčena placebem. Ve studii FUTURE 2 dostávali pacienti úvodní dávku 75 mg, 150 mg nebo 300 mg secukinumabu v týdnu 0, 1, 2 a 3 a nadále pak každé 4 týdny, a to počínaje čtvrtým týdnem. V obou studiích se jednalo o pacienty ve věku ≥ 18 let, kteří měli diagnózu psoriatické artritidy stanovenou na základě splnění kritérií CASPAR (Classification of Psoriatic Arthritis Criteria). Zařazovaní pacienti měli symptomy 6 měsíců a déle a dále museli prodělávat aktivní onemocnění (definováno jako ≥ 3 oteklé klouby a ≥ 3 bolestivé klouby), a to navzdory předcházející léčbě pomocí nesteroidních antirevmatik, chorobu modifikujících léků nebo anti TNFα terapii. U pacientů byla randomizace stratifikována dle předchozí anti TNFα léčby, která byla podávána ve studii FUTURE 1 celkem 29 % a ve studii FUTURE 2 celkem 35 % pacientů. Před zahájením léčby dostávalo ve studiích FUTURE 1 a 2 celkem 61 % a 47 % pacientů methotrexat, 16 % a 20 % jedinců bylo léčeno glukokortikoidy. V 16. týdnu byli pacienti klasifikováni podle toho, zda odpovídali nebo neodpovídali na léčbu (definováno jako ≥ 20% zlepšení oproti hodnotám před zahájením léčby, a to v počtu oteklých a bolestivých kloubů). Pacienti, kteří původně dostávali placebo, byli rerandomizováni (1 : 1) a dostávali 75 mg nebo 150 mg secukinumabu (FUTURE 1) a 150 mg nebo 300 mg secukinumabu (FUTURE 2) každé 4 týdny, a to od 16. týdne (tzv. non-respondeři) nebo od 24. týdne (tzv. respondeři). Primárním cílem studií bylo dosažení zlepšení dle kritérií ACR 20 (kritéria American College of Rheumatology) ve 24. týdn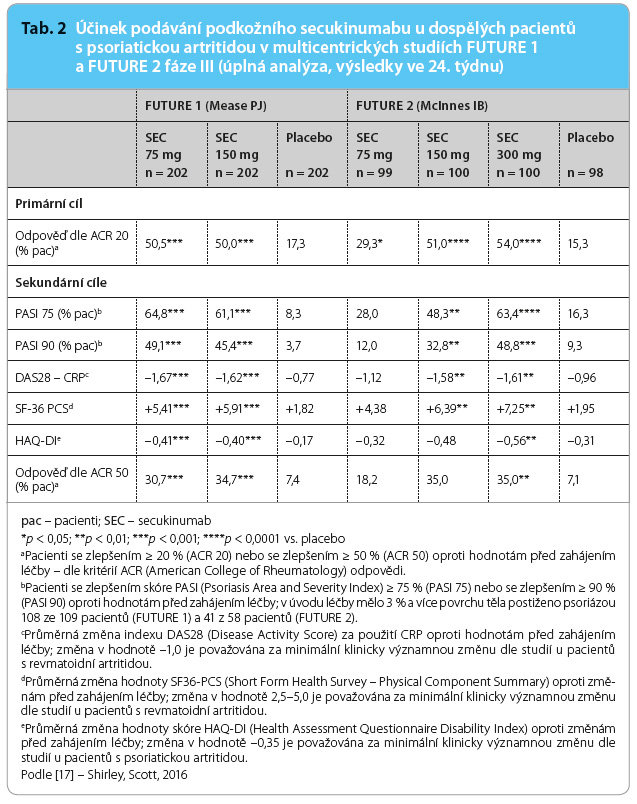 u podávání, současně byly sledovány ještě sekundární cíle (tab. 2). Ve studii FUTURE 1 bylo ve 24. týdnu dosaženo primárního cíle i všech předdefinovaných sekundárních cílů u obou dávek secukinumabu (75 mg i 150 mg) v porovnání s placebem. Účinnost secukinumabu byla dlouhodobá, 79 % pacientů dokončilo 104. týden podávání léku; 67 % a 70 % pacientů léčených secukinumabem v dávce 75 mg a 150 mg týdně dosáhlo odpovědi ACR 20 v 52. týdnu, ve 104. týdnu to pak bylo 69 % a 74 % [14]. Dále bylo ve studii zjištěno, že u těch pacientů, kteří měli daktylitidy nebo entezitidy před zahájením léčby, došlo ve 24. týdnu k vymizení daktylitid u 52 % (109/208) a k vymizení entezitid u 47 % (121/255) pacientů léčených secukinumabem, oproti tomu ve skupině léčené placebem došlo k vymizení daktylitid u 16 % (18/116) a entezitid u 13 % (15/117) pacientů, p < 0,005 oproti placebu. Klinický účinek secukinumabu byl dlouhodobý, ve 104. týdnu setrvávalo v léčbě 79 % pacientů. Více než 80 % pacientů léčených secukinumabem v dávce 75 mg nebo 150 mg nemělo ve 104. týdnu zjištěnu strukturální progresi (hodnoceno pomocí modifikovaného celkového Sharpova skóre, mTSS) [15].
u podávání, současně byly sledovány ještě sekundární cíle (tab. 2). Ve studii FUTURE 1 bylo ve 24. týdnu dosaženo primárního cíle i všech předdefinovaných sekundárních cílů u obou dávek secukinumabu (75 mg i 150 mg) v porovnání s placebem. Účinnost secukinumabu byla dlouhodobá, 79 % pacientů dokončilo 104. týden podávání léku; 67 % a 70 % pacientů léčených secukinumabem v dávce 75 mg a 150 mg týdně dosáhlo odpovědi ACR 20 v 52. týdnu, ve 104. týdnu to pak bylo 69 % a 74 % [14]. Dále bylo ve studii zjištěno, že u těch pacientů, kteří měli daktylitidy nebo entezitidy před zahájením léčby, došlo ve 24. týdnu k vymizení daktylitid u 52 % (109/208) a k vymizení entezitid u 47 % (121/255) pacientů léčených secukinumabem, oproti tomu ve skupině léčené placebem došlo k vymizení daktylitid u 16 % (18/116) a entezitid u 13 % (15/117) pacientů, p < 0,005 oproti placebu. Klinický účinek secukinumabu byl dlouhodobý, ve 104. týdnu setrvávalo v léčbě 79 % pacientů. Více než 80 % pacientů léčených secukinumabem v dávce 75 mg nebo 150 mg nemělo ve 104. týdnu zjištěnu strukturální progresi (hodnoceno pomocí modifikovaného celkového Sharpova skóre, mTSS) [15].
Ve studii FUTURE 2 bylo primárního cíle dosaženo u všech dávek secukinumabu (75 mg, 150 mg a 300 mg), sekundárních cílů však bylo dosaženo pouze u dávek 150 mg a 300 mg secukinumabu. Při podané dávce 300 mg secukinumabu došlo rovněž k signifikantnímu zlepšení skóre HAQ DI (Health Assessment Questionnaire Disability Index) a signifikantně více pacientů dosáhlo zlepšení dle kritérií ACR 50 (tab. 2). Účinek secukinumabu byl ověřen u všech pacientů, nezávisle na předchozí anti TNFα léčbě, ve skupině tzv. TNFα naivních pacientů byla však účinnost vyšší (hodnoceno dle ACR kritérií odpovědi i dle skóre PASI [Psoriasis Area and Severity Index]) [16]. Klinická odpověď trvala i v 52. týdnu, kdy odpovědi ACR 20 dosáhlo 73 % pacientů léčených v obou skupinách (secukinumab 150 mg i 300 mg), přičemž roční léčbu dokončilo celkově 84 % jedinců.
V uvedené studii byl hodnocen i výskyt daktylitid a entezitid, a to u těch pacientů, kteří vykazovali přítomnost těchto znaků před zahájením léčby. K vymizení daktylitidy došlo u 52 ze 111 pacientů (47 %) ve skupině léčené secukinumabem a u 4 z 27 pacientů (15 %) ve skupině léčené placebem. K vymizení entezitidy pak došlo u 76 ze 188 pacientů (40 %) ve skupině léčené secukinumabem a u 14 ze 65 pacientů (22 %) ve skupině s placebem.
Na základě výsledků studií FUTURE 1 a FUTURE 2 bylo regulačními orgány ve Spojených státech amerických i v Evropě schváleno podávání secukinumabu pro léčbu psoriatické artritidy. Pro psoriatickou artritidu se současně přítomnou středně těžkou až těžkou ložiskovou psoriázou nebo pro PsA nedostatečně odpovídající na anti TNFα terapii je doporučena dávka secukinumabu 300 mg ve formě dvou dílčích subkutánních injekcí po 150 mg, na počátku léčby 1× týdně, po 4. týdnu 1× měsíčně. U ostatních případů PsA se doporučuje začínat dávkou 150 mg v obvyklém schématu, při nedostatečné účinnosti je pak možno dávku zvýšit na 300 mg.
Nežádoucí účinky
Mezi nejčastější nežádoucí účinky, které byly zachyceny ve studiích se secukinumabem, patří infekce, a to zvláště v oblasti horních cest dýchacích. Nebyly ovšem pozorovány závažné oportunní infekce, exacerbace latentní tuberkulózy a ani vyšší výskyt virové hepatitidy. Kandidové infekce jsou obvykle orofaryngeální a vaginální, nezávažné, výjimečně byly zachyceny případy ezofagitidy, a to středně závažné, reagující na léčbu a bez nutnosti přerušit podávání secukinumabu [17].
Byly popsány případy hypersenzitivních reakcí, kdy převažovala urtika, dermatitida, kontaktní dermatitida nebo alergická rhinitida. Výskyt angioedému při léčbě secukinumabem se nelišil od jeho výskytu při podávání placeba. Výskyt malignit se ve studiích při léčbě secukinumabem nelišil od placeba. Během studií se secukinumabem nebyl pozorován a ani doložen kauzální vztah mezi secukinumabem a exacerbacemi Crohnovy choroby, ovšem s ohledem na účast IL 17 v patofyziologii onemocnění se doporučuje pacienty s touto chorobou léčené secukinumabem zvýšeně sledovat.
Nebylo pozorováno zvýšené riziko imunogenicity a s ní souvisejících nežádoucích účinků. U pacientů s psoriázou léčených secukinumabem nebylo pozorováno vyšší riziko paradoxního zhoršení psoriatických projevů nebo změny morfologie psoriatických projevů; není také zmiňováno jako riziko v SPC. Riziko demyelinizace CNS nebylo v klinických studiích popsáno a rovněž není uvedeno v SPC jako nežádoucí účinek.
Závěr
Dosavadní zkušenosti prokazují, že podkožně podávaný secukinumab v dávkách 150 mg a 300 mg v obvyklém režimu má dobrou účinnost i toleranci v léčbě ankylozující spondylitidy a psoriatické artritidy u dospělých pacientů, kteří mají aktivní onemocnění navzdory předcházející léčbě nesteroidními antirevmatiky, chorobu modifikujícími léky nebo anti TNFα terapií. Secukinumab je prvním schváleným lékem ze skupiny agens blokujících účinek IL 17, a představuje tak novou léčebnou alternativu v terapii těchto onemocnění.
Seznam použité literatury
- [1] Raychaudhuri SK, Saxena A, Raychaudhuri SP. Role of IL‑17 in the pathogenesis of psoriatic arthritis and axial spondyloarthritis. Clin Rheumatol 2015; 34: 1019–1023.
- [2] Lories RJ, McInnes IB. Primed for inflammation: enthesis‑resident T cells. Nature Medicine 2012; 7: 1018–1019.
- [3] Maldonado‑Ficco H, Parez‑Alamino R, Maldonado‑Cocco JA. Secukinumab: a promising therapeutic option in spondyloarthritis. Clin Rheumatol 2016; 35: 2151–2161.
- [4] Blair HA, Dhillon S. Secukinumab: A review in ankylosing spondylitis. Drugs 2016; 76: 1023–1030.
- [5] Beaten D, Baraliakos X, Braun J, et al. Anti‑interleukin‑17A monoclonal antibody secukinumab in treatment of ankylosing spondylitis: a randomised, double‑blind, placebo‑controlled trial. Lancet 2013; 382: 1705–1713.
- [6] Baraliakos X, Borah B, Braun J. Long‑term effects of secukinumab on MRI findings in relation to clinical efficacy in subjects with active ankylosing spondylitis: an observational study. Ann Rheum Dis 2016; 75: 408–412.
- [7] Baeten D, Sieper J, Braun J, et al. Secukinumab, an interleukin‑17A inhibitor, in ankylosing spondylitis. N Engl J Med 2015; 373: 2534–2548.
- [8] Sieper J, Deodhar A, Marzo‑Ortega H, et al. Secukinumab efficacy in anti‑TNF‑naive and anti‑TNF‑experienced subjects with active ankylosing spondylitis: results from the MEASURE 2 Study. Ann Rheum Dis 2016; publikováno on‑line 31AUG2016.
- [9] Kivitz A, Blanco R, Maradiaga M, et al. Secukinumab reduces sign and symptoms of active ankylosing spondylitis: results from a 16 week, randomised, placebo controlled phase 3 trial (abstract No 3287319). J Clin Rheumatol 2016; 22: 141.
- [10] Baraliakos X, Braun J, Sieper J, et al. Secukinumab reduces sakroiliac joint and spinal inflammation in patients with ankylosing spondylitis: MRI data from a phase 3 randomised, double‑blind, placebo‑controlled study (MEASURE 1) (abstract no. THU0233). Ann Rheum Dis 2015; 74(Suppl 10): 3939–3941.
- [11] Braun J, Baraliakos X, Deodhar S, et al. Effect of secukinumab, an interleukin‑17A inhibitor, on spinal radiographic changes through 2 years in patients with active ankylosing spondylitis: results of the phase 3 study, MEASURE 1. Ann Rheum Dis 2016; 75(Suppl 2): 52.
- [12] Mease PJ, McInnes IB, Kirkham B, et al. Secukinumab inhibition of interleukin‑17A in patients with psoriatic arthritis. N Engl J Med 2015; 373: 1329–1339.
- [13] McInnes I, Mease PJ, Kirkham B, et al. Secukinumab, a human anti‑interleukin‑17A monoclonal antibody, in patients with psoriatic arthritis (FUTURE 2): a randomised, double‑blind, placebo‑controlled, phase 3 trial. Lancet 2015; 386: 1137–1146.
- [14] Mease PJ, McInnes IB, Kirkham B, et al. Secukinumab provides sustained improvements in psoriatic arthritis: 2‑year efficacy and safety results from a phase 3 randomised ‚ double‑blind, placebo controlled trial (abstract no 2148). Arthritis Rheum 2015; 67(Suppl 10): 2576–2578.
- [15] van der Heijde D, Landewé RB, Mease PJ, et al. Brief report: Secukinumab provides significant and sustained inhibition of joint structural damage in a phase III study of active psoriatic arthritis. Arthritis Rheumatol 2016; 68: 1914–1921.
- [16] Kavanaugh A, McInnes IB, Mease PJ, et al. Efficacy of subcutaneous secukinumab in patients with active psoriatic arthritis stratified by prior tumor necrosis factor inhibitor use: Results from the randomized placebo‑controlled FUTURE 2 study. J Rheumatol 2016; 43: 1713–1737.
- [17] Shirley M, Scott LJ. Secukinumab: A review in psoriatic arthritis. Drugs 2016; publikováno on‑line 14JUNE2016.